
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.5. Электродные потенциалы
Электродом называют электрохимическую систему, которая состоит по меньшей мере из двух фаз, одна из которых является проводником первого рода, а другая – второго, причем в ней может протекать электрический ток; такую систему называют иногда также полуэлементом. Электродный процесс – это реакция между компонентами двух фаз, в результате которой электрический заряд переходит из одной фазы в другую.
Как отмечалось выше, в электрохимическом элементе участники реакции пространственно разделены и общую реакцию можно представить как сумму полуреакций, протекающих на отдельных электродах:
AA + ... + zF L LL + ...,
BB + ... L MM + ... + zF,
а ЭДС элемента – как сумму электродных потенциалов:
Е = 1
+ 2
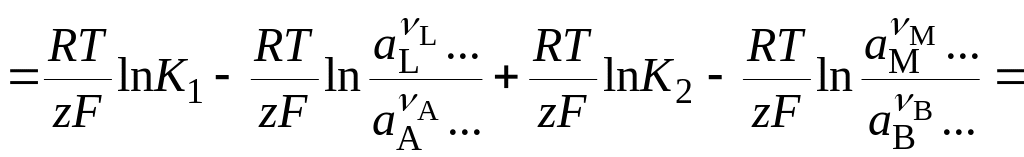
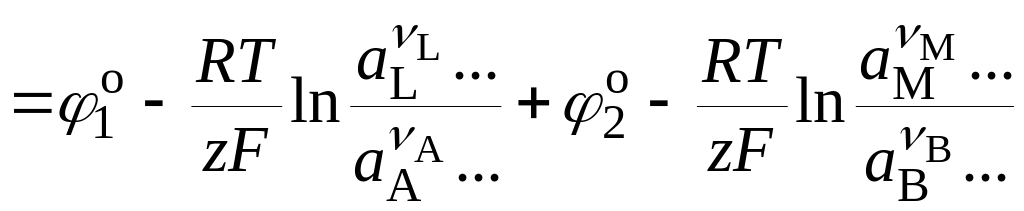 . (18.29)
. (18.29)
Отсюда следует, что уравнение для электродного потенциала имеет такой же вид, как и уравнение для ЭДС электрохимического элемента, но в него входят активности лишь тех веществ, которые принимают участие в электрохимической реакции на данном электроде. Величины o представляют собой стандартные электродные потенциалы, т.е. электродные потенциалы при условии, что активности всех участников реакции равны единице (ai = 1). Из уравнения (18.5) следует, что потенциал электрода
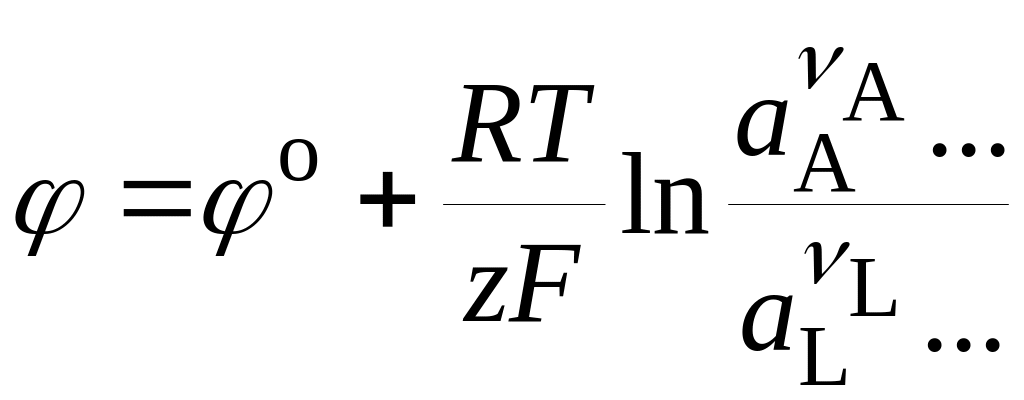 . (18.30)
. (18.30)
Это уравнение обычно называют уравнением Нернста для электродного потенциала.
Таблица 18.1
Стандартные электродные потенциалы в водных растворах при 298,15 К
Электрод |
о, В |
Электрод |
о, В |
Li+|Li |
– 3,045 |
Cu2+|Cu |
+ 0,337 |
K+|K |
– 2,925 |
Cu+|Cu |
+ 0,521 |
Na+|Na |
– 2,714 |
I–|I2 |
+ 0,536 |
Mg2+|Mg |
– 2,37 |
Pb4+|Pb |
+ 0,7 |
Al3+|Al |
– 1,66 |
|
+ 0,789 |
Zn2+|Zn |
– 0,763 |
Ag+|Ag |
+ 0,799 |
Fe2+|Fe |
– 0,440 |
Hg2+|Hg |
+ 0,854 |
Cd2+|Cd |
– 0,403 |
Br–|Br2 |
+ 1,065 |
Ni2+|Ni |
– 0,250 |
OH–|O2 |
+ 0,401 |
Pb2+|Pb |
– 0,126 |
Au3+|Au |
+ 1,29 |
H3O+|H2 |
0,000 |
Cl–|Cl2 |
+ 1,360 |
В действительности невозможно определить или рассчитать потенциал отдельно взятого электрода, поскольку он определяется разностью потенциалов между металлом электрода и раствором (гальвани-потенциал). Поэтому была введена условная шкала относительных величин, которые можно однозначно измерить. Эти величины называют электродными потенциалами.
Электродный потенциал определяют как ЭДС элемента, одним из электродов которого является исследуемый, а другим – подходящий электрод сравнения. В качестве электрода сравнения обычно используют стандартный водородный электрод при данной температуре. Стандартный водородный электрод – это электрод под давлением водорода 1,013.105 Па (1 атм) и активности ионов водорода в растворе, равной единице. Согласно международному соглашению о знаках, электродный потенциал равен ЭДС цепи, составленной из исследуемого электрода и стандартного водородного электрода, записанного слева. Если активность ионов в растворе с исследуемым электродом равна единице, то ЭДС такой цепи равна стандартному потенциалу электрода. Стандартный потенциал водородного электрода условно принят равным нулю во всех растворителях и при всех температурах (оН+/H 0). Это означает, что существует множество шкал электродных потенциалов (для каждого растворителя и каждой температуры), а сопоставление электродных потенциалов в разных шкалах возможно лишь после приведения шкал к какому-либо единому началу отсчета. В таблице 18.1 приведены стандартные потенциалы некоторых электродов в водных растворах при 298 К.
