
- •1. Кинематическое описание движения. Перемещение, скорость.
- •2. Ускорение при криволинейном движении: нормальное и тангенциальное ускорение. Плоское вращение. Угловая скорость, ускорение.
- •3. Связь между векторами скорости и угловой скорости материальной точки. Нормальное, тангенциальное и полное ускорение.
- •4. Степени свободы и обобщенные координаты. Число степеней свободы абсолютно твердого тела.
- •5. Основная задача динамики. Понятие состояния в механике. Законы Ньютона.
- •6. Система единиц си. Границы применимости классической механики.
- •7. Импульс, закон сохранения импульса. Применение закона сохранения импульса к абсолютно неупругому удару. Движение тел с переменной массой.
- •Движение тел с переменной массой.
- •8. Момент импульса. Закон сохранения момента импульса.
- •9. Момент силы. Основное уравнение динамики вращательного движения.
- •10. Силы в природе. Силы сухого и вязкого трения.
- •11. Упругая сила, закон Гука.
- •12. Консервативные и неконсервативные силы в механике. Потенциальная энергия.
- •13. Кинетическая энергия. Закон сохранения энергии в механике.
- •14. Закон всемирного тяготения. Движение в центральном поле. Космические скорости. Законы Кеплера.
- •15. Уравнение движения абсолютно твердого тела. Центр масс, примеры вычисления центра масс.
- •16. Плоское вращение абсолютно твердого тела и его кинетическая энергия.
- •17. Момент инерции тела и его физический смысл. Примеры вычисления момента инерции твердых тел. Теорема Штейнера.
- •18. Момент импульса твердого тела. Вектор угловой скорости и вектор момента импульса. Гироскопический эффект. Угловая скорость прецессии.
- •Гироскоп
- •19. Идеальная и вязкая жидкость. Гидростатика несжимаемой жидкости. Стационарное движение идеальной жидкости. Уравнение Бернулли.
- •20. Гидродинамика вязкой жидкости, коэффициент вязкости. Течение по трубе. Формула Пуазейля. Закон подобия. Формула Стокса. Турбулентность. Движение вязких жидкостей и газов
- •21. Основное уравнение молекулярно - кинетической теории идеального газа. Средняя кинетическая энергия поступательного движения молекулы.
- •22. Молекулярно - кинетический смысл температуры.
- •23. Внутренняя энергия идеального газа.
- •24.Теплоёмкость идеального газа при постоянном оъёме и давлении.
- •25. Статистические распределения. Вероятность и флуктуации.
- •26. Распределение Максвелла.
- •27. Средняя, среднеквадратичная и наиболее вероятная скорости газовых молекул.
- •28. Барометрическая формула. Распределение Больцмана.
- •29. Понятие о физической кинетике. Средняя длина свободного пробега, эффективный диаметр молекул и сечение рассеяния.
- •30. Вязкость, теплопроводность и диффузия в газах.
- •31. Обратимые и необратимые термодинамические процессы.
- •32. Первое начало термодинамики. Простейшие термодинамические процессы.
- •33. Кпд идеальной тепловой машины. Цикл Карно. Понятие термодинамической температуры.
- •34.Энтропия и ее термодинамический смысл. Второе начало термодинамики.
- •35. Уравнение Ван-дер-Вальса и его анализ. Экспериментальные изотермы.
- •36. Перегретая жидкость и перенасыщенный пар. Внутренняя энергия реального газа.
- •37.Эффект Джоуля - Томпсона. Сжижение газов.
- •38.Строение жидкостей. Силы поверхностного натяжения. Коэффициент поверхностного натяжения.
- •39. Давление под изогнутой поверхностью жидкости. Формула Лапласа.
- •40. Явление на границе жидкости и твердого тела. Краевой угол. Капиллярные явления.
- •41. Твердые тела. Аморфные и кристаллические тела.
- •42. Анизотропия кристаллов. Дефекты кристаллов.
- •43. Фазовые переходы первого и второго рода. Кривая фазового равновесия.
- •44. Фазовая диаграмма состояния вещества. Тройная точка. Уравнение Клайперона - Клаузиуса.
- •45. Уравнение гармонического колебания и его основные параметры.
- •46. Колебания груза под действием упругой силы.
- •47. Энергия гармонического колебания.
- •48. Физический и математический маятники. Приведенная длина и центр качания физического маятника.
- •49. Уравнение затухающих колебаний. Декремент затухания.
- •50. Действие периодической силы на затухающий гармонический осциллятор. Резонанс.
- •55. Волновое уравнение. Фазовая скорость волны в твердых телах и жидкостях.
- •56.Скорость звука в газах.
- •57. Передача информации с помощью волн.
- •58. Групповая скорость волны. Дисперсия.
- •59.Стоячие волны. Колебания струны.
- •60. Громкость и высота тона звука.
- •61. Эффект Доплера.
35. Уравнение Ван-дер-Вальса и его анализ. Экспериментальные изотермы.
Для описания
реальных газов необходимо учесть
взаимодействие между молекулами и
размерами молекул. Для этого учтем, что
за счет взаимодействия молекулы
испытывают силы притяжения друг к другу,
что приводит к уменьшению давления по
сравнению с расчетным соответствующая
добавка к давлению имеет вид:
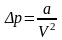 ,
,
Где a-первая постоянная Ван-дер-Вальса, характер. взаимодействие.
Для учета размеров молекул предложим, что не весь объем сосуда доступен для их движения. Поправка к объему обозначается b-вторая постоянная Ван-дер-Вальса. С учетом поправок уравнение Ван-дер-Вальса для 1 моль реального газа принимает вид:
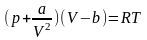 ,
R-газовая постоянная.
,
R-газовая постоянная.
Изотерма Ван-дер-Вальса представляет собой график, соотв. Процессы при T=const. Из уравнения Ван-дер-Вальса следует, что этот график является кубической параболой и в осях pV имеет вид
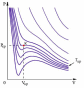
Существует критическая температура при которой область перегибов на графике будет отсутствовать . Т.е. при температуре больше и = критической не возможен переход из газообразного в жидкое состояние. Область перегибов на графике характеризует газовые переходы (испарение, конденсацию), реальные изотермы точек перегиба не имеют и выглядят следующим образом. При этом участок AB изотермы называется переохлажденным газом, CD перегретой жидкостью.
36. Перегретая жидкость и перенасыщенный пар. Внутренняя энергия реального газа.
37.Эффект Джоуля - Томпсона. Сжижение газов.
Эффект Джоуля–Томпсона заключается в том, что при проведении адиабатного процесса с реальным газом происходит изменение его температуры в соотв. с формулой
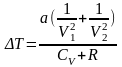 ,
где CV-молярная
теплоемкость при постоянном объеме
,
где CV-молярная
теплоемкость при постоянном объеме
Эффект Джоуля–Томпсона используется для охлаждения реальных газов при прожимании газа через пористый материал ( мятие газа).
Сжатие газов - перевод их в жидкое состояние – осущ. охлаждением газов ниже темтературы кипения при данном давлении. Уменьшением объема это достигается только в том случае, если температура газа ниже критической. Для сжижения газов с критической температурой выше 223 К производится их сжатие в компрессоре с последующей конденсацией в теплообменнике.
38.Строение жидкостей. Силы поверхностного натяжения. Коэффициент поверхностного натяжения.
Жидкость – агрегатное
состояние вещества, при котором оно
сохраняет объем, но не сохраняет форму.
Обладает свойством текучести.
Пове́рхностное натяже́ние —
термодинамическая характеристика
поверхности раздела двух находящихся
в равновесии фаз. Силы поверхностного
натяжения рассчитываются по формуле
F= 𝛔l,
где l – периметр соприкосновения жидкости
и твердого тела. Сила поверхностного
натяжения направлена так , чтобы сокращать
площадь свободной поверхности. Между
молекулами жидкости существуют силы
натяжения, поэтому молекула на поверхности
жидкости стремится притянуться к
молекулам, находящимся внутри и в
результате поверхность жидкость всегда
является натянутой. Для увеличения
внешней поверхности жидкости необходимо
совершать работу:  ,
,
 -коэффициент
поверхностного натяжения.
Коэффициент поверхностного натяжения
жидкости уменьшается с ростом температуры.
Работу
изотермического образования 1 м2
поверхности называют поверхностным
натяжением данной жидкости :
-коэффициент
поверхностного натяжения.
Коэффициент поверхностного натяжения
жидкости уменьшается с ростом температуры.
Работу
изотермического образования 1 м2
поверхности называют поверхностным
натяжением данной жидкости : 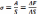 ,
где F-изменение свободной поверхности
энергии, S –изменение площади поверхностного
слоя.
,
где F-изменение свободной поверхности
энергии, S –изменение площади поверхностного
слоя.
