
22. Изобразите цикл Карно в осях (u,s), где u – внутренняя энергия газа; s – энтропия.
Решение:
-

Цикл Карно в осях (P,V): процессы (1→2) и (3→4) – изотермы, при температурах, соответственно, Т и Т (Т > Т ).
Внутренняя энергия идеального газа
U = C
 T
(C
–
теплоемкость при постоянном давлении).
Следовательно, изотермы (1→2) и (3→4)
изобразятся горизонтальными отрезками
U
= const,
U
= const
(U
> U
)
– на рисунке 2.
T
(C
–
теплоемкость при постоянном давлении).
Следовательно, изотермы (1→2) и (3→4)
изобразятся горизонтальными отрезками
U
= const,
U
= const
(U
> U
)
– на рисунке 2.
Адиабаты (2→3) и (4→1) на рисунке 1 изобразятся вертикальными отрезками S = const, S = const (S > S ), т.к. адиабатический процесс – это процесс при постоянной энтропии (изэнтропа).
Цикл Карно на рисунке 2 – прямоугольник со сторонами, параллельными осям координат. Состояние (1) – при большей температуре и меньшей энтропии, т.к. в процессе (1→2) к системе подводится тепло Q > 0, т.е. энтропия возрастает. Состояние (2) – большая температура и большая энтропия. И т.д.
Килограмм кислорода первоначально заключен в объеме V = 0,200 м под давлением p = 5,00∙10 Па. Затем газ расширился ,в результате чего объем газа стал равным V = 0,500 м , а давление p = 2,00∙10 Па. Определить приращение:
а) энтропии газа ΔS;
б) внутренней энергии ΔU.
-
m
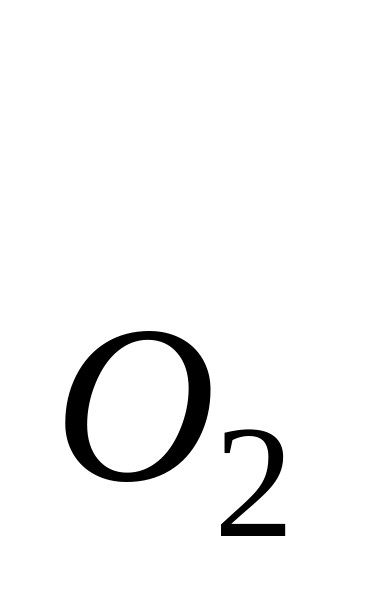 = 1 кг
= 1 кгV = 0,200 м
p = 5,00∙10 Па
V = 0,500 м
p = 2,00∙10 Па
Кислород – двухатомный газ, следовательно, число степеней свободы молекулы i = 5. молярная масса кислорода μ = 32 г/моль. Запишем определение энтропии:
 .
(1)
.
(1)Первое начало термодинамики:
 .
(2)
.
(2)ΔS – ?
ΔU – ?
Подставим (2) в (1):
 .
(3)
.
(3)
Из уравнения
Менделеева-Клапейрона найдем
![]() :
:
![]() ;
;
![]() .
.
Тогда:
 .
(4)
.
(4)
Подставим (4) в (3) и получим:
![]() .
.
Отношение
![]() можно найти следующим образом: запишем
уравнения Менделеева-Клапейрона для
начального и конечного состояний газа:
можно найти следующим образом: запишем
уравнения Менделеева-Клапейрона для
начального и конечного состояний газа:
![]() ;
(А)
;
(А)
![]() .
(В)
.
(В)
Разделим (В) на (А):
![]() .
.
Окончательный результат:
![]() .
(5)
.
(5)
Подставляя численные
значения в (5), обнаруживаем, что
![]() (0,200∙5,00∙10
= 0,500∙2,00∙10
),
т.е
(0,200∙5,00∙10
= 0,500∙2,00∙10
),
т.е
![]() – температура газа не изменилась, не
изменилась, следовательно, и внутренняя
энергия (
)
газа, ΔU
= 0. вычислим ΔS
по формуле (5):
– температура газа не изменилась, не
изменилась, следовательно, и внутренняя
энергия (
)
газа, ΔU
= 0. вычислим ΔS
по формуле (5):
 .
.
Сосуд разделен на две равные части перегородкой с закрытым пробкой отверстием. В одной из половин сосуда содержится моль идеального газа, в другой половине сосуда – вакуум. Пробку удаляют и газ распространяется на весь объем. Считая процесс адиабатическим, определить:
а) приращение внутренней энергии газа ΔU;
б) приращение энтропии газа ΔS.
-
V = 2V
При расширении идеального газа в пустоту работа газа
А = 0. Из первого начала термодинамики
Q = ΔU+A
для адиабатического процесса следует
ΔU = 0. (1)
ΔU – ?
ΔS – ?
Изменение энтропии – по определению:
; (2)
Запишем для δQ первое начало термодинамики:
![]() (3)
(3)
Расширение даже идеального газа в пустоту – процесс необратимый, т.е. ΔS > 0. Подставим (3) в (2) с учетом (1):
![]() .
(4)
.
(4)
Из уравнения Менделеева-Клапейрона для моля идеального газа (pV = RT) найдем:
![]() ;
(5)
;
(5)
Подставим (5) в (4):
 .
.
Имеется сосуд, разделенный перегородкой на две части. В одной из них находится ν молей одного газа, в другой – ν молей другого газа. Оба газа идеальные. Температура и давление обоих газов одинаковые. Перегородки убирают и газы полностью перемешиваются. Найти приращение энтропии ΔS.
-
p = p
T = T
ν
ν
Первоначально первый газ занимал объем V , второй газ – объем V . Когда убирают перегородку, объем каждого газа становится V + V .
Изменение энтропии, по определению,
; (1)
ΔS – ?
Первое начало термодинамики:
(2)
Внутренняя энергия
газа U
= C![]() T
(C
– теплоемкость при постоянном давлении),
а т.к. T
не меняется,
T
(C
– теплоемкость при постоянном давлении),
а т.к. T
не меняется,
![]() .
(3)
.
(3)
Подставим (2) в (1) с учетом (3):
. (4)
Найдем из уравнения Менделеева-Клапейрона pV = νRT:
![]() ;
(5)
;
(5)
Подставим (5) в (4):
![]() .
(6)
.
(6)
Найти приращение энтропии ∆S при превращении массы m=1,00 кг пара, находившегося при температуре 100°C, в воду и последующем охлаждении воды до температуры 20°С. Теплоемкость воды считать не зависящей от температуры. Конденсация происходит при давлении, равном 1 атм.
-
m=1,00кг
t1=100°C
t2=20°C
p=1 атм
Cводы=4,2

r=2250

Превращение пара при температуре t1 в воду температурой t2 описывается двумя процессами:
1) Конденсация пара при t1;
2) Охлаждение воды от t1 до t2.
Изменение энтропии по определению
 (1)
(1)
∆S−?
1)Конденсация пара идет при постоянной температуре, т.е.
![]() (2)
(2)
Где Q1 – количество тепла, выделившегося при конденсации, Q1= −mr (r – удельная теплота преобразования). Соотношение (2) примет вид:
![]() (3)
(3)
2) При охлаждении жидкости температура воды меняется, δQ2=mcdT, - количество тепла, отданного при понижении температуры на dT. Соотношение (1) примет вид
 (4)
(4)
Так как T2<T1, очевидно, что ∆S2<0, объединим (3) и (4):
![]() (5)
(5)
Учтем, что
T1=(t1+273)K;
T2=(t2+273)K.
Подставив численные значения в (5),
получим ∆S=
−7,0![]() − энтропия системы понижается (S2<S1),
так как при конденсации пара и охлаждении
воды система отдает
тепло.
− энтропия системы понижается (S2<S1),
так как при конденсации пара и охлаждении
воды система отдает
тепло.
Найти приращение энтропии ∆S при превращении массы m=200 г льда, находившегося при температуре −10,7°C, в воду при 0°С. Теплоемкость льда считать не зависящей от температуры. Температуру плавления принять равной 273К.
-
m=200г
t1= −10,7°С
t2=273K
сл=2,1

λ=333

Изменение энтропии
∆S=∆S1+∆S2 , (1)
где ∆S1 – изменение энтропии при нагревании льда от t1 до 0°С (273К); ∆S2 – изменение энтропии при таянии льда при температуре 0°С.
Изменение энтропии по определению:
(2)
∆S−?
1)Нагревание льда идет с изменением температуры, при этом количество тепла, необходимое для повышения температуры на dT, равно δQ=mcdT (сл – удельная теплоемкость льда).Соотношение (2) примет вид:
 (3)
(3)
2) Плавление льда идет при постоянной температуре T2, соотношение (2) примет вид:
![]() (4′)
(4′)
где Qпл = mλ – количество тепла, необходимое для плавления массы m при температуре плавления (λ – удельная теплота плавления). Соотношение (4′) примет вид:
![]() (4)
(4)
Подставим (3) и (4) в (1):
![]() (5)
(5)
Подставим в (5) численные значения, учитывая, что Т1=(273−10,7)К:
∆S=260![]() ‒ энтропия системы увеличилась, так
как к системе подводили тепло.
‒ энтропия системы увеличилась, так
как к системе подводили тепло.
В ограниченном интервале температур приращение энтропии некоторого вещества пропорционально приращению температуры: ∆S=α∆T. Как зависит от температуры теплоемкость С вещества в том же интервале?
-
∆S=α∆T
По определению изменение энтропии
 (1)
(1)С(Т)−?
Для малого приращения dS можно записать
![]() (2)
(2)
По условию задачи
![]() .
(3)
.
(3)
Приравниваем правые части (2) и (3):
![]() (4)
(4)
Теплоемкость, по определению,
![]() (5)
(5)
Из (4) получаем
![]() − теплоемкость
линейно зависит от температуры.
− теплоемкость
линейно зависит от температуры.
Найти статистический вес (термодинамическую вероятность) наиболее вероятного распределения N одинаковых молекул по двум одинаковым половинам сосуда. Рассмотреть случаи N=10, N=6, N=2.
