
- •Оглавление
- •Раздел I. Теоретические вопросы
- •Раздел II. Лабораторные работы
- •Раздел I. Теоретические вопросы
- •Тема 14: Аминокислоты, полипептиды, белки
- •Тема 15. Углеводы I. Моносахариды
- •Тема 16. Углеводы II. Полисахариды
- •Тема 17. Липиды
- •Тема 18. Нуклеотиды, нуклеиновые кислоты
- •Тема 19. Ароматические диазосоединения. Азокрасители
- •Тема 20. Практикум - Синтез ацетона
- •1. Обратить особое внимание на тщательное изучение и проработку всех вышеизложенных вопросов темы!
- •Тема 21. Практикум - Синтез ацетилсалициловой кислоты
- •1. Обратить особое внимание на тщательное изучение и проработку всех вышеизложенных вопросов темы!
- •Тема 22. Пятичленные гетероциклы
- •1) Метилфурана 2) метилпиррола 3) метилпиразола 4) метилимидазола
- •Тема 23. Шестичленные гетероциклы
- •Тема 24. Конденсированные гетероциклы
- •Тема 25. Алкалоиды
- •Тема 26. Терпены
- •Тема 27. Стероиды
- •Раздел II. Лабораторные работы
- •1. Общие реакции на алкалоиды
- •2. Талейохинная проба
ГОУ ВПО УРАЛЬСКАЯ ГОСУДАРСТВЕННАЯ
МЕДИЦИНСКАЯ АКАДЕМИЯ
Кафедра химии фармацевтического факультета
ПРАКТИКУМ
ПО ОРГАНИЧЕСКОЙ ХИМИИ
методические указания к практическим занятиям для студентов дневной формы обучения
фармацевтического факультета
(часть 2)
Свердловск
2011
ГОУ ВПО "Уральская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию"
Кафедра химии фармацевтического факультета
органическая химия
методические указания к практическим занятиям для студентов дневной формы обучения фармацевтического факультета
(часть 2)
Свердловск
2010
Методическое пособие предназначено для организации самостоятельной работы студентов. В нем приведены контрольные вопросы, отражающие содержание всех тем курса органической химии, а также даны задания для самостоятельной подготовки к занятиям. Пособие является учебным материалом для студентов II курса фармацевтического факультета.
Составитель: доцент ГОЛОМОЛЗИН Б.В.
Редактор: профессор ТХАЙ В.Д.
Оглавление
Раздел I. Теоретические вопросы
|
стр. |
Тема 14. Аминокислоты, полипептиды, белки |
|
Тема 15. Углеводы I. Моносахариды |
|
Тема 16. Углеводы II. Полисахариды |
|
Тема 17. Липиды |
|
Тема 18. Нуклеотиды, нуклеиновые кислоты |
|
Тема 19. Ароматические диазосоединения. Азокрасители. |
|
Тема 20. Практикум – Синтез ацетона |
|
Тема 21. Практикум – Синтез ацетилсалициловой кислоты |
|
Тема 22. Пятичленные гетероциклы |
|
Тема 23. Шестичленные гетероциклы |
|
Тема 24. Конденсированные гетероциклы |
|
Тема 25. Алкалоиды |
|
Тема 26. Терпены |
|
Тема 27. Стероиды |
|
Раздел II. Лабораторные работы
|
стр. |
Лаб. р. №10. Качественные реакции на аминокислоты и белки |
|
Лаб. р. №11. Качественные реакции на моносахариды |
|
Лаб. р. №12. Качественная реакция на крахмал |
|
Лаб. р. №13. Получение фенилдиазонийхлорида и его реакции |
|
Лаб. р. №14. Синтез ацетона |
|
Лаб. р. №15. Синтез ацетилсалициловой кислоты |
|
Лаб. р. №16. Кислотные свойства мочевой кислоты |
|
Лаб. р. №17. Качественная реакция обнаружения кофеина |
|
Лаб. р. №18. Качественные реакции на алкалоиды |
|
Раздел I. Теоретические вопросы
Тема 14: Аминокислоты, полипептиды, белки
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ ТЕМЫ:
1. Строение аминокислот, их изомерия и физические свойства, биологические функции. Особенности строения и изомерии природных аминокислот, участвующих в построении полипептидов и белков. Классификация природных аминокислот по признакам химического строения. Заменимые и незаменимые аминокислоты.
2. Поведение аминокислот в водных растворах: амфотерность, образование биполярных ионов, изоэлектрическая точка, изменение заряда и электрофоретической подвижности в зависимости от рН среды.
3. Химические свойства аминокислот:
3.1. Образование солей с кислотами и основаниями, образование хелатов.
3.2. Реакции аминогруппы: ацилирование (реакция Шоттен-Баумана), качественная реакция с нингидрином.
3.3. Реакции карбоксильной группы: образование хлорангидридов, сложных эфиров, амидов; декарбоксилирование.
3.4. Реакции -аминокислот при нагревании.
4. Основные пути синтеза аминокислот: аммонолиз -галогенкарбоновых кислот (реакция Геля – Фольгарда), и циангидриновый синтез из альдегидов (реакция Зелинского).
5. Применение аминокислот и их производных в качестве лекарственных препаратов (гистамин, аспарагиновая и глутаминовая кислоты, ГАМК, цистеин, метионин, тирамин, триптофан, глицин, -аминокапроновая кислота).
6. Определение понятия пептидов и белков, общая характеристика их биологической роли.
7. Пептидная связь и пептидная группа, их электронное и пространственное строение. Первичная структура белка, понятие о методах её определения.
8. Химические свойства пептидов и белков: амфотерность, заряд молекулы, его зависимость от рН, изоэлектрическая точка. Классификация белков по их способности к ионизации. Поверхностно-активные свойства. Растворимость белков, её зависимость от молекулярной массы, заряда и сольватации молекулы. Качественные реакции на пептиды и белки. Методы разделения и очистки белков.
9. Вторичная структура: α-спираль, β-структура (складчатый лист), стабилизирующие их связи.
10. Третичная структура: глобула, формирующие взаимодействия – ионное, гидрофобное, водородные и дисульфидные связи. Различие пептидов и белков. Четвертичная структура: агрегат глобулярных субъединиц. Биологическое значение четвертичной структуры. Определяющая роль первичной структуры в формировании вторичной, третичной и четвертичной структур.
11. Примеры лекарственных препаратов, производных аминокислот, полипептидов и белков:
аминокислоты – глицин, аспаркам, аминалон; антибиотики – пенициллины, грамицидины, актиномицины; гормоны – инсулин, вазопрессин, окситоцин; ферменты – трипсин, рибонуклеаза.
ПИСЬМЕННОЕ ДОМАШНЕЕ ЗАДАНИЕ:
1. Изучите строение и номенклатуру природных аминокислот, из которых строятся цепи пелипептидов и белков (см. таблицу в учебнике: Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия – М: ДРОФА, 2007 – с. 317)
2. Запишите схемы диссоциации аспарагиновой кислоты, лизина и фенилаланина. При каком значении рН они существуют в виде биполярных ионов?
3. Напишите схемы следующих реакций:
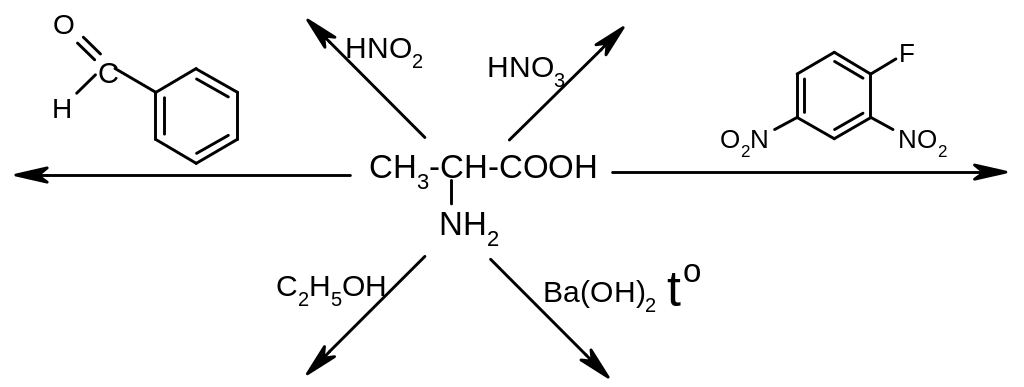
4. Какие соединения образуются при нагревании , , -аминомасляных кислот?
5. Напишите схемы следующих реакций, приведите названия продуктов:
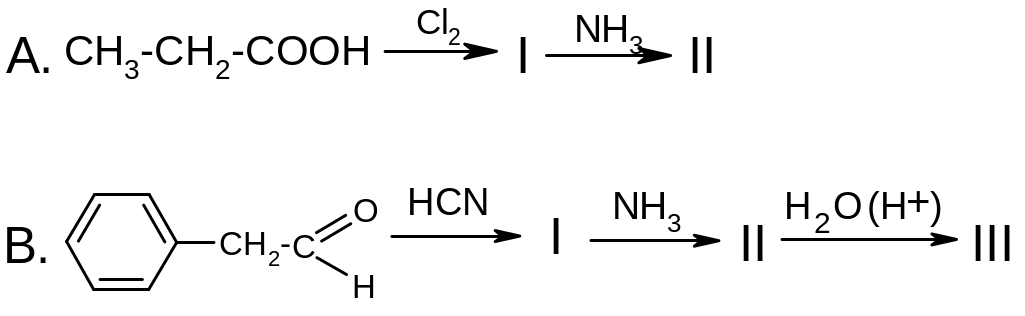
6. Проанализируйте формулу 6-аминопенициллановой кислоты:
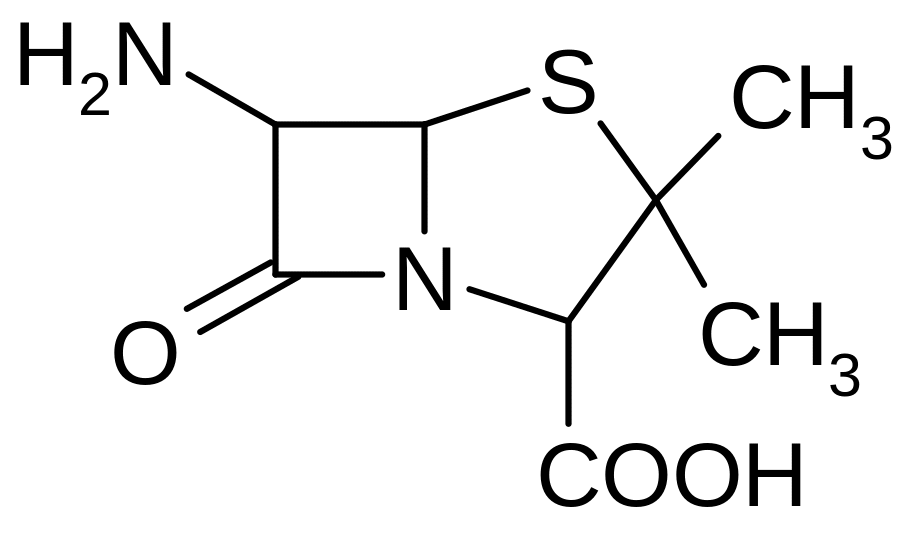
Объясните трактовку этого соединения как дипептида, образованного двумя аминокислотами (какими?).
7. Имеется раствор, содержащий три белка со значениями pI = 4,5; 7,0; 8,9. Какие заряды имеют молекулы этих белков при рН = 7? Предложите метод их разделения.
8. К раствору белка в 0.1 н HCl прибавляют по каплям раствор NaOH (титрование). В определенной точке титрования (какой?) происходит помутнение раствора, а при дальнейшем прибавлении щелочи осадок вновь растворяется. Объясните эти явления.
9. Напишите формулы следующих полипептидов:
(I) –Асп-Гли-Прол-Лиз-Цис-Гис- ;
(II) –Лей-Тир-Илей-Фен-Три-Сер-
а) обозначьте связи, стабилизирующие α-спиральную вторичную структуру этих цепей;
б) приведите схемы качественных реакций, которыми можно определить эти пептиды. Какой качественной реакцией можно отличить их друг от друга?
ПРАКТИЧЕСКАЯ ЧАСТЬ:
Лабораторная работа №10 Качественные реакции на аминокислоты и белки.
ЛИТЕРАТУРА ДЛЯ ПОДГОТОВКИ:
Основная
1. Лекция "Строение и свойства аминокислот, полипептидов и белков".
2. Тюкавкина Н. А., Бауков Ю. И., Биоорганическая химия – М: ДРОФА, 2007 – с. 316-345.
Дополнительная:
1. Овчинников Ю.А., Биоорганическая химия – М. Просвещение, 1987 г., с. 27-176.
