
- •2.Физико-химические свойства углеводородосодержащих веществ и методы их расчета
- •2.1. Контроль качества нефтей
- •2.2. Классификация нефтей
- •2.3. Плотность и молекулярная масса
- •2.4. Вязкость нефтей и нефтепродуктов
- •2.5. Особенности свойств нефтеконденсатных смесей
- •Температура, с
- •2.6. Фазовые состояния углеводородных систем при изменении давления и температуры
- •2.6.1. Критические параметры углеводородов
- •Давление
- •2.6.2. Давление насыщенных паров
- •2.7. Теплофизические свойства нефти и нефтепродуктов в процессах тепломассопереноса
Давление
Рис. 2.15. Диаграмма фазового состояния однокомпонентных
и азеотропных веществ
При высоких давлениях многие твердые вещества проявляют полиморфизм, т.е. способность существовать в двух или нескольких кристаллических структурах, поэтому вблизи кривой А-Т-Д возможно существование так называемых метастабильных фаз. Исключительную сложность фазовых переходов можно подтвердить следующими примерами. Известно, что при атмосферном давлении лед плавится при температуре 0ºС, а вот при давлении, равном 4000 МПа – при температуре 200ºС. Приведенное же выше определение критической точки также не всегда справедливо, и в ряде случаев сосуществование двух фаз можно наблюдать даже при температурах и давлениях, превышающих критические. Такого рода поведение смесей называют реверсивным. Вблизи критической точки многие физико-химические свойства приобретают аномальный оттенок. Термин реверсивный относится к таким парожидкостным системам, в которых первоначально объем сжижения возрастает вместе с давлением, но после определенного его значения уменьшается и может даже равняться нулю.
З
85
2.6.2. Давление насыщенных паров
Анализируя материал предыдущего раздела можно сформулировать другое определение давления насыщенных паров – это давление пара, находящегося в равновесии с жидкостью при данных термодинамических условиях и соотношении объемов фаз. Такая характеристика позволяет судить о склонности нефтей и нефтепродуктов к образованию паровых пробок, например в трубопроводе, потерях при испарении и хранении в резервуарах и т.д., и является основным показателем испаряемости и стабильности товарных нефтепродуктов.
(2.38)![]()
где рST – давление насыщенных паров при температуре Т; рSTo – давление насыщенных паров при известной температуре То; k – эмпирический коэффициент. Давление рS паров индивидуальных углеводородов и нефтяных фракций можно определить, пользуясь различными графиками или например табл. 2.10.
Таблица 2.10
Давление насыщенных паров алканов (рАБС)
ºС |
Давление, МПа |
||||||||
С2Н5 |
С3Н8 |
i-С4Н16 |
С4Н10 |
i-С5Н10 |
C5Н10 |
С6Н14 |
С7Н16 |
С8Н18 |
|
-10 |
1,786 |
0,332 |
0,105 |
0,087 |
- |
- |
- |
- |
- |
-5 |
2,040 |
0,392 |
0,125 |
0,082 |
0,041 |
- |
- |
- |
- |
0 |
2,308 |
0,448 |
0,150 |
0,100 |
0,033 |
0,023 |
0,003 |
- |
- |
5 |
2,502 |
0,332 |
0,179 |
0,121 |
0,051 |
0,029 |
- |
- |
- |
10 |
2,922 |
0,617 |
0,211 |
0,143 |
0,075 |
0,036 |
0,010 |
0,003 |
0,001 |
15 |
3,253 |
0,711 |
0,247 |
0,171 |
0,062 |
0,046 |
0,012 |
0,004 |
- |
20 |
3,672 |
0,817 |
0,289 |
0,197 |
0,105 |
0,055 |
0,016 |
0,005 |
0,002 |
25 |
4,051 |
0,934 |
0,334 |
0,238 |
0,089 |
0,066 |
0,020 |
0,005 |
- |
30 |
4,504 |
1,050 |
0,386 |
0,274 |
0,145 |
0,079 |
0,024 |
0,008 |
0,003 |
35 |
4,795 |
1,204 |
0,443 |
0,318 |
0,125 |
0,084 |
- |
0,010 |
- |
40 |
tкип |
1,353 |
0,508 |
0,365 |
- |
0,112 |
0,037 |
0,012 |
0,004 |
45 |
- |
1,527 |
0,579 |
0,420 |
0,171 |
0,131 |
0,040 |
0,015 |
- |
Д
(2.39)
86![]()
![]() (2.40)
(2.40)
в состав паровой фазы, равно произведению мольной концентрации компонента в паровой фазе на общее давление, т.е.
рi = рSyi. (2.41)
Таким образом, из уравнений (2.40÷2.41) имеем
хiрSi = рSyi. (2.42)
Уравнение (2.42) известно под названием объединенного закона Дальтона – Рауля, согласно которому можно сделать важный вывод – в состоянии равновесия парциальное давление любого компонента смеси в паровой фазе равно парциальному давлению того же компонента в жидкости.
Из приведенного уравнения следует, что
рSi/pS = yi/xi = ki = const
или
рSi = kpiрS и yi = kpixi. (2.43)
Коэффициент kрi, который называют константой равновесия, у отдельных компонентов зависит от температуры и давления и определяется, как правило, из специально составленных графиков. Приведенные уравнения позволяют, например, найти состав газовой фазы по известному составу жидкостей и наоборот.
Константы равновесия (в зарубежной литературе больше известны как константы фазового распределения) дают возможность прогнозировать материальный баланс многокомпонентных двухфазных систем (концентрации компонентов в разных фазах) при условии, если заданы давление и температура и известна также молярная концентрация i-го компонента в однофазном состоянии xi0.
Для любого компонента число молей в двух фазах определяется как сумма Niг и Niж, т.е. Ni0 = Niг + Niж. Отсюда молярная концентрация:
xi0 = уiг + хiж,
где г и ж – числа, показывающие соответственно, какая доля общего количества молей находится в газообразном и жидком состоянии (г + ж= 1). На практике при расчете ж используют метод последовательного приближения, легко реализуемого с помощью персонального компьютера. При этом полагают, что xi = 1.
87
 Учитывая,
что уi/xi = 1,
можно получить следующее выражение для
концентрации i-го компонента в жидкой
и газообразной фазах:
Учитывая,
что уi/xi = 1,
можно получить следующее выражение для
концентрации i-го компонента в жидкой
и газообразной фазах:
В двухкомпонентной системе равновесные составы могут быть определены значительно проще.
![]() а) для
жидкой фазы:
а) для
жидкой фазы:
![]() б) для
газообразной фазы:
б) для
газообразной фазы:
Приоритет в исследовании констант фазового равновесия углеводородов принадлежит американскому нефтяному институту АРJ, диаграммы которого широко используются в нефтепереработке. Известна также методика NGPSA, позволяющая определить значение kр при температурах, достигающих 430С. Опубликованные в печати варианты этих методик весьма сложны и неудобны для практического использования, а варианты компьютеризации схем являются собственностью разработчиков: Тодда, Лесли, Доулинга, Сталла, Соавва, Шервуда и др. Можно отметить публикации отечественных авторов: А.И. Гриценко, Г.Р. Гуревича, В.П. Мамуны, Т.Д. Островского, Г.М. Ярышева, и др. В Сибирском научно-исследовательском институте (СибНИИНП) Шиловым В.И. впервые экспериментально подтвержден метод определения kp в зависимости от молекулярной массы различных нефтей Западной Сибири применительно к условиям нефтепромыслов с высокими значениями абсолютного давления со средней погрешностью 13,8%. Максимальное отклонение 44% установлено для нормального октана.
Д
88
при статистической обработке большого объема информации в ТюмГНГУ были разработаны методики расчета коэффициента kp при низких давлениях (0,10,2 МПа) и температурах от 273 до 330 К. Для алканов получена зависимость
lg kp = 6,8 – 2,7nH + (2000 + 540nH)T-1 – р/рат, (2.44)
для алкенов и аренов рекомендуется следующая формула
lg kp = 6,8 - 2,7nH + 1990[1 + 0,302nH – 9,95(nH - nHФ)nНФ-1]T-1 – р/рат (2.45)
где nH – число атомов водорода у алканов; nНФ – число атомов водорода у нафтенов (цикланов) или у аренов; р и рат – абсолютное и атмосферное давление, соответственно.
В предложенных уравнениях (2.44, 2.45) впервые использован количественный состав водорода, определяющий, по мнению авторов, летучесть нефтяной фракции или конденсата. Это предположение в значительной степени упрощает соответствующие расчеты по сравнению с зарубежными аналогами.
Закономерность изменения коэффициентов фазового распределения компонентов kрi от температуры системы t, заданная с помощью экспериментальных данных, оказалась близкой к экспоненциальной
![]() .
(2.46)
.
(2.46)
Для нахождения коэффициентов Ai и Ci разработаны программы на ПЭВМ, реализующая вышеописанный метод нелинейной регрессии. Использование разработанного алгоритма оказалось весьма удобным и эффективным при обработке автором настоящей работы результатов последующих аналогичных экспериментальных исследований, описанных в следующих главах. В качестве примера в табл. 2.11 приведены значения коэффициентов полученной зависимости (2.46) для чистых компонентов смеси.
Таблица 2.11
Значения коэффициентов для чистых углеводородов
Коэффи-циенты |
Компонент cмеси |
|||||||
CH4 |
C2H6 |
C3H8 |
iC4H10 |
C4H10 |
iC5H12 |
C5H12 |
C6H14 |
|
Аi |
127,14 |
17,31 |
4,55 |
1,57 |
1,08 |
0,32 |
0,24 |
0,055 |
Сi |
0,324 |
0,529 |
0,622 |
0,757 |
0,811 |
0,973 |
1,027 |
1,270 |
Закономерность изменения коэффициентов фазового распределения kрi узких фракций от температуры системы t, также близка к экспоненте и удовлетворительно аппроксимируется следующей функцией:
![]() , (2.47)
, (2.47)
г
89
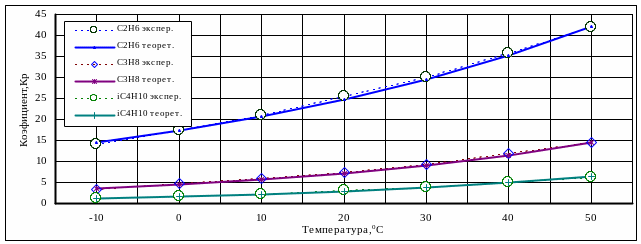
регрессионные модели (2.45), (2.46) адекватны по критерию Фишера и характеризуются малой погрешностью расчета (не более 5÷15%) с коэффициентом множественной корреляции R = 0,97. В качестве примера для ряда углеводородов на рис. 2.16 показано графически отклонение расчетных значений коэффициента фазового распределения kрi от экспериментальных.
С повышением температуры и общего давления давление насыщенных паров отдельных компонентов смеси существенно увеличивается, дополнительно характеризуя отклонение от идеального газа. Таким образом, в уравнения, характеризующие состояние и соотношения паровоздушной среды, Л.Г. Льюисом (1901 г.) была введена величина фугитивность f, значение которой приближается к давлению насыщенных паров при бесконечном уменьшении последней, т.е.
![]() (2.48)
(2.48)
В![]() ряде случаев целесообразно использовать
соотношение фугитивности и давления
насыщенных паров, называемое коэффициентом
активности вещества аФ
(в зарубежной литературе часто
встречается под названием коэффициента
летучести):
ряде случаев целесообразно использовать
соотношение фугитивности и давления
насыщенных паров, называемое коэффициентом
активности вещества аФ
(в зарубежной литературе часто
встречается под названием коэффициента
летучести):
Коэффициент фугитивности показывает, во сколько раз фугитивность больше давления насыщенных паров и более точно выражает стремление вещества переходить из жидкой фазы в паровую. Для инженерных расчетов обычно используют зависимость аФ от приведенных рПР и ТПР.
 При
отсутствии равновесия отношение
фугитивности жидкости к фугитивности
пара можно определить по уравнению
При
отсутствии равновесия отношение
фугитивности жидкости к фугитивности
пара можно определить по уравнению
где fЖ – фугитивность компонента в чистом виде при давлении р и температуре Т; fП – фугитивность компонента при давлении насыщенного пара; р – давление смеси; рS – давление насыщенных паров компонента.
К понятию фугитивности легко прийти путем анализа уравнений состояния идеального газа при постоянной температуре:
Vdр = RT d(ln р) = RT d(ln f).
90
Рис. 2.16. Отклонение
расчетных значений коэффициента
фазового распределения от экспериментальных
91

![]() Так
как аФ = 1 при р = 0, то с
учетом (2.37) можно определить абсолютное
значение коэффициента фугитивности:
Так
как аФ = 1 при р = 0, то с
учетом (2.37) можно определить абсолютное
значение коэффициента фугитивности:
Таким образом, очевидно, что интегрируемая функция представляет собой отклонения от поведения идеального газа и при р = 0 также стремится к нулю.
Фазовые превращения (переход из жидкого состояния в газообразное) в условиях транспорта и хранения таких многокомпонентных веществ, как нефть и нефтепродукты, вследствие исключительной сложности их состава протекают значительно сложнее, чем химически однородных веществ. В процессе испарения постепенно испаряются более легкие фракции, в результате чего жидкая фаза утяжеляется. Таким образом, в течение процесса изменяются и парциальные давления индивидуальных углеводородов, общее давление насыщенного пара нефтепродуктов всегда выше на 1030%, чем следовало бы ожидать из закона аддитивности. Напомним, что аддитивность – свойство ряда химических веществ, состоящее в том, что значение величины, соответствующее целому объекту, равно сумме значений величин, соответствующих его частям. Например, масса вещества равна сумме масс его компонентов.
(2.50)![]()
где tК – средняя температура кипения, ºС.
В интервале температур от –30 до +100ºС можно использовать формулу П.А. Рыбакова:
рSt = р38 · 104,6-1430/T, мм. рт. ст. (2.51)
или следующую зависимость Г.Ф. Большакова:
lg рS = B – A/T, (2.52)
где рS – давление насыщенных паров, Па; А и В – коэффициенты.
При определении давления насыщенных паров нефтей и нефтепродуктов на практике необходимо учитывать два случая:
когда объем паровой фазы VП по сравнению с объемом жидкой фазы VЖ невелик, можно считать, что в состоянии насыщения состав жидкой фазы не меняется и что последняя находится в равновесии с насыщенным паром;
к
92
огда VП значительно больше VЖ, испарение наиболее летучих компонентов продукта приводит к изменению состава жидкости и в состоянии насыщения пар находится в равновесии с жидкостью, но уже измененного состава. Давление пара в этом случае будет отличаться от давления пара, определенного для небольшого объема VП и будет тем больше, чем меньше соотношение VП/VЖ.
![]() Давление
рS при объеме паровой фазы,
близком к нулю, принимает максимальное
значение и определяется давлением паров
наиболее легких углеводородов:
Давление
рS при объеме паровой фазы,
близком к нулю, принимает максимальное
значение и определяется давлением паров
наиболее легких углеводородов:
Таким образом, при характеристике давления насыщенного пара нефтепродуктов или нефтей необходимо указывать кроме температуры и соотношение объемов VП и VЖ, при котором проведены следующие соответствующие измерения рS. При решении инженерных задач выбор соотношения VП/VЖ (при котором следует определять рS) должен исходить из конкретных производственных условий. Особенно это важно для таких случаев, когда VП/VЖ и пары далеки от насыщения, или когда VП/VЖ 0 и давление насыщенных паров имеет максимальное значение.
![]() Зависимость
давления насыщенных паров нефтяных
топлив от соотношения фаз с достаточной
точностью описывается формулой Н.И.
Тихонова:
Зависимость
давления насыщенных паров нефтяных
топлив от соотношения фаз с достаточной
точностью описывается формулой Н.И.
Тихонова:
Известно аналогичное уравнение для определения рS в резервуаре:
рS = 1,29(t/38)0,69(VЖ/V)0,19рS38, (2.53)
где t – температура поверхности жидкости.
На практике давление насыщенных паров обычно определяется различными методами:
методом Рейда, заключающимся в регистрации по манометру избыточного давления насыщенных паров нефтепродуктов, помещенном в специальную «бомбу» и нагретым до 37,8ºС (38ºС), причем соотношение жидкой и паровой фаз в бомбе Рейда составляет 1:4 (ГОСТ 1756-52);
методом Валявского-Бударова, основанным на определении изменения объема паров смеси при нагреве нефтепродуктов до 37,8ºС в стеклянном приборе, при этом соотношение жидкой и паровой фаз принято равным 1:1.
В
93
Следует отметить, что в процессе хранения нефтепродуктов величина соотношения жидкой и паровой фаз может меняться от бесконечности (при хранении в резервуаре с плавающими крышами или понтонами, когда практически отсутствует паровая фаза) до нуля при полной откачке нефтепродукта из резервуара. Так, для автомобильных бензинов при отношении объема жидкой фазы к паровой 10:1 (при заполнении резервуаров на 90%) давление насыщенных паров может быть в 2 раза больше, чем при заполнении резервуара на 10% (отношение фаз 1:10).
Рис. 2.17. Стеклянная
трубка для определения упругости
насыщенных паров
Рис. 2.18. Две модификации
американских приборов Рейда.
а –
упругости насыщенных паров о бензиновой
камерой, заполняемой при атмосферном
давлении;
б –
прибор для определения упругости
насыщенных паров с бензиновой
камерой, заполняемой при повышенном
давлении.

У
94
(2.54)![]()
где xi и fi – содержание и фугитивность i-го компонента в жидкой среде, соответственно.
Поскольку фугитивности компонентов заметно зависят от общего давления в системе, то расчет по этой формуле проводят итерационно. В обсуждаемом стандарте приведены подробные таблицы фугитивности чистых компонентов сжиженного газа при разных температурах и давлениях.
Давление рS у различных нефтепродуктов по Рейду колеблется в следующих пределах (в Па): автобензин – до 9,33·104, авиабензин – до 4,8·104, керосин – 0,4·1040,8·104, дизельное топливо – 0,08·1040,13·104.
В работах Абузовой Ф.Ф., Бронштейна И.С. для бензинов уфимских нефтеперерабатывающих заводов установлен более широкий диапазон изменений рS38, от 86 кПа до 126 кПа. В некоторых опытах рS38 достигало примерно 149 кПа, а закипание нефтей в резервуарах и транспортных емкостях отмечалось при температурах ниже температуры начала кипения, определенной по ГОСТ 2177-66 и принятой за единицу стабильности.
В
95
Исследования, проведенные под руководством профессора Н.Н. Константинова, а позднее сотрудниками кафедры теплотехники Уфимского нефтяного института под руководством Ф.Ф. Абузовой показывают, что давление насыщенных паров нефтей в большей степени зависит от соотношения газовой и жидкой фаз. На рис. 2.19 по кривым равновесного состояния можно определить значение рS38 при температуре, например 20ºС. Следует обратить внимание на то, что рS при соотношении Vп/Vж = 0,1 превышало давление, лимитированное техническими условиями на нефть. Более того, при соотношении Vп/Vж, близком к нулю, давление насыщенных паров превышает нормируемое практически во всем диапазоне положительных температур. Данный факт еще раз объясняет наблюдающееся повышение давления в трубопроводе при производстве аварийно-восстановительных работ, обусловленных нарушением герметичности линейной части. Температура начала кипения бензинов также не всегда является определяющим фактором величины давления насыщения, что для нефтей и конденсатов может быть значимо.
Давление насыщенных паров рS характеризуется также величиной потерь σ углеводородов, испарившихся из первоначального объема. Но потери от испарения нефтей, имеющих одинаковую исходную и конечную упругость паров, различны и зависят от углеводородного состава.
При уменьшении упругости паров с 1180 мм. рт. ст. до 450 мм. рт. ст. (при 38ºС) потери нефти Кулешовского месторождения составляют 4, Ромашкинского – 2, Усть-Балыкского – всего 0,25%. Поэтому для определения давления насыщенных паров необходимо априори знать зависимость рS = ƒ(σ) для каждой нефти. В случае, когда экспериментальным путем найдена величина рS при потере вещества σ, давление насыщенных паров при той же температуре и при любом значении σi можно рассчитать по формуле
рSi = рS e –k(σi- σ) . (2.55)
Здесь следует напомнить, что если смесь не является постоянно испаряющейся, то величина давления данных компонентов над смесью будет также изменяться. Зависимость рS от температуры для разных нефтей также неодинакова. Для точных расчетов необходимо еще знать зависимость рS от температуры для каждого вещества.
Э
96
Целесообразно заметить, что стандартизованный метод определения давления насыщенных паров по ГОСТ 28656-90 в силу предельного упрощения расчетной схемы также оказывается не очень точным. Поэтому в настоящее время лучше использовать более строгие расчетные методы, основанные на современных уравнениях состояния многокомпонентных смесей. Таким образом, исходя из сказанного выше, для определения потерь нефтей от испарения с открытой поверхности использование давления насыщенных паров в качестве исходной характеристики представляется не корректным.
![]() Для
расчета давления насыщенных паров
чистых углеводородов рекомендуется
использовать известную формулу Антуана:
Для
расчета давления насыщенных паров
чистых углеводородов рекомендуется
использовать известную формулу Антуана:
где Ai, Bi, Ci – коэффициенты в табл. 2.3.
Давление насыщенных паров конденсатов с известным углеводородным составом можно определить по следующей зависимости:
г![]() де
kР – эмпирический
коэффициент; xi – концентрация
углеводорода в конденсате.
де
kР – эмпирический
коэффициент; xi – концентрация
углеводорода в конденсате.
Результаты исследований pS стабильных и деэтанизированных конденсатов по методу Рейда, представленные на рис. 2.19, указывают на значительный разброс данных, особенно для деэтанизированного конденсата, что легко объясняется различным составом в конденсатах легких углеводородов. При известной концентрации легких углеводородов в конденсатах экспериментальные значения pS удовлетворительно аппроксимируются следующей зависимостью:
![]() (2.57)
(2.57)
где рSi, xi – парциальное давление и концентрация i-го компонента, kS – коэффициент, характеризующий отклонение формулы (2.57) от закона аддитивности. Для исследованных стабильных конденсатов kS = 1,3, для деэтанизированных kS = 1,15.
97
Таблица 2.12
Значения коэффициентов Антуана
Углеводороды |
А |
В |
С |
от Т |
до Т |
С2Н6 |
9,5784 |
1030,628 |
39,083 |
244 |
305 |
С3Н8 |
9,4337 |
1048,900 |
5,610 |
232 |
301 |
n-С4Н8 |
9,1181 |
1030,340 |
-22,190 |
272 |
348 |
i-С4Н8 |
9,3117 |
1120,165 |
-1,297 |
252 |
407 |
n-С5Н10 |
8,9995 |
1075,820 |
-39,791 |
244 |
393 |
i-С5Н10 |
8,9345 |
1020,010 |
-40,053 |
244 |
737 |
С6Н10 |
9,0026 |
1171,530 |
-48,784 |
214 |
423 |
В заключение следует отметить, что давление насыщенных паров не следует путать с давлением насыщения, которое соответствует моменту появления первых пузырьков газа из газонасыщенной нефти при понижении давления. Как правило, абсолютное значение давления насыщенных паров значительно меньше давления насыщения, которое, например для пластовых нефтей обычно составляет 1,2÷9,0 МПа.
