
2)До хімічних методів відносяться – ваговий або гравіметричний, об’ємний або титриметричний, газовий. Це старі класичні методи, найдавнішим серед яких є ваговий. Він ґрунтується на зважуванні речовини у вигляді вагової форми, тобто такої, яка дуже малорозчинна у воді, має сталу хімічну формулу за якою можна визначити кількість досліджуваної складової частини. Осад з визначуваною речовиною відфільтровують, промивають, прожарюють до сталої ваги і зважують на аналітичних терезах з точністю до четвертого знаку після коми. Аналітичні терези різної конструкції дають змогу зважувати з точністю до 0,0001 г. За відомою вагою осаду обчислюють процентний вміст визначуваного елемента чи речовини в досліджуваному зразку.
Основні операції вагового аналізу
Подрібнення зразка і розчинення його
Осадження і проба на осадження
Фільтрування і висушування осаду
Прожарювання до постійної ваги
Зважування і розрахунки кількісного вмісту.
Вибір осаджувача. З усіх можливих осаджувачів вибирають такий, який давав би осад, що найбільш точно відповідає формулі. Так, для Ва2+ беруть SO42-, а не СО32- чи інші, бо він дає найбільш стійкий осад BaSO4.
Взяття наважки. Дослідами встановлено, що наважку слід брати таку, щоб вага утвореного осаду була 0,3 – 0,5 г.
Розрахунки наважки. Розрахувати скільки потрібно BaCl2, щоб утворений з нього осад ВаSO4 важив біля 0,4 г?
BaCl22H2O + Н2SO4 = ВаSO4 + 2 НCl + 2Н2О.
З 244,3 г BaCl22H2O одержуємо 233,4 г ВаSO4, а
з Х г 0,4 г

Розрахунки кількості осаджувача.
На 244,3 г BaCl22H2O потрібно 98 г 100%-ної Н2SO4, а
на 0,4 Х г
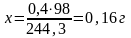
Для утворення великих кристалів осадження ведеться з гарячих розчинів.
Оскільки для осадження береться 2н H2SO4, то:
98 г H2SO4 міститься в 1000 мл розчину, а
0,1 Х мл
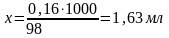
Так як осаджував частково адсорбується осадом, то для повноти осадження його беруть в 1,5 рази більше, ніж розраховано. Повноту осадження контролюють додаючи до просвітленого осаду 2-3 краплі осаджувача, який не повинен давати каламуті в місці падіння крапель.
1)Методи кислотно – основного титрування
В 1766 році кислотно – основне титрування вже було добре відомо. Про аналіз води в хімічній енциклопедії того часу було написано: „Якщо вода містить вільну кислоту або луг, то ці речовини можна ідентифікувати або за смаком, або за їх дією на лакмус або фіалкову настойку, або додаванням такої кількості кислоти або основи, яке необхідно для досягнення крапки насичення.”
Метод базується на використанні протолітичних реакцій, зокрема, для водних розчинів – реакцій :
Н+ + ОН- = Н2О ( Н3О+ + ОН- = 2Н2О )
Метод дозволяє визначати концентрацію багатьох неорганічних і органічних речовин , що можуть проявляти кислотно – основні властивості.
Розрізняють :
Ацидиметричне ( титрант – кислота )
Алкаліметричне ( титрант – основа )
Можливість кислотно – основного титрування й підбір індикатора здійснюють за допомогою кривих титрування, які будують у координатах рН – об’єм ( частка ) титранта .
При титруванні кислотами та основами користуються різними методами встановлення точки еквівалентності. Найбільш широко використовуються для цього різні органічні речовини, які мають характер кислот чи основ і змінюють своє забарвлення залежно від величини рН розчину.
Будова і забарвлення індикатора фенолфталеїну
а) в кислому середовищі б) в лужному середовищі

Безбарвний малиновий
Інтервал переходу при рН 8,0 – 10,0
рТ = 9,0
Будова і забарвлення індикатора метилового оранжевого
а) в кислому середовищі б) в лужному середовищі
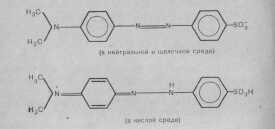
Червоний Жовтий
Основною вимогою при виборі індикатора є близькість значень показника титрування індикатора є близькість значень показника титрування індикатора
( рТ) і рН точки еквівалентності
НInd = Н+ + Ind-
[Н+] [Ind -]
К = ------------------
[HІnd -]
[HІnd -]
pK = pH + Ig -------------
[Ind -]
При зміні концентрації [ H+] відбуваються зміщення рівноваги, яке приводить до збільшення концентрації однієї з форм і зменшення - іншої.
рТ – рН середина інтервалу переходу, коли
[НInd] = [Ind], при цьому :
[HІnd -]
рТ = pK = pH + Ig ------------- = рН
[Ind -]
Таким чином, для вибіру індикатору необхідно знайти індикатор, в якого величина рТ якомога ближча до величини рН в точці еквівалентності.
Як робочі титровані розчини найчастіше використовуються :
Сильні кислоти й основи.
Шляхом безпосереднього титрування можна визначити такі групи електролітів: Сильні і слабкі основи, солі слабких основ і, аналогічно, сильні й слабкі кислоти, а також солі слабких основ і сильних кислот.
