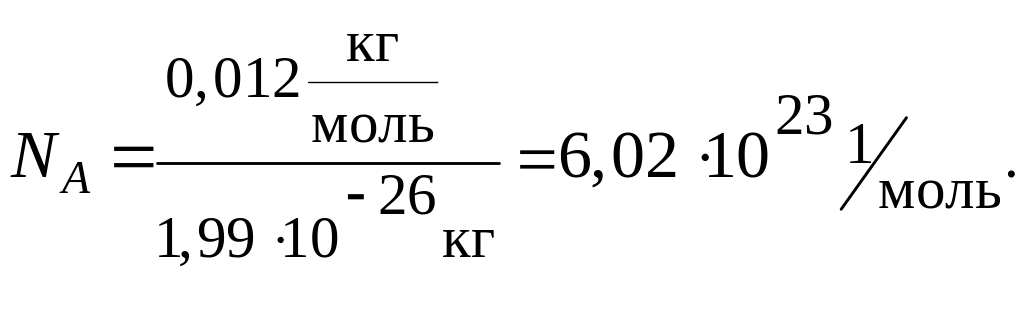- •Б илет №1 Первоначальные понятия химии
- •1.2. Атомно-молекулярное учение
- •1.3. Основные понятия химии
- •1.3.2. Атомная и молекулярная массы
- •1.3.3. Моль, молярная масса, молярный объем
- •1.3.5. Связь между объемом вещества и его количеством
- •4.3. Электронная структура атома
- •4.4. Основное и возбужденное состояние атома
- •4.1. Периодический закон д.И.Менделеева
- •Вопрос №7 Химическая связь.
- •Вопрос №9.Тепловые эффекты химических реакций. Термохимия.
- •Тепловой эффект химической реакции
- •5.4. Энергия Гиббса.
- •Вопрос №10.Химическая кинетика.
- •Вопрос №13 Химическое равновесие
- •6.3. Смещение химического равновесия.
- •2. Объемная доля.
- •5. Молярная концентрация.
- •7. Моляльность.
- •Вопрос №18.Электролитическая диссоциация
- •Вопрос №20.Реакции в растворах электролитов
- •1)Фильтрование
- •Определение рН-среды колориметрическим методом
- •Изменение окраски наиболее распространенных индикаторов
- •Гидролиз солей.
Б илет №1 Первоначальные понятия химии
Химия – это естественная наука, которая изучает состав, строение, свойства и взаимные превращения веществ, а также явления, сопровождающие эти превращения.
Предметом изучения химии является химическая форма движения материи.
Материя - это философская категория, обозначающая объективную реальность, существующую независимо от человеческого сознания.
Материя существует в двух основных видах – в форме вещества и форме поля.
Вещество – форма существования материи, состящая из частиц, характеризующихся собственной массой покоя.
Примерами частиц, имеющих собственную массу покоя, а следовательно, представляющие собой вещества, являются электроны, протоны и другие элементарные частицы, ядра атомов и сами атомы, молекулы и кристаллы.
Самые разнообразные окружающие нас тела состоят из различных химических веществ.
1.2. Атомно-молекулярное учение
Сущность атомно-молекулярного учения М.В. Ломоносова сводится к следующему:
1. Все вещества состоят из молекул (М.В. Ломоносов называл их «корпускулами»).
2. Молекулы состоят из атомов (М.В. Ломоносов называл их «элементами»).
3. Частицы – молекулы и атомы – находятся в непрерывном движении. Теплота состоит во внутреннем движении этих частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ – из различных атомов.
Дальнейшими исследованиями было показано, что атомы разных веществ могут отличаться друг от друга зарядом ядра, массой, размерами, химическими свойствами.
1.3. Основные понятия химии
Атом – наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Молекула – наименьшая частица химического вещества, обладающая всеми его химическими свойствами.
Атом (совр.) – электронейтральная частица, состоящая из положительно заряженного ядра и компенсирующих его заряд электронов.
Химический элемент – каждый отдельный вид атомов, характеризующийся определенным положительным зарядом ядра.
1.3.2. Атомная и молекулярная массы
Одной из важнейших характеристик атомов является его масса.
Абсолютной называется масса атома, выраженная в килограммах (граммах).
В практических расчётах пользоваться такими величинами крайне неудобно. Поэтому обычно пользуются значениями не абсолютных масс атомов, а значениями относительных атомных масс.
Относительная атомная масса обозначается Ar,
В качестве единицы для измерения масс атомов и молекул принята атомная единица массы (а.е.м.).
Атомная единица массы (а.е.м.) представляет собой 1/12 часть массы атома изотопа углерода 12С, т.е.
а.е.м.
=
![]() =
=
![]() · 1,99 · 10–26
кг =
· 1,99 · 10–26
кг =
![]() · 1,99 · 10–23
г.
· 1,99 · 10–23
г.
Относительная атомная масса показывает, во сколько раз масса атома данного элемента больше 1/12 части массы атома изотопа углерода 12С, т. е. атомной единицы массы.
Абсолютная масса молекулы (m)мол. – масса молекулы химического вещества, выраженная в килограммах (граммах).
Относительная молекулярная масса (Мr) (или просто молекулярная масса) – масса молекулы, выраженная в атомных единицах массы.
1.3.3. Моль, молярная масса, молярный объем
Одной из основных единиц в Международной системе единиц (СИ) является единица количества вещества – моль.
Моль – это такое количество вещества, которое содержит столько структурных единиц данного вещества (молекул, атомов, ионов и др.), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа углерода 12С.
Молярной массой (M) называется масса вещества, взятого в количестве 1 моль.
[г/моль]. ν = m / M,m = ν · M,
Вопрос № 2 Качественный и количественный состав вещества. Молярный объем. Число Авогадро
Чтобы описать качественный состав вещества, перечисляют, атомы каких элементов входят в состав этого вещества. При описании количественного состава молекулярного вещества указывают атомы каких элементов и в каком количестве образуют молекулу данного вещества. При описании количественного состава немолекулярного вещества указывают отношение числа атомов каждого из элементов, входящих в состав этого вещества.
Моль любого вещества содержит одно и то же число частиц этого вещества (структурных единиц). Число структурных единиц, содержащихся в веществе количеством один моль равно 6,02·1023 и называется числом Авогадро (NА).