
- •Б илет №1 Первоначальные понятия химии
- •1.2. Атомно-молекулярное учение
- •1.3. Основные понятия химии
- •1.3.2. Атомная и молекулярная массы
- •1.3.3. Моль, молярная масса, молярный объем
- •1.3.5. Связь между объемом вещества и его количеством
- •4.3. Электронная структура атома
- •4.4. Основное и возбужденное состояние атома
- •4.1. Периодический закон д.И.Менделеева
- •Вопрос №7 Химическая связь.
- •Вопрос №9.Тепловые эффекты химических реакций. Термохимия.
- •Тепловой эффект химической реакции
- •5.4. Энергия Гиббса.
- •Вопрос №10.Химическая кинетика.
- •Вопрос №13 Химическое равновесие
- •6.3. Смещение химического равновесия.
- •2. Объемная доля.
- •5. Молярная концентрация.
- •7. Моляльность.
- •Вопрос №18.Электролитическая диссоциация
- •Вопрос №20.Реакции в растворах электролитов
- •1)Фильтрование
- •Определение рН-среды колориметрическим методом
- •Изменение окраски наиболее распространенных индикаторов
- •Гидролиз солей.
Вопрос №9.Тепловые эффекты химических реакций. Термохимия.
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией.
Три вида систем: 1) изолированные, которые не обмениваются с соседними ни веществом, ни энергией, 2) закрытые, которые обмениваются с соседними энергией, но не веществом ; 3) открытые, которые обмениваются с соседними и веществом, и энергией.
Тепловой эффект химической реакции
Количество теплоты, которое выделяется или поглощается при протекании химической реакции, называется тепловым эффектом реакции.
Энтальпия Н это свойство вещества, являющееся мерой энергии, накапливаемой веществом при его образовании. Часто энтальпию вещества называют его теплосодержанием. Размерность энтальпии - [кДж/моль}
Тепловой эффект химической реакции обозначается символами Q или ΔH, причем их значения равны по величине, но противоположны по знаку:
+Q = –ΔH.
Реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими.
Они характеризуются положительным тепловым эффектом (Q> >0), и соответственно уменьшением энтальпии (теплосодержания) системы (ΔH<0).
Реакции, протекающие с поглощением теплоты из окружающей среды, т.е. с отрицательным тепловым эффектом (Q<0), и приводящие к росту энтальпии (теплосодержания системы) (ΔH>0), называются эндотермическими.
Термохимические уравнения подчиняются закону Лавуазье-Лапласа:
тепловой эффект прямой реакции равен по абсолютной величине, но противоположен по знаку тепловому эффекту обратной реакции.
.
Энтропия – это мера неупорядоченности состояния системы; Энтропия возрастает (∆Ѕ>0) с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п.
Изменение энтропии системы в результате протекания химической реакции (∆S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов. Изменение энтропии в результате протекания химической реакции
aA + bB = сС + dD:
![]() .
.
5.4. Энергия Гиббса.
Направление протекания химической реакции определяет энергия Гиббса (∆G). Еще энергию Гиббса называют изобарно- изотермическим потенциалом. Размерность энергии Гиббса кДж/моль.
aA + bB = сС + dD
![]() ,
,
где ∆G0 – стандартная энергия Гиббса образования вещества, кДж/моль.
Условия возм-ти протекания хим-ой р-ии
∆G<0
- реакция возможна при дополнительных условиях(равновесие смещено в сторону образования продуктов реакции)
∆G>0
-реакция невозможна в данных условиях(равновесие смещено в сторону образ-я исх-х в-в)
(при ∆G > 300 кДж/моль,реакция невозможна в принципе)
∆G=0
-система находится в состоянии химического равновесия.
Вопрос №10.Химическая кинетика.
Химическая кинетика раздел химии, изучающий скорости и механизмы химических процессов, а также их зависимость от различных факторов.
скорость реакции это величина, показывающая изменение молярной концентрации одного из веществ в единицу времени.
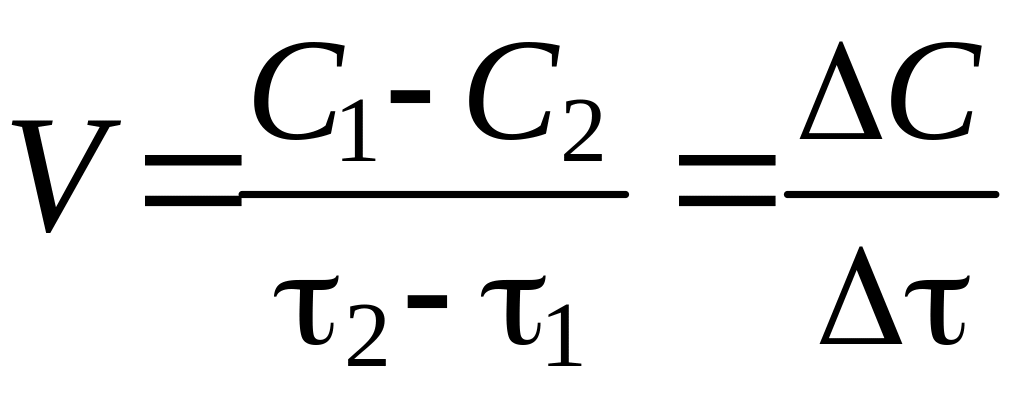 [моль/л·с].
[моль/л·с].
Скорость химической реакции зависит от целого ряда факторов:
• природы реагирующих веществ;
• концентрации реагирующих веществ;
• давления (для газовых систем);
• температуры системы;
• площади поверхности (для гетерогенных систем);
• наличия в системе катализатора и других факторов.
Закон действующих масс гласит: скорость элементарной химической реакции при постоянной температуре прямо пропорциональна произведению молярных концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
В общем случае, если в элементарную реакцию вступают одновременно т молекул вещества А и n молекул вещества В:
mА + nВ = С,
то уравнение для скорости реакции (кинетическое уравнение)
![]()
где k коэффициент пропорциональности, который называется константой скорости химической реакции;
Константа скорости реакции k численно равна скорости реакции, в которой концентрации реагирующих веществ (или их произведение в кинетических уравнениях) равны единице.
Основной закон химической кинетики:
Скорость химич-ой р-ии прямо пропорциональна произведению концентрации реагирующих в-в в степенях их стехиометрических коэффициентов.
Влияние давления на скорость
Увеличение давления приводит к пропорциональному росту концентрации, а следовательно и скорости.
Вопрос №11
Химическая кинетика раздел химии, изучающий скорости и механизмы химических процессов, а также их зависимость от различных факторов.
скорость реакции это величина, показывающая изменение молярной концентрации одного из веществ в единицу времени.
.
Скорость химической реакции зависит от целого ряда факторов:
• природы реагирующих веществ;
• концентрации реагирующих веществ;
• давления (для газовых систем);
• температуры системы;
• площади поверхности (для гетерогенных систем);
• наличия в системе катализатора и других факторов.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10 0С скорость химической реакции возрастает в два - четыре раза.
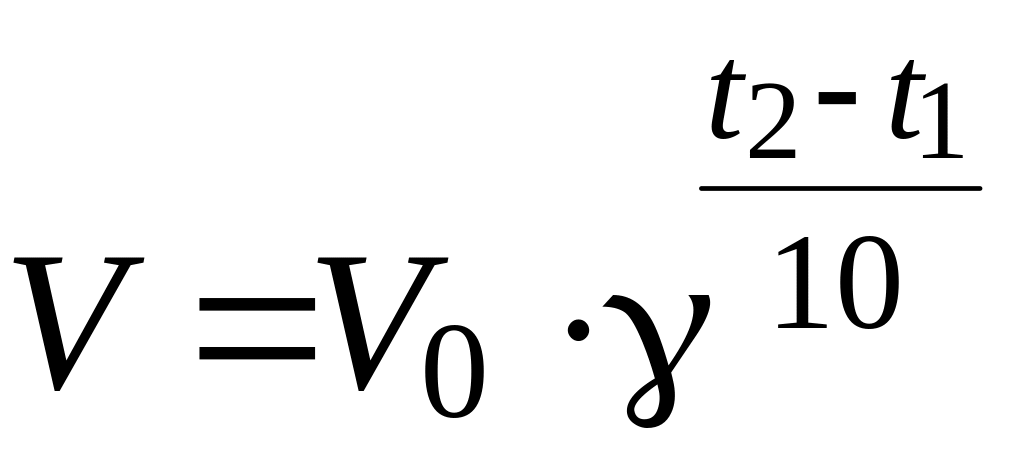 ,
,
где V1 – скорость реакции при начальной температуре системы t1, V2 – скорость реакции при конечной температуре системы t2,
γ – температурный коэффициент реакции, равный 2÷4.
Энергия, необходимая для увеличения энергии молекул реагирующих веществ до энергии активированного комплекса, называется энергией активации Еа.
Согласно уравнению Аррениуса, чем больше значение энергии активации Eакт, тем в большей степени константа скорости химической реакции k зависит от температуры:
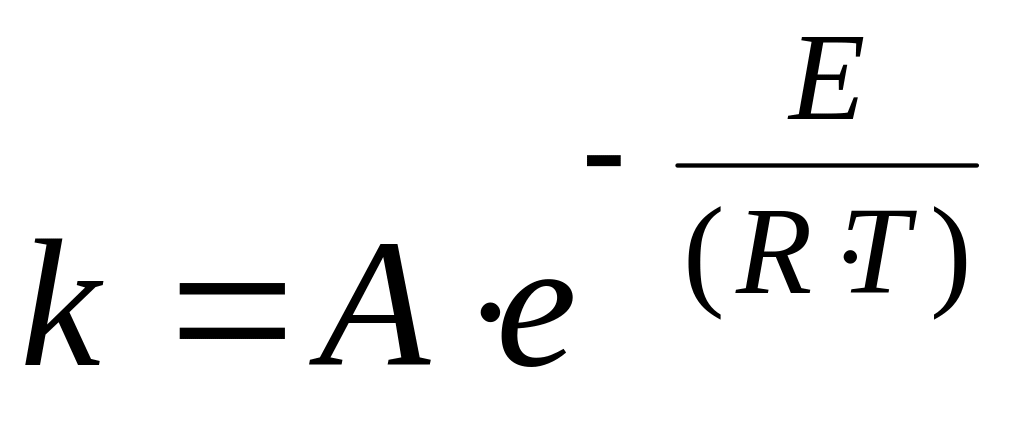 ,
,
Путь реакции
Активированный
комплекс



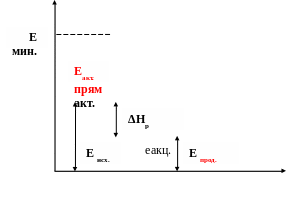

Рис. 6.1. Энергетическая диаграмма экзотермической реакции:
Eисх – средняя энергия исходных веществ; Eпрод – средняя энергия продуктов реакции; Eмин – энергия активированного комплекса; Eакт – энергия активации; ΔHр – тепловой эффект химической реакции
Вопрос №12.Химическая кинетика раздел химии, изучающий скорости и механизмы химических процессов, а также их зависимость от различных факторов.
скорость реакции это величина, показывающая изменение молярной концентрации одного из веществ в единицу времени.
.
Скорость химической реакции зависит от целого ряда факторов:
• природы реагирующих веществ;
• концентрации реагирующих веществ;
• давления (для газовых систем);
• температуры системы;
• площади поверхности (для гетерогенных систем);
• наличия в системе катализатора и других факторов.
Катализаторы это вещества, которые повышают скорость химической реакции. Влияние, оказываемое катализаторами на химические реакции, называется катализом.
механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений.
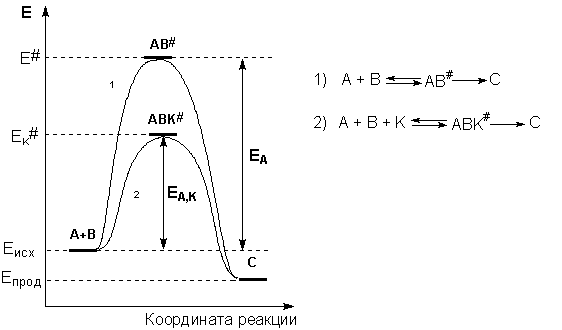 Энергетическая
диаграмма химической реакции без
катализатора (1)
и в присутствии катализатора (2).
Энергетическая
диаграмма химической реакции без
катализатора (1)
и в присутствии катализатора (2).
Различают положительный и отрицательный катализ (соответственно увеличение и уменьшение скорости реакции), хотя часто под термином "катализ" подразумевают только положительный катализ; отрицательный катализ называют ингибированием. Все катализаторы одинаково ускоряет как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывают, а только способствуют более быстрому его достижению.
