
- •Билет 11
- •Зависимость скорости реакции от рН
- •Билет 13.
- •Билет 14.
- •Билет 17
- •Энзимопатии, возникающие при в6 дефиците.
- •Билет 22.
- •Билет 27.
- •Билет 28.
- •Билет 31.
- •Билет 32.
- •Билет 33.
- •Билет 34
- •Биологическая ценность белков.
- •Пути превращения аминокислот в печени.
- •Синтез аминокислот
- •Декарбоксилирование аминокислот.
- •Пути обезвреживания аммиака.
- •Энергетическая цена синтеза мочевины
- •Креатин Креатинфосфат
- •Обмен цистеина и метионина.
- •Функции цистеина:
- •Обмен фенилаланина и тирозина.
- •Синтез катехоламинов (адреналина, норадреналина)
- •Синтез тироксина
- •Обмен триптофана.
- •Биосинтез мелатонина.
- •Структура и свойства нуклеопротеидов.
- •Виды нуклеиновых кислот
- •Структура нуклеопротеидов.
- •Нуклеиновые кислоты.
- •Обмен нуклеотидов.
- •Распад пуриновых оснований.
- •Распад пиримидиновых оснований.
- •Распад пуриновых оснований.
- •Метаболизм белково-пептидных гормонов.
- •Пути экскреции гормонов и их метаболитов.
- •Биосинтез мелатонина.
- •Метаболизм аминокислотных гормонов.
- •Метаболизм тиреоидных гормонов.
- •Метаболизм мелатонина.
- •Пути экскреции гормонов и их метаболитов.
- •Регуляция обмена белков.
- •Этапы синтеза стероидных гормонов.
- •Транспорт гормонов.
- •Специфические транспортные белки плазмы крови.
- •Неспецифические белки.
- •Физиологическая роль связывания гормонов в крови.
- •Периферический метаболизм гормонов.
- •Виды метаболизма:
- •Регуляция обмена белков.
- •Этапы действия стг.
- •Этапы действия инсулина.
- •Половые гормоны.
- •Регуляция водно-солевого обмена.
- •Гормональная регуляция обмена кальция.
- •Функции кальция.
- •Билет 80. Витамины.
- •Функции витаминов.
- •Этапы нарушений обмена витаминов.
- •Диагностика гиповитаминозов
- •Причины возникновения и коррекция авитаминозов.
- •Причины нарушений обмена витаминов
- •Авитаминоз, гиповитаминоз.
- •Причины возникновения гиповитаминозов.
- •Клиническая картина гиповитаминозов.
- •Определение недостатка витаминов.
- •Биохимические принципы витаминотерапии
- •Нарушение обмена в1.
- •Витамин в5(рр).
- •Примеры реакций.
- •Патология обмена витамина в5.
- •Витамин в2 – рибофлавин.
- •Практической применение в2.
- •Обмен витамина в3 (пантотеновая кислота).
- •Витамин в6.
- •Витамин в6 участвует в обмене триптофана.
- •Энзимопатии, возникающие при в6 дефиците.
- •Обмен витамина н (биотин).
- •Врожденная пропионатацидемия.
- •Фолиевая кислота – витамин в9, Вс.
- •Нарушения обмена фолиевой кислоты.
- •Витамин в12-кобаламин.
- •Нарушения обмена витамина в12.
- •Аскорбиновая кислота (витамин с).
- •Нарушения обмена витамина с.
- •Функции витамина а.
- •Нарушения обмена витамина а.
- •Витамин е (токоферолы).
- •Витамин d.
- •Функции витамина d.
- •Механизм действия витамина d.
- •Нарушение обмена витамина d.
- •Врожденные нарушения обмена витамина d.
- •Витамин к.
- •Функции витамина к.
- •Белки плазмы крови.
- •Высаливание.
- •Функции белков плазмы крови.
- •Альбумины.
- •Строение гемоглобина.
- •Аномальные типы гемоглобина
- •Патология обмена гемоглобина.
- •Порфирии.
- •Синтез гема.
- •-Глобулины.
- •Билет 97. Биохимия печени
- •Билет 98
Билет 1.
Цепи,связывают,остатков,связями.
Белки,взаимодействий,структуру,конформацией.
Последовательность,содержит,о построении,трехмерной.
Уровня различают,называемых.
Линейная,остатков,в цепи,пер белка.
Индивидуального каждого,в участке ДНК,геном.
В,синтеза,информ-ия в гене перп,на м-РНК,рибосоме,сборка пер струк.
Каждый из 50 тыс,белков,имеет уникальную.
Все моле-лы, белка,одинаковое,остатков,в белке,отличает ,другого.
Цепи,связывают,связями.
Взаимодействий,сруктуру,конформацией.
Уровня .
Последовательность ,третичную.
Последовательность .
Закодирована ,ДНК,геном.
Синтеза,мРНК,сборка.
Каждый ,уникальную.
Первичная структура белка.
В настоящее время расшифрована первичная структура около 2500 белков, а в природе имеется 1012 разнообразных белков.
Первичная структура – это последовательность (порядок) соединения аминокислотных остатков с помощью пептидной связи.
Пептидная связь образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты.
В
образовании первичной структуры
участвуют
![]() -аминокислоты.
-аминокислоты.
Пептидная связь образует остов полипептидной цепи, она является повторяющимся фрагментом.
Свойства первичной структуры белка
Детерминированность – последовательность аминокислот в белке генетически закодирована. Информация о последовательности аминокислот содержится в ДНК.
Уникальность – для каждого белка в организме характерна определенная последовательность аминокислот.
Аминокислоты, входящие в состав белков делят на 2 группы:
Взаимозаменяемые аминокислоты – это амиокислоты, сходные по структуре и свойствам.
Невзаимозаменяемые аминокислоты, отличающиеся по структуре и свойствам.
В белковой молекуле различают 2 вида замен аминокислот:
Консервативная – замена одной аминокислоты на другую сходную по структуре. Такая замена не приводит к изменению свойств белка.
Примеры: гли-ала, асп-глу, тир-фен, вал-лей.
Радикальная замена – замена одной аминокислоты на другую отличающуюся по структуре. Такая замена приводит к изменению свойств белка.
Примеры: глу-вал, сер-цис, про-три, фен-асп, илей-мет.
При радикальной замене возникает белок с другими свойствами, что может привести к патологии.
3.Универсальность первичной структуры. Белки, выполняющие одинаковые функции в разных организмах имеют одинаковую или близкую первичную структуру.
В природных белках одна и та же аминокислота не встречается подряд больше 3 раз.
Радикальная замена глу на вал в шестом положении в молекуле гемоглобина приводит к развитию серповидно-клеточной анемии. При этой патологии эритроциты в условиях низкого парциального давления приобретают форму серпа. После отдачи кислорода такой гемоглобин превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов,. Тактоиды деформируют клетку и эритроциты приобретают форму серпа. При этом происходит гемолиз эритроцитов. Болезни протекает остро и дети погибают. Эта патология называется серповидно-клеточной анемией.
Классическим примером наследственной гемоглобинопатии является серповидноклеточная анемия.Глу в 6-м положении в бетта –цепи заменен на валин.Эритроциты в условиях низкого парциального давления кислорода принимают форму серпа.Такой гемоглобин после отдачи кислорода превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами ,которые деформируют клетку и вызывают массивных гемолиз.
Любой дефект рецептра ЛПНП или белка апоВ-100,взаимодействующего с ним ,приводит к развитию наиболее распространенного наследственного заболевания –семейной гиперхолестеринемии.Пичиной этого аутосомно-доминантного заболевания выступают мутации в гене рецептора ЛПНП.Гетерозиготы,имеющие один нор ген,встречаются с част-й 1:500.Количество рецепторов наа поверхности клеток у них снижено вдвое,а конц холестерола в плазме повышается вдвое.Это приводит к выраженному атеросклерозу и инфаркту или инсульту.Гомозиготы-1:1млн.У них конц хол увеличена в 5-6 раз.
Связывая ЛНП, клетки поддерживают определенный уровень этих ЛП в крови. У всех обследованных здоровых людей интернализация ЛНП неизбежно сопровождается и связыванием с рецепторами клеток. Связывание и интернализация ЛНП обеспечивается одним и тем же белком, входящим в состав рецепторов ЛНП. В фибробластах больных с семейной гиперхолестеринемией, дефицитных по рецепторам ЛНП интернализация их резко угнетается.
Появление в клетках свободного холестерина ингибирует ОМГ-КоА-редуктазу снижает эндогенный синтез холестерина. При концентрации ЛНП > 50 мкг/мл синтез холестерина в фибробластах подавляется полностью.
Гиперхолестеринемия – главная причина отложения холестерина в артериях. Но важное значение имеют также первичные повреждения стенок сосудов. Повреждения эндотелия могут возникать в следствие гипертонии, воспалительных процессов.
В области повреждения эндотелия в стенку сосудов проникают компоненты крови, в том числе липопротеиды, которые поглощаются макрофагами. Мышечные клетки сосудов начинают размножаться и тоже фагоцитировать липопротеиды. Ферменты лизосом разрушают липопротеиды, кроме холестерина. Холестерин накапливается в клетке, клетка гибнет, а холестерин оказывается в межклеточном пространстве и инкапсулируется соединительной тканью – образуется атеросклеротическая бляшка.
Между отложением холестерина в артериях и липопротеидами крови происходит обмен, но при гиперхолестеринемии преобладает поток холестерина в стенки сосудов.
Методы профилактики и лечения атеросклероза направлены на уменьшение гиперхолестеринемии. Для этого применяют малохолестериновую диету, лекарства увеличивающие эксткрецию холестерина или ингибирующие его синтез, прямое удаление холестерина из крови методом гемодиффузии.Печень донора с нормальным количеством рецепторов .Резкое повышение холестерина в пище ( до 1,5 г ежедневно) может сопровождаться некоторой гиперхолестеринемией у здоровых людей.
Стр455 Северин.
Билет 2.
Конформация – это пространственное расположение в органической молекуле замещающих групп, способных свободно изменять свое положение в пространстве без разрыва связей, благодаря свободному вращению вокруг одинарных углеродных связей.
Различают 2 вида вторичной структуры белка:
1. -спираль
2.
![]() -складчатость.
-складчатость.
Вторичную структуру стабилизируют водородные связи. Водородные связи возникают между атомом водорода в NH группе и карбоксильным кислородом.
Характеристика -спирали.
-спираль стабилизируется водородными связями, которые возникают между каждой первой и четвертой аминокислотой. Шаг спирали включает 3,6 аминокислотных остатка.
Образование -спирали происходит по часовой стрелке (правый ход спирали), т.к. природные белки состоят из L-аминокислот.
Для каждого белка характерна своя степень спирализации полипептидной цепи. Спирализованные участки чередуются с линейными. В молекуле гемоглобина и -цепи спирализованы на 75%, в лизоциме – 42%, пепсине – 30%.
Степень спирализации зависит от первичной структуры белка.
-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии.
В образовании водородных связей участвуют все пептидные группы. Это обеспечивает максимальную стабильность -спирали.
так как все гидрофильные группы пептидного остоваобычно учатвуют в образовании водородных связей,то гидрофобность альфа спиралей увеличивается.
радикалы аминокислот находятся на наружной стороне альфа спиралей и направлены от пептидного остова в стороны.Они не участвуют в образовании водородных связей,характ для втор структуры,но некоторые из них могут нарушать формирование альфа спиралей:
пролин.его атом азота входит в состав жесткого кольца,что исключает возможность вращения вокруг N-CH связей.Кроме того,у атома азота пролина ,образующего связь сдругой аминокислотой нет водорода.В результате пролин не способен организовать водородную связь и структура альфа спиралей нарушается.Обычно здесь возникает петля или изгиб.
Участки,где последовательно расположены несколько одинаково заряженных радикалов,между которыми возникают электростатические силы отталкивания.
Участки с близко расположенными обьемными радикалами,механически нарушающими формирование альфа спиралей,например метионин,триптофан.
Спирализации белковой молекулы препятствует аминокислота пролин.
- складчатость имеет слабоизогнутую конфигурацию полипептидной цепи.
Если связанные полипептидныые цепи направлены противоположно,возникает антипараллельная -структура,если же N и С концы полипептидных цепей совпадают,возникает структура параллельного -складчатого слоя.
Для - складчатости характерны водородные связи в пределах одной полипептидной цепи или сложных полипептидных цепей.
В белках возможны переходы от -спирали к -складчатости и обратно вследствие перестройки водородных связей.
-складчатость имеет плоскую форму.
-спираль имеет стержневую форму.
Водородные связи – слабые связи, энергия связи 10 – 20 ккал/моль, но большое количество связей обеспечивает стабильность белковой молекулы.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Билет 3.
Третичная структура белка.
Третичной структурой белка называется трехмерная простанственная структура образующаяся за счет взаимодействия между радикалами аминокислот,которые могут располагаться на знаачительном расстоянии в цепи.
По форме третичной структуры белка делят на глобулярные и фибриллярные.
В стабилизации третичной структуры белковой молекулы участвуют ковалентные связи (пептидные и дисульфидные). Основную роль в стабилизации играют нековалентные связи: водородные, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-вальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия.
Электростатические=ионные могут возникать внутри гидрофоб ядра между анионными ггруппами аспартата и глутамата и катионными лизина,аргинина,гистидина.
Гидрофобные радикалы аминокислот ала, вал, изолей, мет, фен в водной среде взаимодействуют друг с другом. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, а полярные радикалы оказываются ориентированными в сторону воды.В результате внутри белковой глобулы оказывается гидрофобное ядро.
Если же белки функционируют в липидном окружении,то наоборот. В любом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение.
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму с меньшим запахом энергии.
При формировании третичной структуры полипептидная цепь изгибается в местах нахождения пролина, глицина.
Глобулярные белки растворимы в воде, а фибриллярные нет.
Активные центры формируются за счет ограниченного числа аминокислот (12-16). Часто аминокислоты удалены друг от друга. Активные центры возникают при образовании четвертичной структуры.
Сближение различных фунх грп,прин\х раз\м уч-м п ц\и позвол\т соз\ть простра\ю конф\ю контактного уч\а акт\го ц\ра.Т е форма а ц закладывается,а формируется при чет или при добии коф\та.
Билет 4
Денатурация.
Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов.
При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка.
При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Различают 2 вида денатурации:
Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Свойства денатурированных белков.
Увеличение числа реактивных или функциональных групп по сравнению с нативной молекулой белка (это группы COOH, NH2, SH, OH, группы боковых радикалов аминокислот).
Уменьшение растворимости и осаждение белка (связано с потерей гидратной оболочки), развертыванием молекулы белка, с «обнаружением» гидрофобных радикалов и нейтрализации зарядов полярных групп.
Изменение конфигурации молекулы белка.
Потеря биологической активности, вызванная нарушением нативной структуры.
Более легкое расщепление протеолитическими ферментами по сравнению с нативным белком – переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
Ферментные методы гидролиза основаны на избирательности действия протеолитических ферментов расщепляющих пептидные связи между определенными аминокислотами.
Пепсин расщепляет связи, образованные остатками фенилаланина, тирозина и глутаминовой кислоты.
Трипсин расщепляет связи между аргинином и лизином.
Химотрипсин гидролизует связи триптофана, тирозина и фенилаланина.
Гидрофобные взаимодействия,а также ионные и водородные связи относятся к числу слабых,тк энергия их лишь ненамного превосходит энергию теплового движения атомов при комнатной температуре(т е уже при данной температуре возможен разрыв связей ).
Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи.
Однако,белки состоят из огромного числа атомов ,находящихся в посттояном (броуновском) движении,что приводит к енбольшим перемещениям отдельных участков полипептидной цепи ,которые обычно не нарушают общую структуру белка и его функции.Следовательно,белки обладают конформационной лабильностью – склонностью к небольшим изменениям конформации за счет разрыва одних и образования других слабых связей.Конформация белка может меняться при изменении химических и физических средств среды,а также при взаимодействии белка с другими молекулами.При этом происходит изменение пространственной структуры не только участка,контактирующего с другой молекулой,но и конформации белка в целом.Конформационные изменения играют роль огромную в функционировании белков в клетке живой.
Билет 5
Четвертичная структура белка-это количество и взаиморасположение полипептидных цепей
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).Их называют мономерами.Цепи белков соединенные ковалентными связями (например дисульфидными)поэтому инсулин мономерный белок.
Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура.
Под четвертичной структурой понимают объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.Олигомерные белки содержат от 2(гексокиназа)до 312(пируватдегидрогеназа)пртомеров.Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностью протомеров.
Комплементарность-пространственное и химическое соответствие взаимодействующих поверхностей.
В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер.
Для белков с четвертичной структурой характерно понятие субъединицы.
Субъединица – это функционально активная часть молекулы белка.
Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 и 2 -цепей.
Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия.
Активные центры возникают при образовании четвертичной структуры.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Альфа спирали в протомере обозначают латинскими буквами от A до H,начиная с N конца
Кооперативные изменения конформации протомеров.
Кислород связывается с протомерами гемоглобина чере железо(2),который соединен с 4 атомами азота пиррольных колец и атомом азота Гис F8 белковой части протомера.Связывание кислорода с оставшейся координационной связью железа происходит по другую сторону от плоскости гема.Гис Е7 обеспечивает оптимальные условия.Присоединение кислорода к атому железа одного протомера вызывает его перемещение в плоскостьь гема,за ним перемещаются остаток Гис F8 и полипептидная цепь.Так как протомер связан с остальными протомерами,а белки обладают конформационной лабильностью,происходит изменение конформации всего белка.Конформационные изменения ,произошедшие в других протомерах,облегчают присоединение следующей молекулы кислорода ,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы кислорода .Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче первой.
Изменение конформации(а следовательно и функциональных свойств) всех протомеров олигомерного белка при присоединение лиганда только к одному из них носит название Кооперативные изменения конформации протомеров.
Аналогичным образом в тканях диссоцифция каждой молекулы кислорода изменяет конфоормацию всех протомеров и облегчает отщепление последующих молекул кислорода.
Билет 6
Классификация белков.
По хим строению.
простые белки-это те,которые содержат в своем составе только полипептидные цепи,состоящие из аминокислотных остатков.Пример:основные белкки хроматина-гистоны;эластин.
сложные белки-те,которые,кроме полипептидной цепи,содержат в своем составе небелковую часть,присоединенную слабыми или ковалентными связями.Небелковая часть может быть представлена ионами металлов,какими-либо органическими молекулами.Прочно связанная с белком небелковая часть носит название простетической группы:гемопротеины,цитохромы,каталаза,пероксидаза,фосфопротеины,липопротеины,гллликопротеины,Сложный белок ,т.о.,состоит из небелковой части(прстетическая группа,и белковой(апопротеин) и называется холопротеином.
По функциям.
ферменты-это специализированные белки,ускоряющие течение химических реакций.Благодаря ф. скорости хим реакций возрастают в миллиооны раз.Благодаря набору ферментов в клетках превращения поступающих вещесттвв протекают не хаотично,а в строго определенных направлениях.
регуляторрные белки-это большая группа белковых гормонов,участвующих в поддержании постоянства внутренней среды организма.Они воздействуют на клетки мишени.Например:инсулин,кальмодулиин(присоед 4 кальция ,крепится к др б\м и рег\т их фун\ю)
рецепторные белки-для гидрофобных молекул они внутри клетки.
транспортные –переносят молекулы,плохо растворимые в воде: альбумин переноситв плазме жир к\ты и билирубин,гемоглобин.
Структурные белки-они расположены определенным образом в тканях,придают им форму,создают опору,определяют механические свойства данной ткани:коллаген,эластин.
защитные белки-иммуноглобулины,фибриноген,протромбин.
Сократительные белки-наделяют клетку способностью либо сокращаться,либо передвигаться.:актин,миозин,тубулин,
Физико-химические свойства белков:это различие индивидуальных белков по форме молекул,по массе,суммарному заряду,соотношению полярных и неполярных групп,растворимость,степень устойчивости к воздействию денатурирующих агентов.
по форме молекул на глобуллярные и фибриллярные.
У глобулярных компактна структтура,гидрофобные радикалы спрятаны в гидрофобное ядро,лучше растворимы в жидкостях организма.
По молекулярной массе:белки-вмс,номогут сильно оттличаться по молекулярной массе,а именно : от 6000 1млн Д в зависимости от коол\ва ам\т и протомеров.
Суммарный заряд белков: они имеют в своем составе радикалы лизина,аргинина,гистидина,глутамата и аспартата,способные к ионизации.Степень ионизации зависит от рН среды.При 7 все ионогенныегр б нах в ионниз состоянии.В кислой среде происходит подавление иониз глу и асп ,в щелочеой –уменьш «+» заряда. Изоэлектрическая точка-значение рН ,при котором белок приобретает суммарный нулевой заряд. Тк в большенстве белков преобладают глу и асп ,то рI для большинства белков лежит в слабокислой среде..гистоны-для них в слабощелочной.Белки,имеющие «-« или «+» заряд лучше растворимы.Суммарный заряд ув кол-во диполей воды ,способных связаться с белком, и препятствует контакту одноименнно заряженных молекул,в результате чего повышает растворимость в воде .Заряженные белки могут двигаться в электрическом поле.
Соотношение полярных и неполярных групп на поверхности нативных молекул белков.Протомеры олигомерныхбелков часто в области контактов содержат гидрофобные радикалы.индивидуальлно для индив\х белков.
Растворимост белков-зависит от всех вышеперечисленных свойств белков:формы,м м\ы,величины заряда,соотношения полярных и неполярных групп на пов б\а.Кроме того,р\ть опред\ся составом растворителя,напр,некоторые белки легче растворяются в слабом солевом ра\ре,нежели в дистиллированной воде.
Билет 7.
Структура и свойства ферментов.
Ферменты (энзимы) – специфические белки, входящие в состав всех клеток и тканей живых организмов, играющие роль биологических катализаторов.
Доказательства белковой природы ферментов.
Инативация ферментов при нагревании. Инактивация ферментов совпадает с денатурацией белка. Ферменты разрушаются также под действием минеральных кислот, щелочей, солей, алкалоидов, при облучении рентгеновскими и ультрафиолетовыми лучами.
Электрохимические свойства ферментов.
Изоэлектрическая точка ферментов.
Поведение ферментов при изменении концентрации водородных генов.
Высокая специфичность ферментов.
Ферменты не способны проникать через полупроницаемые мембраны.
Сохранение активности ферментами после действия водоотнимающими средствами (ацетон, спирт, нейтральные соли щелочных металлов).
Различают следующие виды активных центров:
Субстратный (якорная площадка) активный центр – обеспечивает присоединение субстрата за счет образования слабых связей: водородных, ван-дер-ваальсовых, гидрофобных взаимодействий.
Каталитический активный центр – отвечает за превращение субстрата. В пространстве эти центры могут быть разделены, а могут быть совмещены.
Аллостерический (регуляторный) обеспечивает присоединение низкомолекулярных веществ, приводит к изменению активности фермента. Аллостерический центр удален от субстратного и каталитического центров.
Закономерности построения активных центров.
Активные центры формируются за счет ограниченного числа аминокислот (12-16). Часто аминокислоты удалены друг от друга. Активные центры возникают при образовании четвертичной структуры.
В построении активных центров часто участвуют аминокислоты: гис, сер, лиз, асп, цис.
В построении активных центров сложных ферментов участвуют группировки кофакторов.
Олиго- и мультимерные ферменты на каждом протомере имеют свой каталитический и субстратный центр, аллостерический центр формируется за счет нескольких протомеров. При разрушении четвертичной структуры нарушается аллостерический центр и регуляция прекращается, а каталитическая функция характерная для протомера сохраняется.
Активный центр – это трехмерная структура, имеющая вид впадины или щели.
Теории, объясняющие механизм взаимодействия фермента и субстрата.
Теория Фишера – теория предшествующего соответствия, теория «ключ – замок». Согласно теории активный центр фермента существует и точно соответствует субстрату.
Недостатки (противоречия) теории:
Нет соответствия в термодинамических расчетах (разница в расчетном количестве выделяемой энергии и практически выделяемом количестве энергии).
По этой теории фермент может ошибаться и присоединять похожий субстрат.
Субстраты часто низкомолекулярные вещества, а ферменты высокомолекулярные, содержащие большое число аминокислот. Теория не объясняла существование групповой специфичности.
Теория Кошленда – индуцированного соответствия, т.е. активный центр формируется в момент взаимодействия фермента и субстрата, т.е. происходит подгонка. В субстрате происходит изменение связей. Наличие активных центров определяют специфичность.
Виды специфичности.
Абсолбтная – одному субстрату соответствует один фермент.
Уреаза катализирует расщепление мочевины, аспартаза катализирует взаимодействие NH3 с фумаровой кислотой, в результате образуется аспарагиновая кислота, но аспартаза не действует на малеиновую кислоту.
СООН COOH
| |
CH CH2
|| ![]() |
|
CH ![]() CHNH2
CHNH2
| |
COOH COOH
Фумарат Аспартат
Относительная групповая специфичность. Фермент расщепляет группу субстратов, для которых характерен один тип связей.
Пример: пепсин расщепляет пептидную связь –CO-NH между аминокислотами.
Аналогично действуют трипсин, химотрипсин, пептидазы.
Химотрепсин расщепляет пептидные связи между три, тир и фен, но при определенных условиях могут расщеплять амидные и сложноэфирные связи.
Стереохимическая специфичность – фермент обеспечивает превращение определенного оптического (стереоизомера). В организме происходит превращение L-аминокислот, но D-углеводов.
Фумараза катализирует превращение фумаровой кислоты (транс-изомер), но не действует на малеиновую кислоту (цис-изомер).
При исследовании специфичности ферментов было установленно, что молекула субстрата должна обладать двумя структурными особенностями:
Субстрат должен содержать специфическую химическую связь, которую фермент мог атаковать.
В молекуле субстрата должна быть функциональная группа, называемая связывающей группой, которая способна связываться с ферментом и ориентировать молекулу субстрата в активном центре фермента, чтобы атакуемая связь субстрата была правильно расположена по отношению к каталитической группе фермента.
БИЛЕТ №8.
Концентрация субстрата зависит от питания, возраста, физической нагрузки.
Зависимость скорости ферментативной реакции субстрата выражается уравнением Михаэлиса-Ментен:
![]()
Vmax – максимальная скорость реакции
[S] – концентрация субстрата
Km – константа Михаэлиса.
Анализ уравнения Михаэлиса-Ментен.
Концентрация субстрата мала, стремиться к нулю. При этих условиях [S] можно пренебречь:
[S]![]() 0,
при этом [S]
можно пренебречь:
0,
при этом [S]
можно пренебречь:
![]()
Концентрация субстрата стремится к бесконечности, пренебрегаем Km и уравнение имеет вид:
![]()
Сокращаем на [S] и скорость реакции равняется Vmax.
Если принять, что
 ,
то из уравнения Михаэлиса-Ментен,
разделив его на Vmax,
получили Km=[S]:
,
то из уравнения Михаэлиса-Ментен,
разделив его на Vmax,
получили Km=[S]:
![]() и разделив на
Vmax
получим
и разделив на
Vmax
получим
![]() .
Решая уравнение относительно Km
получаем Km+[S]
= 2[S],
.
Решая уравнение относительно Km
получаем Km+[S]
= 2[S],
Km=[S]
Km – величина, численно равная концентрации субстрата при , выраженная в молях. Km = 10-1 – 10-6 – для клеток организма, величина const.
Km показывает:
Степень сродства между ферментом и субстратом, существует обратная зависимость – чем меньше Km, тем больше сродство F к S.
Km позволяет определить какой субстрат будет превращаться под действием данного фермента:
Например, этиленгликоль – составная часть антифриза и алкагольдегидрогеназа (АДГ) будет превращать его в щавелевую кислоту, которая является ядом для печени.
Алкагольдегидрогеназа превращает этиловый спирт в уксусный альдегид и степень сродства АДГ к С2Н5ОН выше, чем к этиленгликолю и на этом основан способ нейтрализации этиленгликоля.
Km показывает степень сродства между белковой и небелковой частью F,

Km позволяет определить вид ингибирования.
Способ определения Km .
Построение график Михаэлиса-Ментен:
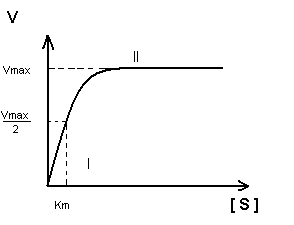
I участок – с увеличением концентрации субстрата увеличивается скорость ферментативной реакции
II участок – с увеличением концентрации субстрата скорость реакции не изменяется, т.к. все активные центры заняты.
Недостаток графика Михаэлиса-Ментен при определении Km заключается в том, что Vmax достигается с трудом, реакции в клетке протекают с оптимальной скоростью, а не Vmax.
Построение графика Лайнуэвера-Бэрка – метод обратных величин

Преимущество метода заключается в том, что прямую можно построить по двум точкам и нет необходимости определять максимальную скорость.
Зависимость скорости ферментативной реакции от концентрации фермента.
Зависимость
носит линейный характер. Скорость
химической реакции, катализируемой
данным ферментом прямопропорциональна
к онцентрации
фермента. При этом концентрация субстрата
величина постоянная. Это обясняетя
большим количеством активных центров
при определенном количестве молекул
субстрата
онцентрации
фермента. При этом концентрация субстрата
величина постоянная. Это обясняетя
большим количеством активных центров
при определенном количестве молекул
субстрата
БИЛЕТ 9.
Билет№10
Влияние низкомолекулярных веществ на активность фенрментов.
Низкомолекулярные вещества, изменяющие скорость ферментативных реакций делят на 2 группы:
Активаторы – ускоряющие протекание ферментативной реакции.
Ингибиторы – замедляют протекание ферментативных реакций.
Значение ингибирования активности ферментов.
Ингибирование лежит в основе действия лекарственных веществ и токсических агентов.
Ингибирование – один из подходов к изучению ферментативного действия (например, структуры активного центра).
ингибирование регулирует скорость и течение реакций в клетке
Ингибирование бывает 2-х видов:
Необратимое
Обратимое
Необратимое ингибирование имеет место тогда, когда присоединение ингибитора к ферменту носит необратимый характер.
 Например:
это действие алкилирующих агентов
(подацетамид) необратимо действующих
на тиогруппу ферментов. Необратимость
связана с тем, что равновесие смещено
вправо, в сторону образования ковалентного
производного фермента:
Например:
это действие алкилирующих агентов
(подацетамид) необратимо действующих
на тиогруппу ферментов. Необратимость
связана с тем, что равновесие смещено
вправо, в сторону образования ковалентного
производного фермента:
F-S-H + J-CH2CONH2 F-S-CH2-CONH2 + HJ
Необратимым является действие токстческих фосфоорганических соединений, которые называют нервно-паралитическими ядами, они ингибируют ацетилхолинэстеразу, участвующую в передаче нервных импульсов.
Необратимое ингибирование
Многие ингибиторы необратимо связываются с Е или ES, и, поскольку это влияет на Vmax, такое ингибирование относят к неконкурентному.
Ингибиторы этого типа часто ковалентно связываются с ферментом или с комплексом фермент-субстрат, необратимо изменяя нативную конфигурацию. Это объясняет токсическое действие Hg2+, Pb2+ и соединений мышьяка.
На необратимом ингибировании основано действие пенициллина. Пенициллин ингибирует действие одного из ферментов, участвующих в сборке клеточной стенки бактерий. Клетки, не имеющие клеточной стенки, легко лизируются.
Действие аспирина основано на ковалентной модификации фермента. Аспирин снижает скорость синтеза простагландинов, выступая в роли ингибитора циклооксигеназного компонента эндопероксид-синтетазы. Считается, что возникновение болей, воспалений, температуры связано с простагландинами.
При интоксикации связывание яда или его вытеснение из комплекса фермент-ингибитор возможно с помощью реактиваторов, или противоядий. К ним относятся все SH – содержащие комплексоны (цистеин, димеркаптопропанол), лимонная кислота.
Обратимое ингибирование бывает 2-х видов:
Конкурентное
Неконкурентное
Обратимое конкурентное ингибирование – активность фермента восстанавливается после удаления ингибитора путем увеличения концентрации субстрата.
Отличительный признак конкурентного ингибитора – конкурентный ингибитор по структуре близок субстрату. Конкурентный ингибитор конкурирует с субстратом за активный центр фермента.
Пример: сукцинатдегидрогеназа катализирует превращение сукцината в фумарат. Конкурентным ингибитором сукцинатдегидрогеназы является малоновая кислота, которая содержит на одну группу СН2 меньше, чем сукцинат.
СООН СООН COOH
| СДГ | |
С Н2
Н2
![]() СН
CH2
СН
CH2
| || |
|| |
СН2 СН COOH
| | малоновая кислота
СООН СООН
Сукцинат и малоновая кислота являются структурными аналогами и конкурируют за активный центр фермента. (Это является подтверждением тому, что активный центр не является жестким образованием, подходящим субстрату, как «ключ-замок».)
При конкурентном ингибировании степень ингибирования фермента не зависит от абсолютной концентрации ингибитора, а от соотношения ингибитора и субстрата, если это соотношение J:S=1:50, то активность фермента ингибируется на 50%.
Действие конкурентного ингибитора снимается повышением концентрации субстрата, так как сродство фермента и субстрата выше, чем сродство фермента и ингибитора.
Кm F и S и Km F и J различны и это узнают путем построения графиков Михаэлиса-Ментен и Лайнуэвера-Бэрка


Vmax – одинакова
Km с ингибитором увеличивается.
Действие многих химиотерапевтических средств основано на конкурентном ингибировании. Например, сулфаниламидные препараты, используемые для лечения болезней, вызываемых микробными инфекциями. Сульфаниламидные препараты по структуре сходны с п-аминобензойной кислотой. ПАБК является предшественником в микробиологическом синтезе фолиевой кислоты, из которой кофермент, необходимый для синтеза нуклииновых кислот микроорганизмов. При введении сульфаниламидных препаратов наблюдается угнетение фермента и гибель микроорганизмов.
На конкурентном ингибировании основано применение и фторурацила, который используется при лечения рака.
Неконкурентное, обратимое ингибирование.
Действие неконкурентного ингибитора не может быть устранено увеличением концентрации субстрата.
Неконкурентный
ингибитор не
связывается
с активным центром, он может связываться
со свободным ферментом
![]() ,
либо с комплексом FS
,
либо с комплексом FS
![]() ,
либо с тем и другим, но обе формы JF
и JFS
– не активны.
,
либо с тем и другим, но обе формы JF
и JFS
– не активны.


Km- не изменяется, т.к. нет связывания с активным центром.
Vmax – уменьшается.
Наиболее общий тип неконкурентного ингибирования имеет место при действии реагентов, обратимо связывающих SH-группы цис, входящего в каталитический центр или близко от него. Это ионы Cu2+, Hg2+, Ag+ и их производные с образованием меркаптидов:
![]()
Ферменты, для активации которых необходимы ионы Ме ингибируются по такому способу агентами связывающими эти ионы:
![]() ферро
или ферроцианид.
ферро
или ферроцианид.
Билет 11
Низкомолекулярные вещества, изменяющие скорость ферментативных реакций делят на 2 группы:
Активаторы – ускоряющие протекание ферментативной реакции.
Ингибиторы – замедляют протекание ферментативных реакций.
Активаторы делят на 2 группы:
В качестве активатора могут выступать коферменты или простетическая группа (в основном витамины).
Для
этой группы характерны те же закономерности,
что описаны для взаимодействия фермента
и субстрата F+S
и A+Ko
подчиняются одним закономерностям
![]()

Km определяет сколько вводить Ko.
Активаторы, являющиеся связующим звеном между F и S (ориентирование фермента и субстрата) и обеспечивающим взаимодействие фермента и субстрата (F A S), взаимодействие апофермента и кофактора Апоф А Ко
Часто это ионы Ме – Со, Mn, Mg, Zn.
Активация зимогенов.
Многие пищеварительные ферменты синтезируются в неактивной форме – в виде зимогенов (пепсиноген, трипсиноген и др.).
Эти неактивные зимогены активируются после попадания в ЖКТ, благодаря этому не происходит переваривания клеток, где происходит синтез ферментов. Зимогены не активны, так как содержат дополнительные участки или группы, которые препятствуют доступу субстрата к активному центру. Удаление этой блокирующей группы протеолитическими ферментами приводит к необратимой активации зимогена.
Трипсиноген

![]()
Эндопептидаза расщепляет пептидную связь между лиз в положении 6 и лей в положении 7, в результате отщепляется пептид и образуется активный трипсин.
Схема активации зимогена:

По такой схеме происходит активация целого ряда зимогенов:
Пищеварительные ферменты
Ферменты свертывания крови
Белковые гормоны
Кининовая система, компонент
Фибриллярный белок проколлоген коллоген.
Основная черта активации зимогенов заключается в каскадном (последовательном) включении зимогенов с образованием активных ферментов например 12-перстной кишки.
Регуляция путем химической модификации.
По существу это изменение химической структуры активного центра. В некоторых случаях фермент может существовать в клетке в неактивной форме или слабоактивном состоянии, но присоединение фосфатной группы при участии фосфорилирующего фермента, называемого киназой, к аминокислоте вблизи от активного центра, активирует фермент. Такая система может быть возвращена в исходное состояние под действием фермента, отщепляющего фосфатную группу.
Киназа Ф
 F
(актив)
F
(актив)
F (неакт) Ф
(неакт) Ф
Фосфотаза – Ф
Такой механизм очень важен, т.к. активность киназы и фосфатазы могут изменяться под действием гормонов.
Витамин |
Коферментная форма |
Переносимая группа |
Тип катализируемой реакции |
В1 тиамин |
ТДФ- тиаминдифосфат ТПФ (ТТФ) - тиаминпирофосфат |
Отщепление СО2 |
Окислительное декарбоксилирование |
В2 рибофла-вин |
ФМН – флавинмононуклеотид ФАД – флавинаденин-динуклеотид |
Протоны
(Н+)
и электроны ( |
Дегидрирование |
В3 пантоте-новая кислота |
HSKoA – (аш эс коэнзим А) |
Ацильная группа (R-C=O) | |
Ацилирования |
В5 никотин-амид |
НАД – никотинамидаде-ниндинуклеотид НАДФ – никотинамид-адениндинуклеотид фосфат |
Протоны и электроны |
Дегидрирование
|
В6 пиридок-саль |
ПФ – пиридоксаль фосфат |
NH2-группа (амино-группа) |
Трансаминирование |
В7 биотин |
Коферментной формой является сам витамин |
СО2 |
Карбоксилирование |
В9,10 фолиевая кислота |
ТГФК – тетрагидро-фолиевая кислота ТГФК-СН3 – метилтетра-гидрофолиевая кислота, СН2ОН–ТГФК – гидроксиметилен, ТГФК-С=О – формил- | ТГФК Н |
Перенос одноуглерод-ных фрагментов: метил – СН3, гидрокси-метилен - СН2ОН, формил –С=О | H |
|
В12 кобал-амин |
СН3-В12 – метил-кобаламин, ДА-В12 – дезоксиаденозил кобаламин |
Перенос метильной группы СН3 |
Трансметилирование |
Билет12
Зависимость скорости ферментативной реакции от температуры.
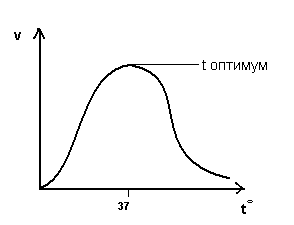 При
t=36-380
ферменты обладают наибольшей активностью.
Эта температура называется температурный
оптимум:
При
t=36-380
ферменты обладают наибольшей активностью.
Эта температура называется температурный
оптимум:
С повышением t0 до оптимума активность ферментов повышается.
Высокие t вызывают денатурацию ферментов.
Низкие t снижают активность ферментов.
Изменение t0 приводит к нарушению связей, закрепляющих белковую структуру ферментов (третичную, четвертичную), т.е. вызывает денатурацию.
Обратимая денатурация наблюдается при понижении t0. Это позволяет хранить ферменты, биологические жидкости, кровь.
Повышение температуры необратимо нарушает белковую структуру фермента. Это свойство используется при стерилизации материалов, инструментов.
Лихорадка – защитное свойство организма, т.к. происходит денатурация ферментов микроорганизмов и поэтому нецелесообразно применять жаропонижающие средства.
