
- •4.Схема котельной установки. Тепловой баланс котлоагрегата.
- •1.Топливо. Элементарный состав. Горение топлива.
- •2.Топливо. Расчет количества воздуха необходимого для сгорания топлива. Коэффициент избытка воздуха.
- •3.Топливо. Высшая и низшая теплота сгорания топлива. Способы определения. Условное топливо.
- •5.Схема тэс. Цикл Ренкена.
- •14. Неравновестный обратный цикл Карно. Холодильный коэффициент, отопительный коэффициент.
- •15. Равновестный и неравновестный циклы парового компрессионного теплового насоса.
- •16. Энтропия. Энтальпия
1
1.Топливо. Элементарный состав. Горение топлива.
Топливом называется горючее вещество, специально сжигаемое для получения тепла и используемое как источник энергии. В его состав входят горючие и негорючие вещества. К горючим веществам относится углерод, водород, их соединения между собой (углеводороды) и с различными химическими элементами - кислородом, азотом и др. К негорючим веществам (балласту) относится зола и влага. Некоторые виды топлива содержат серу (горючую, летучую), которая в топливе нежелательна, так как придаёт продуктам сгорания коррозионные свойства. По агрегатному состоянию топливо подразделяется на 3 вида: твёрдое, жидкое и газообразное. По происхождению топливо делится на естественное (дрова, торф, бурые и каменные угли, антрацит, природный газ и др.) и искусственное
(каменно-угольный кокс, брикеты, древесный уголь; генераторный, коксовый, доменный газы; продукты переработки нефти (мазут и др.).
Элементарный состав топлива
Рабочая масса топлива состоит из 7 элементов: углерода Ср, водорода Нр, азота Np, кислорода Ор, летучей серы Sj,p, золы Ар, влаги Wp.
Ср + Нр + Or +NP + SP + Ар + WP =100%
Если удалить влагу Wp, останется сухая масса:
Ср +НР +Ор + NP + SP + АР =100%
Если удалить влагу Wp и золу Ар - получим горючую массу:
Ср +НР +Ор +NP + Sp = 100%
Горючими элементами в топливе являются: углерод Ср, водород Нр, летучая сера 8ЛР (сера рабочая летучая состоит из органической и колчеданной. Сера бывает ещё сульфатная, которая не горит). Основной горючей составляющей топлива является углерод, горение которого обусловливает выделение основного количества тепла. Теплота сгорания аморфного углерода 34,4 МДж/кг (8130 ккал/кг). Водород является вторым по значению элементом горючей массы топлива, его содержание в горючей массе твердых и
жидких топлив колеблется от 2 до 10%. Много водорода содержится в природном газе, мазуте и горючих сланцах, меньше всего в антраците.
Теплота сгорания водорода в водяной пар — 10,8 МДж/м3 (2579 ккал/м3).
Кислород и азот в топливе являются органическим балластом, так как их наличие уменьшает содержание горючих элементов в топливе.
Сгорание топлива
Сгорание представляет собой хим. соединение составных элементов топлива с кислородом, происходящее по формулам: С+О2=СО2; 2Н2+О2=2Н2О.
При
неполном сгорании углерода 2С+О2=2СО.
Для полного сгорания 1 кг жидкого или
1 м3 газообразного топлива требуется
количество воздуха  ,
называемое теоретически Необходимым
количеством воздуха. Величина
достаточна для полного сгорания топлива,
если перемешивание его с воздухом
настолько
хорошее, что все элементы топлива
полностью сгорают. Отношение количества
воздуха L,
действительно поступающего
в
двигатель и участвующего в сгорании
топлива,к теоретически необходимому
количеству воздуха
называется коэффициентом избытка
воздуха α=L/
.В
результате сгорания топлива получается
смесь горячих газов, представляющих
собой продукты сгорания. Относительный
состав продуктов сгорания зависит для
данного топлива от α.
,
называемое теоретически Необходимым
количеством воздуха. Величина
достаточна для полного сгорания топлива,
если перемешивание его с воздухом
настолько
хорошее, что все элементы топлива
полностью сгорают. Отношение количества
воздуха L,
действительно поступающего
в
двигатель и участвующего в сгорании
топлива,к теоретически необходимому
количеству воздуха
называется коэффициентом избытка
воздуха α=L/
.В
результате сгорания топлива получается
смесь горячих газов, представляющих
собой продукты сгорания. Относительный
состав продуктов сгорания зависит для
данного топлива от α.
2.Топливо. Расчет количества воздуха необходимого для сгорания топлива. Коэффициент избытка воздуха.
Топливом называется горючее вещество, специально сжигаемое для получения тепла и используемое как источник энергии.
В его состав входят горючие и негорючие вещества.
Сгорание топлива
Сгорание представляет собой хим. соединение составных элементов топлива с кислородом, происходящее по формулам: С+О2=СО2; 2Н2+О2=2Н2О.
При неполном сгорании углерода 2С+О2=2СО. Для полного сгорания 1 кг жидкого или 1 м3 газообразного топлива требуется количество воздуха , называемое теоретически необходимым количеством воздуха. Величина достаточна для полного сгорания топлива, если перемешивание его с воздухом настолько хорошее, что все элементы топлива полностью сгорают. В действ-ти, такое перемешивание в двс не осуществляется и количество воздуха, требуемое для полного сгорания 1 кг или м3 топлива, больше теоретически необходимого.
Отношение количества воздуха L, действительно поступающего в двигатель и участвующего в сгорании топлива, к теоретически необходимому количеству воздуха называется коэффициентом избытка воздуха α=L/ .
В результате сгорания топлива получается смесь горячих газов, представляющих собой продукты сгорания. Относительный состав продуктов сгорания зависит для данного топлива от α. При полном сгорании жидкого или газообразного топлива, если α=1, продукты сгорания состоят из СО2, Н2О, N2. Если α>1, то продукты сгорания содержат СО2, Н2О, N2 и избыточный кислород О2. Если α<1, то продукты сгорания содержат СО2, Н2О, N2 и продукты неполного сгорания СО, СН4…
3.Топливо. Высшая и низшая теплота сгорания топлива. Способы определения. Условное топливо.
Топливом называется горючее вещество, специально сжигаемое для получения тепла и используемое как источник энергии.
В его состав входят горючие и негорючие вещества.
Количество тепла, выделяющегося при полном сгорании единицы массы данного топлива зависит от того, в паровом или жидком состоянии находится влага в продуктах сгорания. Если водяной пар сконденсируется и вода в продуктах сгорания будет находиться в жидком виде, то тепло парообразования освободится и тогда количество тепла, выделяющегося при сгорании единицы массы топлива, получается больше.
Количество тепла, выделяющегося при полном сгорании 1 кг твердого или жидкого топлива или 1 м3 газового топлива, при условии, что образующиеся водяные пары в продуктах сгорания конденсируются, называется высшей теплотой сгорания топлива.
Количество тепла, которое выделяется при полном сгорании 1 кг твердого или жидкого или 1 м3 газового топлива, за вычетом тепла парообразования водяных паров, образующихся при горении, называется низшей теплотой сгорания.
Условное топливо
Расход топлива на парогенератор данной производительности зависит от его теплоты сгорания, которая для различных топлив изменяется в больших пределах. Для сравнения по энергетической ценности и эффективности использования различных сортовтоплив введено понятие об условном топливе, которому присваивается теплота сгорания, равная Qycл =29,33 МДж/кг (7000 ккал/кг).
5.Схема тэс. Цикл Ренкена.
Преобразование энергии органического или ядерного топлива вмеханическую при помощи водяного пара осуществляется в паровых силовых установках.
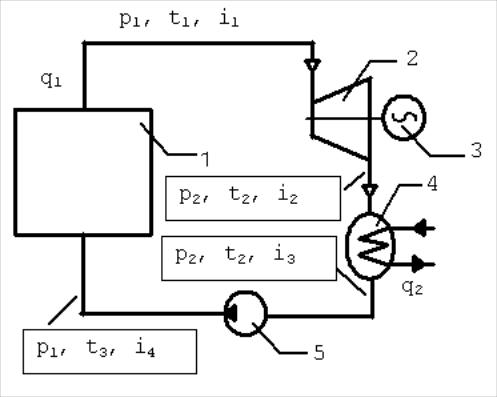 Принципиальная
тепловая схема паросиловой установки:
В паровом котле 1 вода превращается в
перегретый пар с параметрами p1, t1, i1,
который по паропроводу поступает в
турбину 2, где происходит его адиабатное
расширение до давления p2 с совершением
технической работы, приводящей во
вращательное движение ротор электрического
генератора 3. Затем пар поступает в
конденсатор 4, который представляет
собой трубчатый теплообменник.
Принципиальная
тепловая схема паросиловой установки:
В паровом котле 1 вода превращается в
перегретый пар с параметрами p1, t1, i1,
который по паропроводу поступает в
турбину 2, где происходит его адиабатное
расширение до давления p2 с совершением
технической работы, приводящей во
вращательное движение ротор электрического
генератора 3. Затем пар поступает в
конденсатор 4, который представляет
собой трубчатый теплообменник.
Внутренняя поверхность трубок конденсатора охлаждается циркулирующей водой. В конденсаторе при помощи охлаждающей воды от пара отнимается теплота парообразования и пар переходит при постоянных давлении р2 и температуре t2 в жидкость, которая с помощью насоса 5 подаётся в паровой котёл 1. В дальнейшем цикл повторяется.
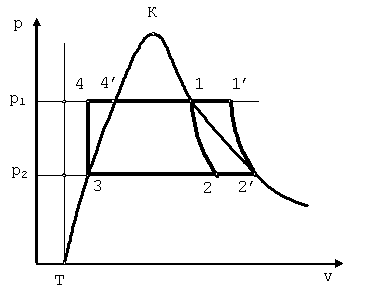
Цикл Ренкина
В паросиловых установках применяют цикл Ренкина. В цикле Ренкина охлаждение влажного пара в конденсаторе производится до превращения его в воду. Различают цикл Ренкина с сухим насыщенным паром и с перегретым паром. В цикле Ренкина с сухим насыщенным паром сухой насыщенный пар с параметрами p1, T1, i1 поступает из парового котла в турбину (точка 1), где адиабатно расширяется от давления p1 до давления p2 (точка 2). После турбины влажный насыщенный пар с параметрами p2, T2, i2 поступает в
конденсатор, где полностью конденсируется при постоянных давлении и температуре (точка 3). Питательная вода с помощью насоса сжимается до давления p1, равного давлению в паровом котле, и подаётся в котёл (точка 4). Параметры воды на входе в котёл – p1, T2, i4.
В паровом котле питательная вода смешивается с кипящей водой,нагревается до температуры кипения и испаряется.
Цикл Ренкина состоит из следующих процессов:
4′-1 – процесс парообразования в котле при постоянном давлении;
1-2 – процесс адиабатного расширения пара в турбине;
2-3 – процесс конденсации влажного пара в конденсаторе с отводом теплоты с помощью охлаждающей воды;
3-4 – процесс адиабатного сжатия воды в насосе от давления p2 до давления p1;
4-4’
– процесс подвода теплоты к воде при
давлении p1 в паровом котле до
соответствующей этому давлению
температуры кипения.
14. Неравновестный обратный цикл Карно. Холодильный коэффициент, отопительный коэффициент.
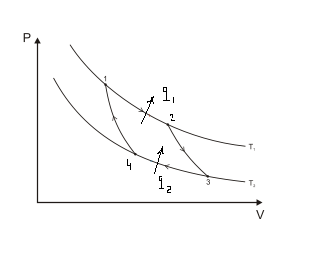
Все процессы цикла Карно являются обратимыми, поэтомуесли провести цикл в обратном направлении,то процессы пойдут по тем же линиям, что и в прямом цикле. Рабочее тело из состояния 1 адиабатно расширяется (линия 1-2). Температура его уменьшается при этом от Т1 до Т2. Затем оно расширяется изотермически при Т2 (линия 2-3). В процессе расширения рабочее тело
получает от холодного источника количество тепла q2. Далее оно сжимается адиабатно (линия 3-4) в результате чего его температура растет до Т1. Затем рабочее тело сжимается изотермически(линия 4-1), отдавая в этом процессе горячему источнику количество тепла q1. Цикл замыкается в точке 1.
При совершении обратного цикла рабочее тело получает от холодного источника количество тепла q2 и на него затрачивается извне работа L0, изображаемая в определенном масштабе площадью цикла.
Всю эту энергию в виде количества тепла q1 рабочее тело отдает горячему источнику, ибо само оно возвращается в начальное состояние, т е в этом цикле q1= q2+L0. Таким образом, в обратном цикле Карно, так же как и в любом обратном цикле, происходит передача тепла от холодного тела к горячему за счет затраты работы.
Холодильный коэффициент: безразмерная величина (обычно больше единицы), характеризующая энергетическую эффективность работы холодильной машины.
εк = T0/(Т — Т0), где T0 и Т — абсолютные температуры охлаждаемого объекта и окружающей среды.
Отопительный
коэффициент:
безразмерная величина, применяемая в
технич. термодинамике и теплотехнике
для хар-ки энергетич. эффективности
цикла теплового насоса. Отопительный
коэффициент.
 равен
отношению кол-ва теплоты Q подв, сообщаемой
за цикл нагреваемому телу, к работе А,
затрачиваемой в цикле: Еотоп= Qподв /А.
Отоп. коэф. всегда больше 1 и связан с
холодильным коэффициентом е для того
же цикла соотношением Еотоп = е + 1.
равен
отношению кол-ва теплоты Q подв, сообщаемой
за цикл нагреваемому телу, к работе А,
затрачиваемой в цикле: Еотоп= Qподв /А.
Отоп. коэф. всегда больше 1 и связан с
холодильным коэффициентом е для того
же цикла соотношением Еотоп = е + 1.
15. Равновестный и неравновестный циклы парового компрессионного теплового насоса.
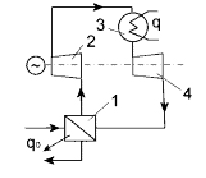
Паровые компрессионные холодильные машины — это установки, в которых рабочее тело в процессах работы совершает фазовый переход (газ-жидкость) . В цикле паровой компрессионной холодильной машины происходит
непрерывное фазовое превращение рабочего тела (кипение, испарение, а затем конденсация). Принципиальная схема одноступенчатой идеальной паровой холодильной машины приведена на рис. Основными элементами
оборудования установки являются компрессор, конденсатор, детандер (расширитель) и испаритель. Цикл машины, представляющий собой обратный цикл Карно, происходит в области влажного пара. Холодильный агент кипит в
испарителе 1 при низком давлении и низкой температуре; при этом извлекается тепло от охлаждаемого тела.
Газ из испарителя засасывается компрессором 2 и сжимается адиабатно с повышением температуры. Компрессор нагнетает газ в конденсатор 3, где он конденсируется при высоком постоянном давлении и высокой температуре,
отдавая тепло обогреваемому телу. Жидкий хладоагент поступает в детандер 4 и расширяется адиабатно, производя полезную работу за счёт внутренней энергии. Далее хладоагент поступает в испаритель, и рабочий
цикл повторяется снова.
16. Энтропия. Энтальпия
Энтальпия i некоторая функция состояния, которая для 1 кг рабочего тела равна i=u+pv (дж/кг).
u- внутренняя энергия, p- абсолютное давление, v-удельный объем.
Энтальпию можно представить след. образом. Пусть 1 кг рабочего тела в равновесном процессе при постоянном давлении перемещает поршень площадью F на расстояние h. При таком перемещении рабочее тело совершает работу pFh=pv , которая передается окружающей среде. С данным равновесным состоянием рабочего тела, характеризуемым параметрами p, v, связана энергия, складывающаяся из внутренней энергии самого рабочего тела и потенциальной энергии pv окружающей среды. Эта полная энергия расширенной системы целиком определяется состоянием рабочего тела и
численно представляет собой его энтальпию.
dq=qi – vdp,
q(1-2)=i(2)-i(1)-∫vdp. Эти выражения представляют собой аналитическое выражение первого закона термодинамики через энтальпию.
Энтропия. Для термодинамич. системы, совершающей квазистатически (бесконечно медленно) циклич. процесс, в к-ром система последовательно получает малые кол-ва теплоты dQ при соответствующих значениях абс. темп-ры Т, интеграл от «приведённого» кол-ва теплоты dQ/T по всему циклу равен нулю.
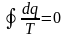 (
равенство Клаузиуса)
(
равенство Клаузиуса)
Это
равенство, эквивалентное второму началу
термодинамики для равновесных процессов,
Клаузиус получил, рассматривая
произвольный циклич. процесс как сумму
очень большого (в пределе бесконечно
большого) числа элементарных Карно
циклов. Математически равенство
Клаузиуса необходимо и достаточно для
того, чтобы выражение dS=dQ/T представляло
собой полный дифференциал ф-ции состояния
S(энтропия).
15 5
14 2 16
3
![]()



![]()




![]()
0 30 31
2


![]()
