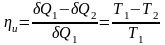- •Система единиц си. Основные и дополнительные единицы.
- •Здесь формула
- •Закон сохранения момента импульса точки
- •27. Энтропия, ее статистическое толкование
- •29. Испарение, конденсация, сублимация, плавление и кристаллизация.
- •30. Электрический заряд. Ионизация. Элементарный заряд. Закон сохранения электрического заряда.
Закон сохранения момента импульса точки
Если сила, действующая на точку равна нулю или сила не равна нулю, но момент силы равен нулю, то момент импульса точки остается с течением времени постоянным.
Если внешние силы таковы, что моменты сил относительно т. О = 0, т.е.
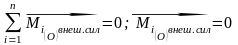 ,
тогда
,
тогда
 .
.
Замечание: внутренние силы изменяют моменты импульсов отдельных частей системы, но изменяют так, что сумма этих изменения равна нулю.
14. постулаты специальной теории относительности.
СТО— теория, описывающая движение, законы механики и пространственно-временные отношения при произвольных скоростях движения, меньших скорости света в вакууме, в том числе близких к скорости света.
I. 1) все физ-ие процессы (законы, явления)(механические, химич, оптические) протекают одинаково во всех инерциальных системах отчета
Замечания: 1) этот постулат расширяет механ-ий принцип относительности на всеобщий принцип и носит название принцип относительности Энштейна
2) все ИСО равноправны
II. 2) ск света в вакууме одинакова во всех ИСО и не зависит от скорости движения источника и приемника сигнала. c=3*108 м/с – ск света вакууме.
Замечания: 1) этот постулат явл следствием принципа причинности. (двигаясь со ск света можно увидеть только темноту)
2) для ск света в вакууме не выполняется класс ический закон сложения скоростей
3) ск света в вакууме явл max допустимой скоростью движения материального объекта
(для нетрино 2-ой постулат нарушается т.е. нетрино двигается быстрее ск света)
15. следствия из преобразований Лоренца.
Кинематические формулы преобразований координат (xyz) и времени в СТОназ преобразованиями Лоренца.
Следствия: 1)релятивистское замедление хода часов
( - собственное время, промежуток времени между 2-мя событиями происходящих в одной точки системы K’; - промежуток времени между этими же событиями в системе K)
2) релятивистское сокращение длины объекта
( - длина объекта СО, в кот он покоится; - длина объекта СО, относительно кот он движется со ск V)
3) релятивистская масса ( - масса покоя, - масса объекта, движущегося со ск V – массы не одинаковы)
4) полная энергия релятивистской частицы
17. идеальный газ. Уравнение Клайперона-Менделеева.
Идеальный газ – сильно разреженный газ с малой плотностью
Характеристика идеального газа:
В идеальном газе длина свободного пробега намного больше радиуса молекул
Внутренняя энергия явл только кинетической
За время свободного пробега частицы можно считать не взаимодействующими
Они взаимодейст только при столкновении
Столкновение молекул можно считать абсолютно упругим ударом , кинетическая энергия при этом не теряется
Идеаль газ невозможно увеличение давления или уменьшением объема превратить в жидкость. Идеаль газ существ при t-ре выше критической
Уравнение Клайперона-Менделеева.
pV/T=m/M*R где: р- давление (Па), V – объем (м3), Т – абсолютная t-ра (К)
для одного и того же кол-ва любого газа отношение pV/T=const=R=8,31 Дж/моль*К, где R- универсальная газовая постоянная.
ʋ=m/M – одна моль содержит столько же структурных единиц, сколько атомов содержится в 12 г С12, где ʋ - кол-во вещества (моль), М – Mr*10-3(г/моль)
отсюда pV=ʋRT
18. понятие о степенях свободы газовых молекул. Основное ур-е состояния идеального газа.
i- число степеней свободы – это число независимых переменных полностью характеризующих состояние системы
Газ из одноатомных молекул:
i=3 (поступательные степени свободы)
Газ из двух атомных молекул с жесткой связью, такая молекула напоминает гантель
I=3+2 ( может вращаться) Ʃi=5
Газ из двух атомных молекул с упругой связью
i=2+3+1 ( колебательная степень свободы) Ʃ=6
Газ из трех атомных молекул
i=6 (связи жесткие)
Ур-е состояния идеального газа
PV=N/NA*RT , где N-число молекул, Na=6,02*1023 – постоян Авогадро
R/NA=k=1,38 * 10-23 Дж/К, где к- постоян Больцмана
Отсюда PV/T=kN
20. температура. Термодинамическая шкала.
Температура- скалярная физ величина, характеризующая интенсивность теплового движения молекул изолированной системы [T] = 1 К
Температура есть мера средне квадратичной кинетической энергии молекул газа
Смысл средней кВ скорости
Средняя кв скорость определяет температуру газа
ТЕРМОДИНАМИЧЕСКАЯ ТЕМПЕРАТУРНАЯ шкала (Кельвина шкала) - абсолютная шкала температур, не зависящая от свойств термометрического вещества (начало отсчета - абсолютный нуль температуры). Построение термодинамической температурной шкалы основано на втором начале термодинамики и, в частности, на независимости кпд Карно цикла от природы рабочего тела. Единица термодинамической температуры - кельвин (К)
21. первое начало термодинамики.
Представ собой закон сохранения и превращения энергии для тепловых процессов.
Кол-во теплоты, переданное системе идет на приращение ее внутренней энергии и на совершение работы над внешними телами
Это в дифференциальной форме
Это в интегральной форме
Сдествие 1-го начал термодинамики: невозможность построения вечного двигателя (циклически работающая тепловая машина, кот могла бы работать без затрат энергии из вне – соверш работу но не получ теплоту) 1-го рода.
22. работа в термодинамике. Работа при изопроцесах в газах.
Работа в термодинамике– это изменение внутренней энергии системы, связанное с изменением ее объема и расположения ее частей относительно друг друга. Например, ударяя по куску свинца молотком, сгибая и разгибая проволоку или сжимая находящийся под поршнем в цилиндре газ, мы каждый раз совершаем над системой работу и тем самым изменяем ее внутреннюю энергию. Мерой изменения внутренней энергии при этом является величина совершенной работы. Работа газа положительна при расширении газа и отрицательна при его сжатии. На p–V-диаграмме работа газа численно совпадает (по модулю) с площадью фигуры под графиком зависимости давления от объема.
Работа при изопроцесах.
Изохорный . V-const Av=
Изобарный. p=const
Изотермический. T=const
23. теплоемкость. Уравнение Майера.
Тело теплоемкости - наз величина численно равная кол-ву теплоты, необходимому для изменения t-ры тела на один градус. Теплоемкость бывает:
Массовая – с – это теплоем одного кг данного вещ-ва [Дж/кг*К]
Молярная – С – это теплоем одного моль данного газа [Дж/моль*К]
Моляр теплоем в процее p=const, наз изобарный Cp, а в процессе V=const наз изохорный Cv
Удельная теплоем идеального газа зависит от харакетера процесса отвода и подвода теплоты, от атомности газа, и t-ры, теплоемкости реальных газов и от давления
Уравнение Майера
24. адиабатный процесс. Уравнение Пуассона.
Адиабат процесс- наз процесс происходящий без теплообмена с окр средой. Адиабатическим процессами можно считать все быстропротекающие процессы. Адиабатические процессы происходят в двигателях внутреннего сгорания , в холодильных установках и т. д.
25. второе начало термодинамики.
Осн формулировка- 2 закон термодинамики связан с необратимостью односторонней направленностью всех естественных в макромире
Формулировка Больцмана – природа стремится к переходу от менее вероятных состояний к более вероятным
Или- внутр энергия не может самопроизвольно переходить от тела с меньшей t-рой к телу с большей t-рой (вечный двигатель 2-го рода невозможен)
26. цикл Карно и его КПД для идеального газа.
Цикл Карно – это идеальный термодинамический круговой процесс. в котором совершается превращение теплоты в работу (или работы в теплоту).Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении. Описание: источник теплоты состоит: 1) нагревателя (тепловой резервуар с высокой t-ой Т1) 2) холодильника (тепловой резервуар с низкой t-ой Т2)
Четыре фазы цикла: 1) Изотермическое расширение: подвод теплоты Q1 горячего источника к рабочему телу. 2) Адиабатическое расширение: при Q=Const. Температура уменьшается от Т1 до Т2. 3) Изотермическое сжатие: отвод теплоты Q2 к холодному источнику от рабочего тела. 4) Адиабатическое сжатие: при Q=Const. Температура повышается от Т2 до Т1.
Карно доказал теорему: коэффициент полезного действия идеальной тепловой машины, в которой используется Цикл Карно, зависит только от температур нагревателя и холодильника, но не зависит от природы рабочего вещества
По
определению, коэффициент полезного
действия η
цикла
Карно есть: