
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
2.2. Постулаты квантово-механической теории
Квантово-механическая теория является основополагающей концепцией, принципы которой не могут быть выведены из каких-либо более общих теоретических построений. В соответствии с этим в основе квантовой механики, как и в основе любой другой фундаментальной теории, лежат постулаты - положения, справедливость которых гарантируется опытом, хотя они и не могут быть строго доказаны. Такими постулатами квантовой механики являются принцип корпускулярно-волнового дуализма и принцип неопределенности.
Принцип корпускулярно-волнового дуализма может быть сформулирован следующим образом (Луи де Бройль, 1924): каждому движущемуся материальному объекту можно поставить в соответствие волновой процесс. Если это положение справедливо, то должно существовать уравнение, связывающее корпускулярные свойства объекта (масса, скорость) с волновыми (длина волны или частота). Такое уравнение может быть строго выведено для фотона, частицы, движению которой соответствует распространение электромагнитной волны. Поскольку для фотона масса покоя равна нулю, а скорость движения частицы и скорость распространения волны одинаковы (с = 3108 м/с), энергия фотона может быть найдена как из уравнения Планка (E = h), описывающего волновой процесс, так и из уравнения Эйнштейна (E = mc2), характеризующего фотон как частицу. Приравнивая правые части этих уравнений и учитывая, что = с, получим
![]()
где р - импульс фотона, откуда
![]() (2-2)
(2-2)
Принцип де Бройля распространяет уравнение (2-2) на любые частицы, масса покоя которых отличается от нуля, а скорость (v) - от скорости света. В этом случае
![]() (2-3).
(2-3).
Волны, соответствующие движущимся частицам, получили название волн материи или волн де Бройля. Представить физическую сущность волн де Бройля несколько затруднительно. По концепции М. Борна волны де Бройля являются волнами вероятности: для пучка электронов вероятность появления частицы в определенном объеме пространства изменяется по волновому закону.
Волны материи могут быть зарегистрированы экспериментально. Так, Девиссон и Джермер (1927) обнаружили, что пучок электронов, направленный на грань монокристалла никеля, дает при отражении типичную интерференционную картину. При этом экспериментально определенные значения длин волн совпали с рассчитанными по уравнению де Бройля. В настоящее время волновые свойства обнаружены экспериментально у таких частиц как протоны, нейтроны и даже атомы гелия. Для макробъектов длины волн де Бройля очень малы (порядка 10-30-10-40 м); зарегистрировать такую волну экспериментально не представляется возможным.
Вторым основным постулатом квантовой механики является принцип неопределенности, сформулированный В. Гейзенбергом (1927). В классической физике точность измерения той или иной характеристики объекта определяется лишь разрешающей способностью используемого прибора и не зависит от того, насколько точно определены какие-либо другие характеристики объекта. В микромире картина принципиально меняется; в нем существуют характеристики, точное определение одной из которых препятствует определению другой. Таким свойством обладают, например, координаты частицы, определяющие ее положение в пространстве, и ее скорость или импульс. Соотношение неопределенности можно сформулировать следующим образом: принципиально невозможно одновременно точно определить положение микрочастицы в пространстве и ее импульс.
Продемонстрируем справедливость этого принципа с помощью следующего мысленного эксперимента. Пусть движущийся электрон освещают потоком фотонов, а отраженные фотоны регистрируют с помощью некого идеального детектора, пытаясь таким образом установить координаты и импульс микрочастицы. Положение частицы в пространстве задается координатами x, y , z, а ее импульс, являющийся векторной величиной, - его проекциями на координатные оси (px, py, pz). Очевидно, что при этом значение импульса будет характеризоваться некоторой неопределенностью (погрешностью определения), так как при столкновении фотона, имеющего собственный импульс, с электроном импульс последнего изменится. Точно также измерение координат будет проведено с некоторой неопределенностью, связанной с дифракцией фотонов на электроне, вследствие чего образ электрона будет размытым. При этом дифракция будет увеличиваться с увеличением длины волны излучения. Предположим, что наблюдатель желает максимально сократить неопределенность положения электрона, уменьшая для этого длину волны фотона. Однако это влечет за собой увеличение частоты излучения ( = с/), а также энергии и импульса фотона, так как
p
=
![]() (2-4)
(2-4)
где Ек - кинетическая энергия фотона. В результате в силу закона сохранения импульса столкновение с фотоном существенно изменит импульс электрона, погрешность его определения возрастет, а наблюдаемая траектория электрона станет зигзагообразной.

С другой стороны, уменьшение неопределенности импульса требует уменьшения импульса фотона, для чего необходимо уменьшить его энергию, а, следовательно, увеличить длину волны. Результатом этого будет усиление дифракции, а соответственно, увеличение неопределенности в значениях координат - экспериментатор увидит вместо точки размытое пятно, и не сможет установить, где именно в пределах этого пятна будет находится электрон.

Рассмотренный мысленный эксперимент показывает, что одновременно уменьшить неопределенность импульса и координат электрона принципиально невозможно.
Математически принцип неопределенности для частицы, движущейся в трехмерном пространстве, выражается тремя неравенствами:
xpx
ypy
zpz
где
а
и ра
неопределенности координат и проекций
импульса на координатные оси,
=
![]() = 1,0510-34
Джс.
= 1,0510-34
Джс.
Заметим, что координаты и импульс - не единственные физические характеристики, связанные принципом неопределенности. Так, для нестационарных состояний невозможно одновременно точно определить время существования состояния и его энергию.
Из принципа неопределенности вытекает несколько важных выводов, необходимых для правильного понимания особенностей микромира:
1. Микрочастица не имеет детерминированной (строго определенной) траектории. Для построения траектории движущегося тела необходимо знать закон, по которому происходит движение, и начальные условия - значения координат и импульса в какой-то момент времени. Принцип неопределенности это запрещает.
2. В микромире инструмент наблюдения взаимодействует с объектом наблюдения, изменяя его характеристики.
3. Модель атома должна быть вероятностной. Следует отказаться от попыток определить точные значения характеристик микрочастицы (координат, импульса, энергии и т.) и попытаться установить их вероятные значения.
При построении вероятностной модели атома пришлось отказаться от понятия "электронная орбита". В квантовой механике это понятие заменено понятием "электронная орбиталь". Электронная орбиталь - это область околоядерного пространства, в которой вероятность нахождения электрон существенно отличается от нуля. Невозможно установить, где именно в пределах орбитали в данный момент находится электрон, но можно оценить вероятность его пребывания в той или иной точке пространства. Таким образом, электрон как бы "размазан" (делокализован) в объеме электронной орбитали, образуя электронное облако.
Важнейшими характеристиками электронной орбитали являются ее граничная поверхность и функция радиального распределения вероятности нахождения электрона. Граничная поверхность определяет форму электронной орбитали (сфера, объемная восьмерка и т.д.). Обычно граничную поверхность строят таким образом, чтобы вероятность нахождения электрона в ограниченном ею пространстве составляла 90 или 95%. Функция радиального распределения показывает вероятность нахождения электрона на разных расстояниях от ядра. На рис. 1 и 2 показаны граничные поверхности и кривые радиального распределения для некоторых состояний электрона атома водорода.
Для основного состояния атома водорода (1s) граничная поверхность имеет форму сферы, а кривая радиального распределения вероятности проходит через максимум при r = 52,9 пм (1 пм = 10-12 м). Заметим, что данная величина совпадает с радиусом первой боровской стационарной орбиты. На этом примере прослеживаются отличия модели атома водорода по Н. Бору от квантово-механической модели - то, что в теории Бора является радиусом первой стационарной орбиты, в квантовой механике характеризуется как наиболее вероятное расстояние между электроном и ядром.

Рис. 1. Форма граничной поверхности s-, p- и d-орбиталей. Указаны также математические знаки
соответствующих волновых функций
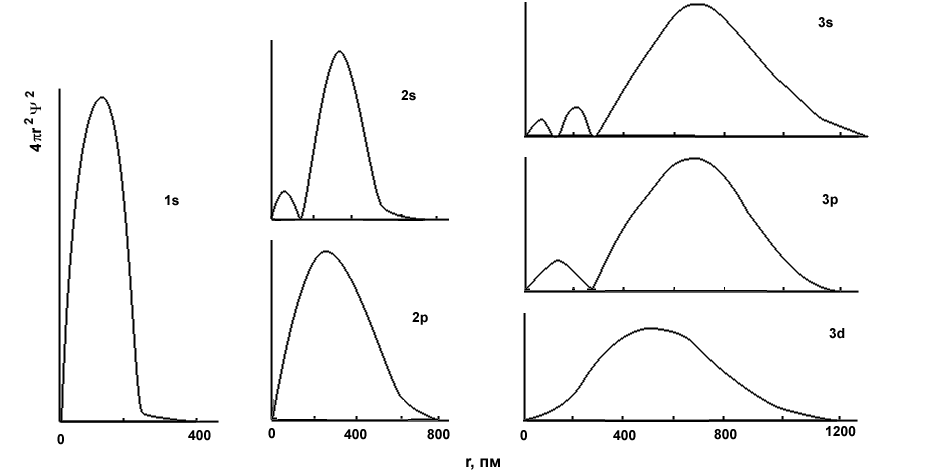
Рис. 2. Кривые радиального распределения вероятности нахождения электронов для некоторых орбиталей
атома водорода
