
- •Процессы окисления
- •13.1. Общая характеристика процессов окисления
- •Окисление без изменения углеродного скелета молекулы
- •13.1.2. Деструктивное окисление с изменением углеродного скелета молекулы
- •13.1.3. Окисление, сопровождающееся связыванием молекул исходных реагентов (окислительная конденсация или окислительное сочетание)
- •13.2. Окислительные агенты и техника безопасности в процессах окисления
- •13.3. Окисление по насыщенному атому углерода
- •13.3.1. Получение фенола и ацетона. Сравнительные характеристики методов получения фенола.
- •13.3.2. Окисление парафинов
- •13.3.3. Окисление циклоалканов и их производных
- •13.4. Окисление ароматических соединений.
- •13.4.1 Получение ароматических альдегидов и карбоновых кислот.
- •13.4.2. Получение хинонов.
13.4. Окисление ароматических соединений.
В ряду ароматических соединений реакции окисления можно подразделить на два типа:
реакции без изменения углеродного скелета молекулы.
реакции с изменением (разрушением) углеродного скелета молекулы.
К первой группе реакций относится окисление алкильных групп в алкилароматических производных, а также образование хинонов и фенолов:

![]()

![]()

Ко второй группе реакций окисления относятся реакции, приводящие к изменению углеродного скелета. Примерами подобных реакций могут служить окисление нафталина и аценафтена до фталевого ангидрида и нафталевого ангидрида:


Все процессы окисления являются экзотермическими. Поэтому необходимо предусматривать хорошие условия теплопередачи.
13.4.1 Получение ароматических альдегидов и карбоновых кислот.
Получение ароматических альдегидов с использованием реакций окисления представляет собой достаточно сложный процесс, поскольку альдегиды очень легко окисляют до соответствующих карбоновых кислот. Поэтому окисление метилзамещенных ароматических соединений до соответствующих альдегидов проводят с использованием мягких окислителей. Таким окислителями, в частности, могут являться диоксид марганца в водной серной кислоте (температура не выше 40оС), сульфат марганца (III), диоксид селена. Примерами подобных реакций могут служить получение бензальдегид-2,4-дисульфокислоты и 2-нафтальдегида:


Д остаточно
гладко альдегидная группа может быть
получена при окислительном гидролизе
хлорметильных производных. В качестве
окислителей в данном случае могут быть
использованы либо бихромат натрия в
водном растворе едкого натра, либо смесь
водной перекиси водорода и раствора
едкого натра:
остаточно
гладко альдегидная группа может быть
получена при окислительном гидролизе
хлорметильных производных. В качестве
окислителей в данном случае могут быть
использованы либо бихромат натрия в
водном растворе едкого натра, либо смесь
водной перекиси водорода и раствора
едкого натра:
Окисление метильной группы до карбоксильной группы может быть осуществлено с использованием различных окислителей: перманаганат калия в воде или в кислой среде, бихромат натрия в кислой среде, азотная кислота.
Примерами подобных реакций могут служить получение п-нитробензойной кислоты и изофталевой кислоты из п-нитротолуола и м-ксилола, соответственно:


При жидкофазном каталитическом окислении толуола кислородом воздуха при атмосферном давлении 160-180оС в присутствии Co2(OH)2CO3 и NaBr образуется п-толуиловая кислота. В более жестких условиях (260-280оС, 7 Мпа) происходит окисление второй метильной группы, в результате чего образуется терефталевая кислота, но с выходом только 40-60%.

Н епосредственно
тетрефталевую кислоту получают из-
п-ксилола путем окисления в присутствии
ацетата собальта (II) и
бромида натрия при 150-170оС и давлении
до 4 МПа. Терефталевая кислота и ее эфиры
широко используются в полимерной
промышленности (производство лавсана,
пластификаторов). Диметиловый эфир
терефталевой кислоты может быть получен
по следующей схеме:
епосредственно
тетрефталевую кислоту получают из-
п-ксилола путем окисления в присутствии
ацетата собальта (II) и
бромида натрия при 150-170оС и давлении
до 4 МПа. Терефталевая кислота и ее эфиры
широко используются в полимерной
промышленности (производство лавсана,
пластификаторов). Диметиловый эфир
терефталевой кислоты может быть получен
по следующей схеме:
Два важных продукта образуется при гетерогенно-каталитическом окислении бензола и нафталина: малеиновый ангидрид и фталевый ангидрид. Фталевый ангидрид получают также гетерогенно-каталитическим окислением о-ксилола.

Окисление бензола до малеинового ангидрида проводят в кожухотрубном реакторе со стационарным слоем катализатора. Окисление начинается при температуре выше 350оС. Поэтому первоначально бензоло-воздушную смесь нагревают до необходимой температуры. Само окисление является экзотермическим процессом. Поэтому необходим интенсивный отвод тепла. В качестве теплоносителя используется расплавленная нитрит-нитратная смесь. Полученная после контактирования смесь охлаждается. При этом выделяется до 50% малеинового ангидрида. Непоглощенный малеиновый ангидрид далее поглощается водой с образованием малеиновой кислоты.
Аналогичным образом проводят окисление о-ксилола до фталевого ангидрида.

Фталевый ангидрид может быть также получен при окислении нафталина. В этом случае процесс ведут в аппарате с псевдоожиженным слоем катализатора. Нафталин подается в зону окисления в расплавленном состоянии в виде нафталино-воздушной смеси.
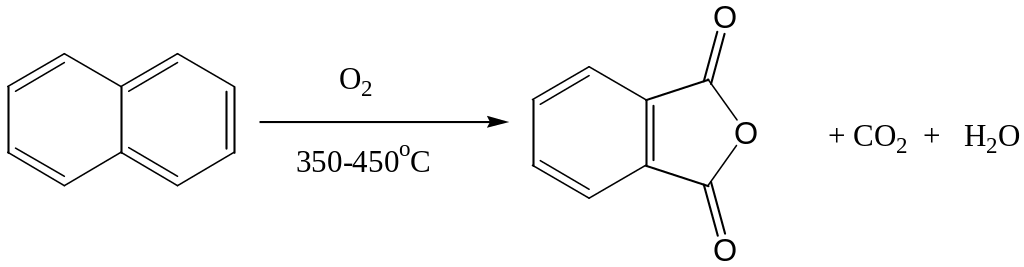
Фталевый ангидрид широко используется в тонком органическом синтезе, в производстве красителей, пластификаторов для полимерной промышленности и т.д. Важным химическим применением фталевого ангидрида является его использование в качестве исходного соединения в процессе получения антраниловой кислоты.
Первоначально фталевый ангидрид обработкой водным раствором аммиака превращают последовательно в фталимид и моноамид фталевой кислоты:

Д алее
аммонийную соль переводят в натриевую
и проводят перегруппировку Гофмана:
действием гипохлорита или гипобромита
натрия (смесь брома и раствора едкого
натра) амид превращают в амин. Механизм
реакции включает образование изоцианата
в качестве промежуточного продукта:
алее
аммонийную соль переводят в натриевую
и проводят перегруппировку Гофмана:
действием гипохлорита или гипобромита
натрия (смесь брома и раствора едкого
натра) амид превращают в амин. Механизм
реакции включает образование изоцианата
в качестве промежуточного продукта:


