
- •Раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4 Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •9.2.5 Способы осуществления экстракции
- •9.2.6. Применение экстракции
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Природа комплексообразователя и лигандов
Устойчивость комплексных соединений зависит от природы комплексообразователя и лигандов. Так, устойчивость комплексов ионов d-элементов с различными лигандами изменяется в ряду
Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+
Данный ряд называется рядом устойчивости Ирвинга - Уильямса.
Закономерность изменения устойчивости многих комплексов металлов с различными лигандами можно объяснить с помощью теории жёстких и мягких кислот и оснований (ЖМКО) Р.Пирсона. Согласно данной теории кислоты и основания Льюиса разделяются на жёсткие и мягкие. Жесткие кислоты обладают конфигурацией внешнего электронного слоя s2p6 - такой же, как и благородные газы. Они имеют малый размер и низкую поляризуемость. К ним относится большинство катионов щелочных и щелочноземельных металлов, а также элементов главной подгруппы III группы периодической системы. Жесткими кислотами являются также катионы некоторых d-элементов с неполностью занятым d-подуровнем, например, Mn2+, Cr3+, Co3+, Ti4+. Самая жёсткая кислота - катион H+, который вообще не имеет электронной оболочки. К мягким кислотам относятся, как правило, катионы d-элементов в невысоких степенях окисления, например, Ag+, Hg2+, Hg22+, Cd2+ и т.п. Такие катионы имеют большой размер и легко поляризуются.
У оснований (лигандов) степень жёсткости зависит от их размера. Чем больше атом или соответствующий ему анион, тем легче он поляризуется и тем выше степень его «мягкости». Например, F- является жёстким основанием, Cl- - занимает промежуточное положение между жёсткими и мягкими основаниями, а Br - и I- относятся к мягким основаниям.
Мягкость кислот или оснований увеличивается по мере уменьшения абсолютной величины заряда иона. Например, Cu2+ является кислотой средней жёсткости, а Cu+ - мягкой. Cтепень «мягкости» катиона металла зависит и от природы связанного с ним лиганда. Например, ион Co2+ в аммиачном комплексе ведёт себя как жёсткая кислота, а в цианидном - как мягкая.
Согласно теории ЖМКО
Например, ионы Al3+, Be2+ «предпочитают» образовывать комплексы с O- и N- содержащими органическими лигандами (жёсткими основаниями). Для ионов Ag+ или Hg2+, наоборот, лучше подходят S-содержащие органические реагенты (мягкие основания).
Комплексы катионов металлов с полидентатными лигандами являются более устойчивыми, чем комплексы с аналогичными монодентатными лигандами. Данное явление называется хелатным эффектом. Хелатный эффект обычно объясняется тем, что реакция сольватированного катиона металла с хелатобразующим лигандом приводит к большему увеличению энтропии, чем реакция с монодентатным лигандом.
Комплексы металлов с макроциклическими лигандами (пример таких лигандов - краун-эфиры) более устойчивы, чем комплексы с аналогичными лигандами с открытой цепью. Данное явление называется макроциклическим, или суперхелатным эффектом.
Концентрация реагентов
Процесс образования комплексов, содержащих в своём составе более одного лиганда, протекает ступенчато, поэтому в растворе наряду со свободными ионами металла и свободным лигандом будут присутствовать несколько видов комплексов, представляющих собой результат присоединения к иону металла разного числа лигандов. Молярные доли этих комплексов, а также молярную долю свободных ионов металла можно рассчитать следующим образом.
![]()
![]()
![]() ...
...
![]()
![]() =
=
![]()
![]()
![]()
![]()
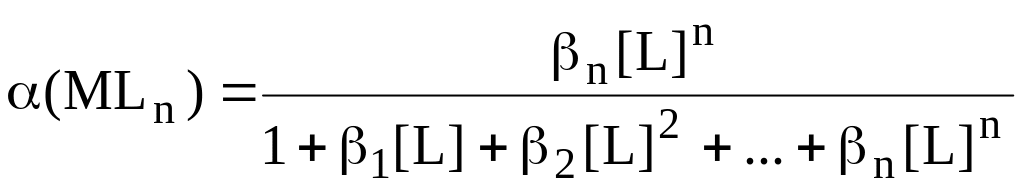
Пример 5.1. Рассчитать равновесные концентрации частиц Ag+ и [Ag(NH3)2]+ в растворе с общей концентрацией катионов серебра 1,010-2 моль/л и равновесной концентрацией NH3 1,010-3 моль/л.
![]()
![]() моль/л
моль/л
![]()
![]() моль/л
моль/л
Сумма, стоящая в знаменателе выражений для расчёта (M) и (MLn), называется функцией закомплексованности - F(L). Она представляет собой отношение общей концентрации катиона металла к равновесной концентрации иона металла, не связанной в комплексы.
![]()
![]()
![]()
Значение
F(L)
может изменяться от 1 до
![]() .
Если комплексообразование отсутствует,
то [M]
= CM
и F(L)
= 1. Если же, наоборот, практически все
ионы металла связаны в комплексы, то
F(L)
.
Если комплексообразование отсутствует,
то [M]
= CM
и F(L)
= 1. Если же, наоборот, практически все
ионы металла связаны в комплексы, то
F(L)
![]() .
.
Отношение концентрации лиганда, вошедшего в комплексы, к общей концентрации ионов металла называется средним лигандным числом (функцией образования).
![]()
Среднее
лигандное число показывает среднее
число лигандов, связанных с ионом металла
во всех образующихся при данных условиях
комплексах или, для монодентатных
лигандов, среднее координационное число
центрального иона. Значение
![]() может изменяться от 0, если комплексообразование
отсутствует, до nмакс,
если в растворе присутствует только
один комплекс с максимально возможным
для данного вида комплексов числом
лигандов. В промежуточных случаях, когда
в растворе находятся несколько комплексов,
значение
может быть дробным. Значение среднего
лигандного числа при некоторой величине
[L]
можно рассчитать следующим образом
может изменяться от 0, если комплексообразование
отсутствует, до nмакс,
если в растворе присутствует только
один комплекс с максимально возможным
для данного вида комплексов числом
лигандов. В промежуточных случаях, когда
в растворе находятся несколько комплексов,
значение
может быть дробным. Значение среднего
лигандного числа при некоторой величине
[L]
можно рассчитать следующим образом
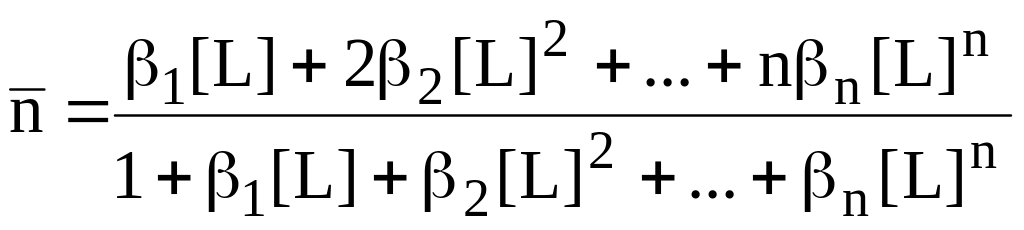
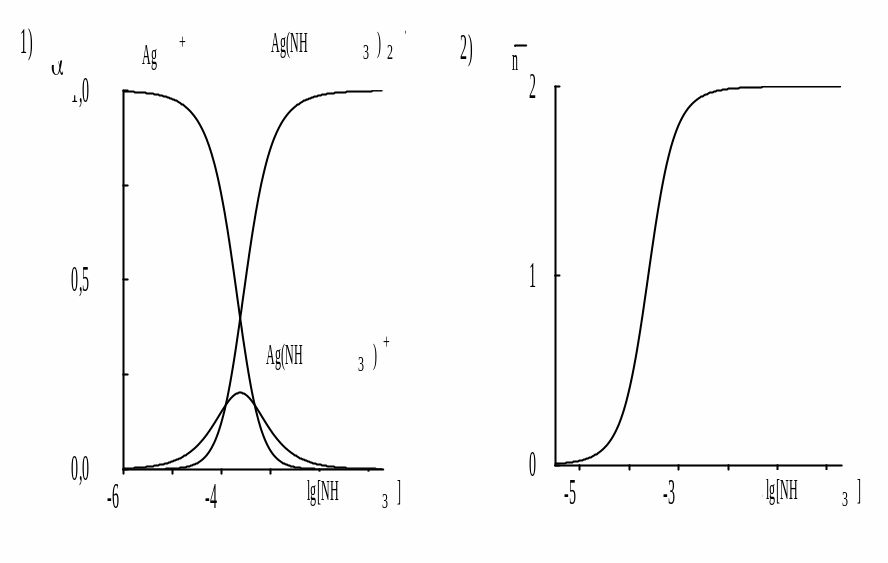
Рис. 5.1. Распределительная диаграмма (1) и кривая образования (2) для аммиачных комплексов серебра
Зависимость молярных долей компонентов системы (свободных ионов металла и различных комплексов) от lg[L] (или -lg[L]) называется распределительной диаграммой для данных комплексов. Зависимость от lg[L] (или -lg[L]) называется кривой образования комплекса (рис. 5.1).
