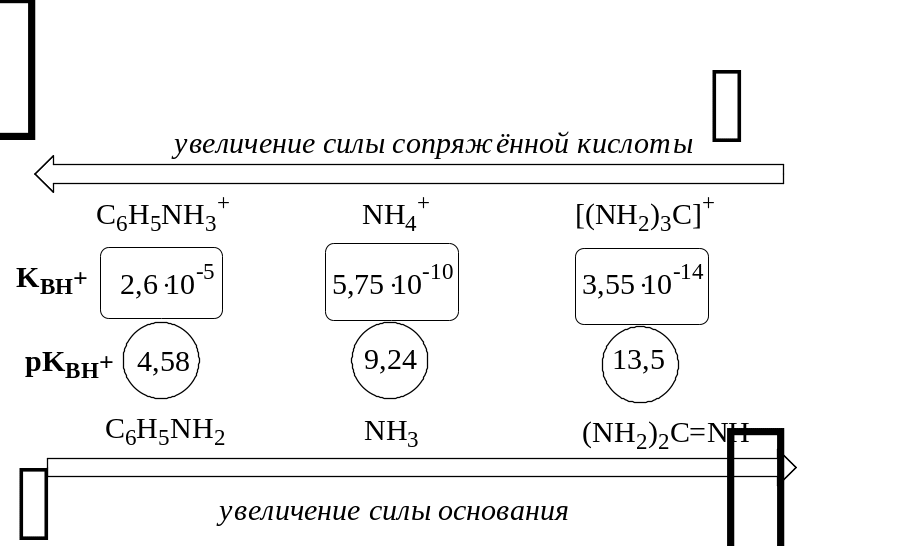- •Раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4 Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •9.2.5 Способы осуществления экстракции
- •9.2.6. Применение экстракции
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Глава 4
4.1. Важнейшие теории кислот и оснований
Первая научная теория кислотности была предложена в 1780-х годах А. Лавуазье. Согласно данной теории все кислоты должны были обязательно содержать атом кислорода, что и было отражено в названии этого элемента.

В 1816 году Г. Дэви высказал предположение, что в состав кислот должен обязательно входить атом водорода. В 1833 году Ю. Либих уточнил это определение - кислота - вещество, в состав которого входят атомы водорода, способные замещаться атомами металла.
В 1880-х годах С. Аррениус и В. Оствальд предложили ионную теорию кислот и оснований, согласно которой
В 1923 году почти одновременно появились ещё 2 теории кислот и оснований. Автором первой были датский химик И.Н. Брёнстед и английский химик Т.М. Лоури, а второй – американский физикохимик Г.H. Льюис. Согласно теории Брёнстеда - Лоури, названной протолитической теорией кислот и оснований:
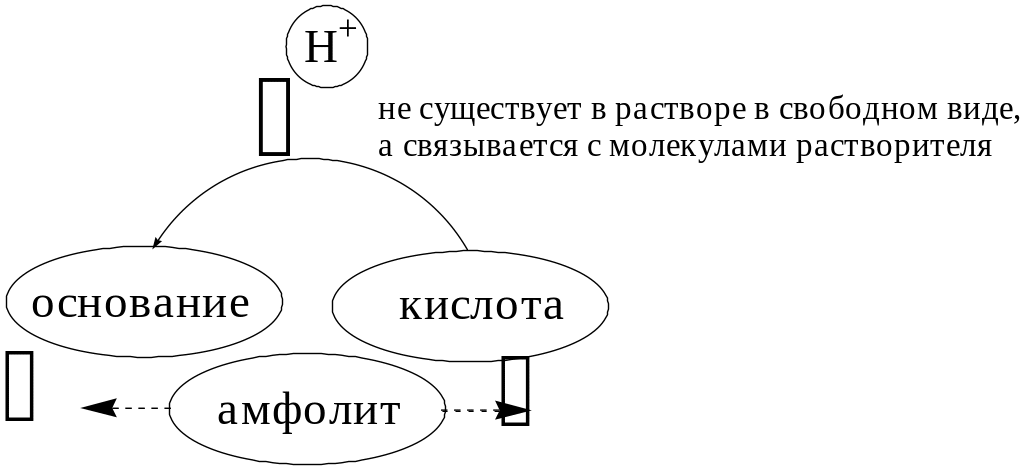
Кислоты, основания и амфолиты могут быть как электронейтральными, так и иметь заряд.

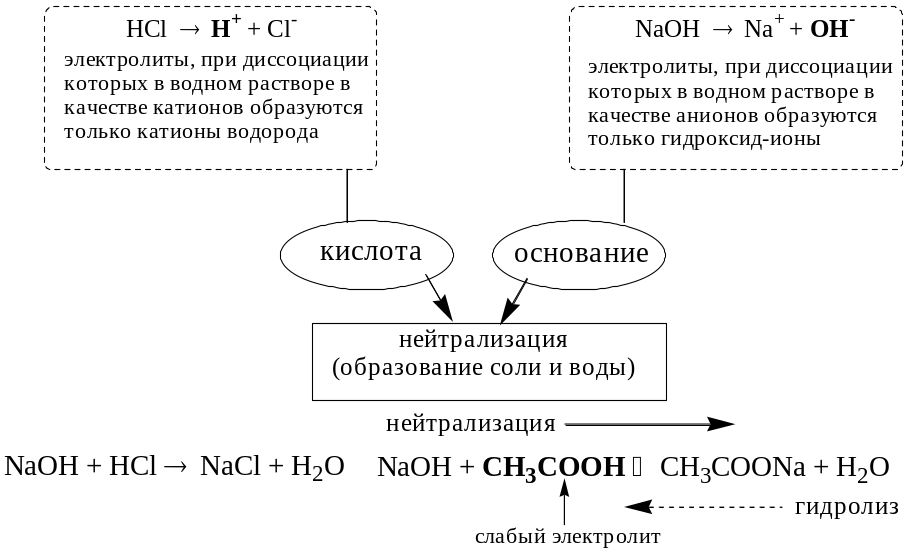
Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к основанию. Кислоты и основания существуют как сопряжённые пары. В процессе взаимодействия друг с другом кислота и основание не исчезают, например, образуя соль, а превращаются в новое основание и новую кислоту.
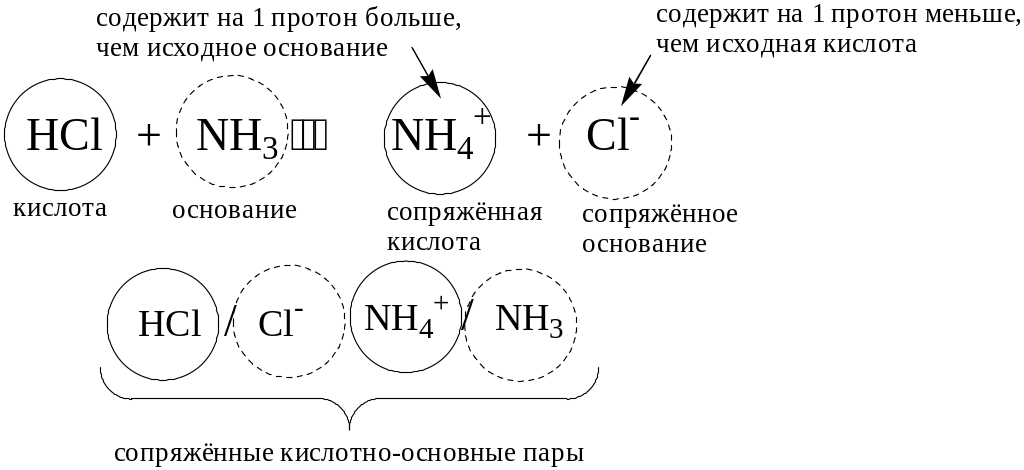
Понятие «соль» в протолитической теории вообще не используется и, тем более, отсутствует понятие «гидролиз соли». Так, например, тот факт, что раствор NH4Cl имеет слабокислую среду, объясняется не гидролизом данной соли с образованием слабого электролита NH4OH и сильного электролита HCl, а тем, что катион аммония является слабой кислотой. Более того, никакого «слабого электролита» NH4OH на самом деле не существует (связь между атомами кислорода и азота не может быть ковалентной, так как азот не бывает пятивалентным).
Согласно теории Льюиса, названной электронной теорией кислот и оснований
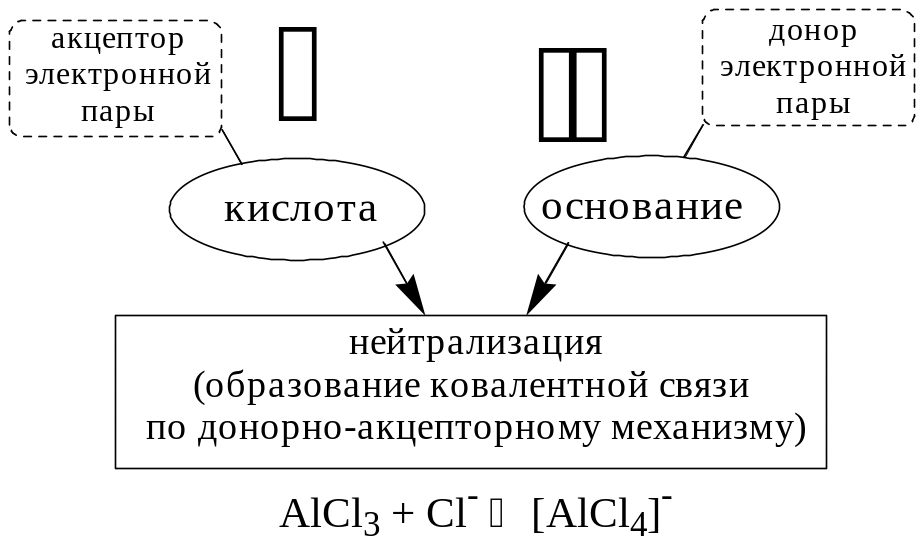
Основания Брёнстеда и основания Льюиса представляют собой одни и те же соединения, понятие «кислота» согласно протолитической и электронной теориям отличается.
В аналитической химии преимущественно используется протолитическая теория. Это связано с тем, что теория Льюиса имеет слишком общий характер и её трудно применить для количественных расчётов.
4.2. Количественное описание силы кислот и оснований
Для количественной характеристики силы кислот, находящихся в растворе, используют константу, характеризующую способность кислоты отдавать протон молекуле растворителя, выступающей в качестве основания. Такая константа называется константой кислотности (Ka).

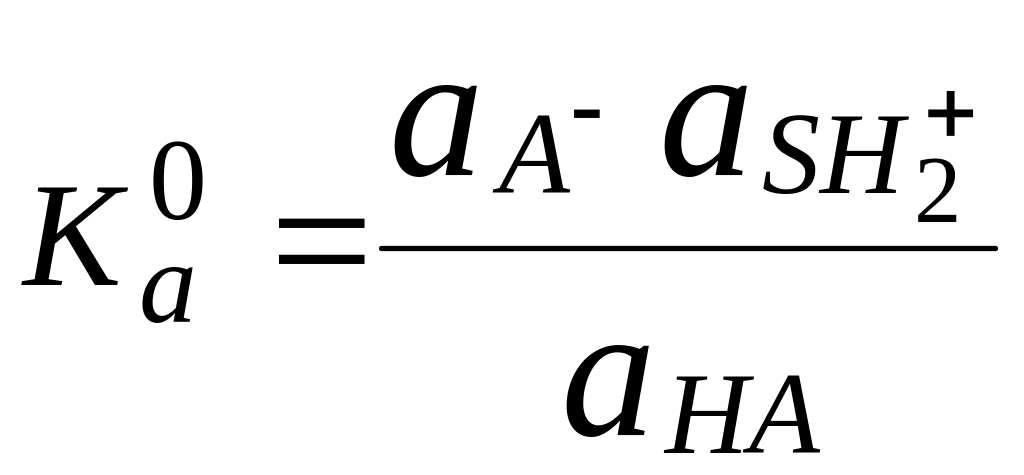
![]()
![]()
Активность растворителя не входит в выражение константы, так как считается равной 1.
Для водных растворов
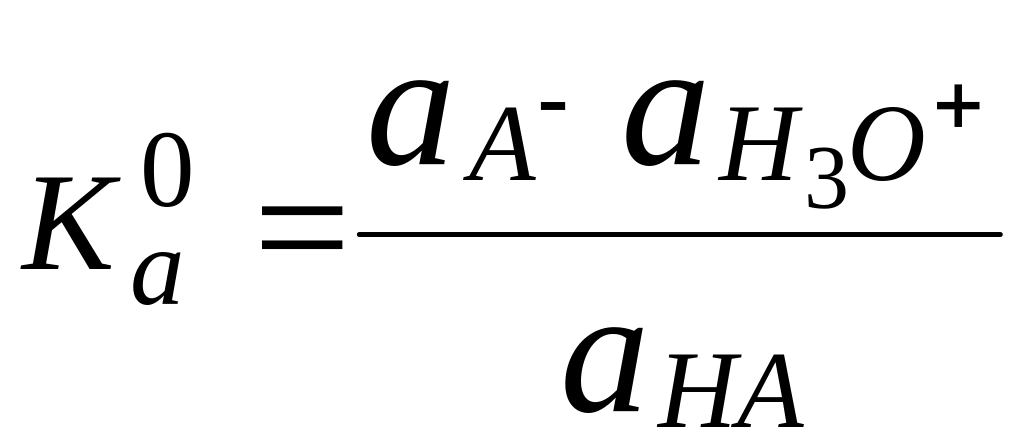
![]()

Силу оснований можно описывать двояко: с помощью константы основности (Kb) либо с помощью константы кислотности сопряженной кислоты (KBH+ или Ka). В случае водных растворов данные константы описывают следующие равновесия:
B + H2O BH+ + OH- BH+ + H2O B + H3O+
![]()
![]()
Константа основности в современной аналитической химии практически не применяется. Это связано с тем, что при использовании данной константы, приходится работать с активностью (или концентрацией) гидроксид-ионов, в то время как среду раствора принято описывать с помощью концентрации ионов водорода. Кроме того, при использовании константы кислотности сопряжённой кислоты все протолиты (и кислоты и основания) можно объединить в одну таблицу. Константа основности не несёт никакой новой информации, так как её легко рассчитать, зная величину константы кислотности сопряжённой кислоты.
Обозначения KBH+ и Ka равнозначны между собой. Первый из них мы в дальнейшем будем использовать в тех случаях, когда речь идёт о характеристике силы основания через сопряжённую с ним кислоту. Это особенно удобно в случае сложных органических молекул, содержащих несколько кислотных и основных центров.
![]()