
- •Раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4 Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •9.2.5 Способы осуществления экстракции
- •9.2.6. Применение экстракции
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Уравнение Нернста
Влияние активности компонентов, участвующих в процессе, и температуры на величину потенциала описывается уравнением Нернста
![]()
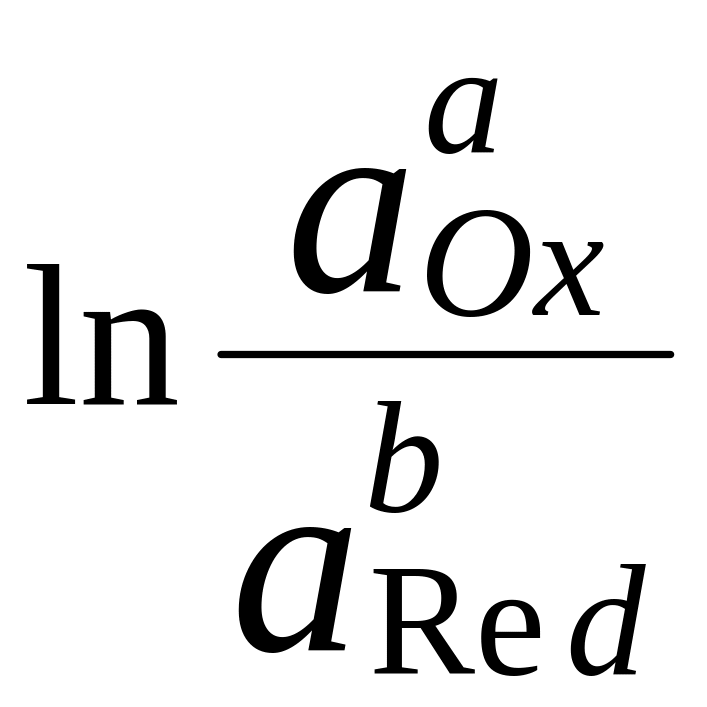
Если объединить постоянные величины в одну константу, а натуральный логарифм заменить десятичным, то при T = 298 К
![]()
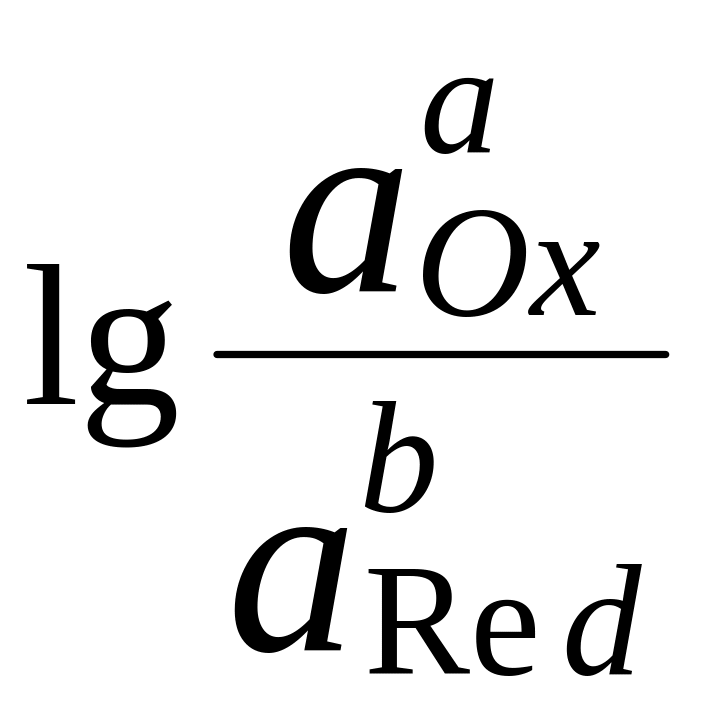
Например,
для Cr2O72-
+ 14H+
+
![]()
2Cr3+
+ 7H2O
2Cr3+
+ 7H2O
![]()
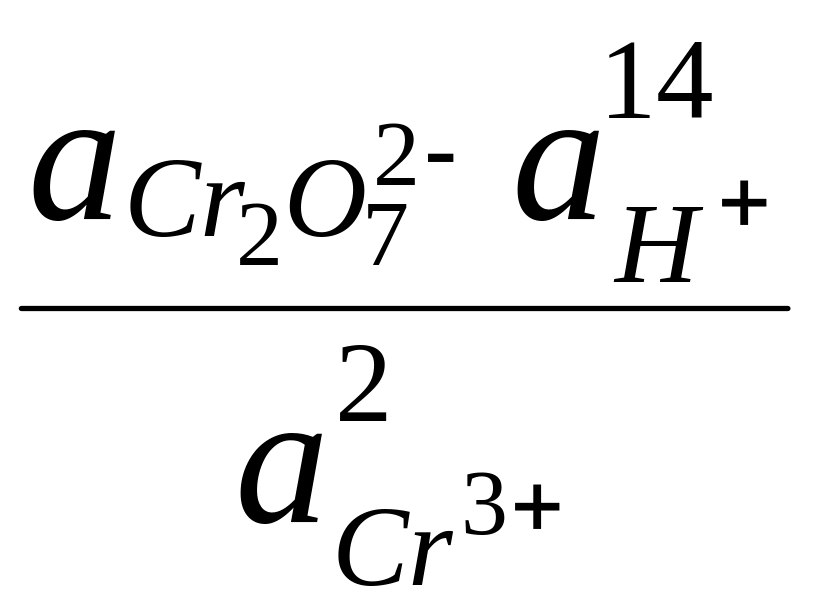
Формальный
электродный потенциал
![]() -
это
потенциал полуреакции, измеренный при
условии, что концентрации окисленной
и восстановленной формы равны 1 моль/л,
а концентрации посторонних ионов
известны.
-
это
потенциал полуреакции, измеренный при
условии, что концентрации окисленной
и восстановленной формы равны 1 моль/л,
а концентрации посторонних ионов
известны.
![]()
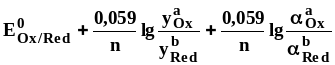
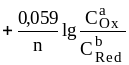
Формальный электродный потенциал является аналогом условной концентрационной константы равновесия в рассмотренных ранее равновесиях. Он равен выделенной полужирным шрифтом сумме первых трех членов в приведенном выше уравнении. Величина формального потенциала зависит от ионной силы раствора, природы и концентрации посторонних электролитов. Например, для Fe3+/Fe2+:

Константа равновесия окислительно-восстановительной реакции
Способность одного вещества отдавать электроны другому веществу можно оценить также с помощью константы равновесия окислительно-восстановительной реакции. Эта константа связана с ЭДС реакции следующим образом. Пусть реакция между окислителем Ox1 и восстановителем Red2 состоит из двух полуреакций (полуреакцию с участием Red2 для удобства запишем как процесс восстановления окисленной его формы):
Ox1
+ n1
Red1
![]()
Ox2
+ n2
Red2
![]()
Наименьшее общее кратное для n1 и n2 обозначим как m. Суммарное уравнение реакции будет иметь следующий вид
aOx1 + bRed2 aRed1 + bOx2,
где a = m/n1, b = m/n2.
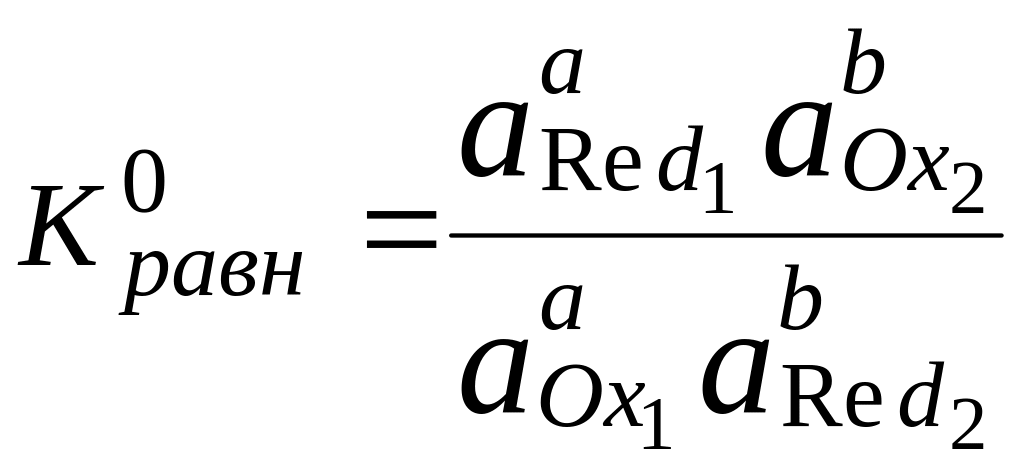
В
состоянии равновесия G
= 0, Е
= 0 и
![]() =
=
![]()
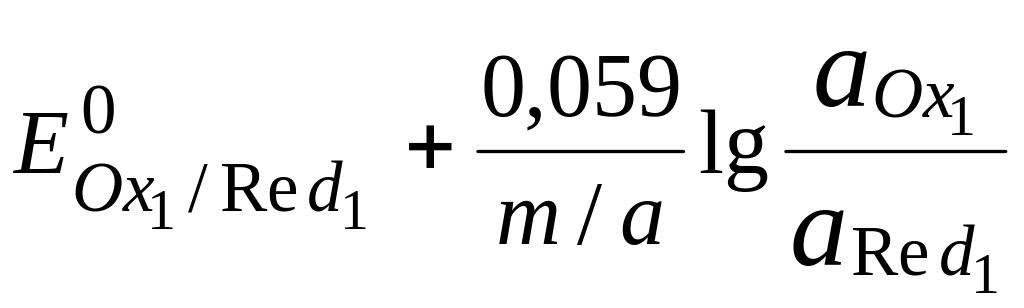 =
=

-
=
![]()

![]()
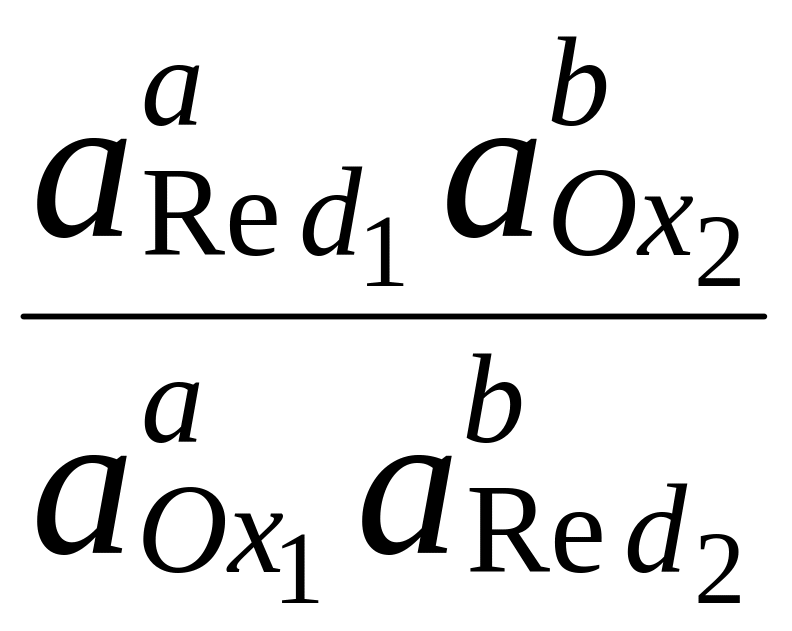 =
=
![]()
![]()
Обратите внимание, что в выражение для расчёта константы равновесия окислительно-восстановительной реакции входит не произведение числа электронов n1 и n2, а их наименьшее общее кратное m, которое может быть равно этому произведению, а может быть и не равно.
Если lgK > 0, реакция может самопроизвольно протекать в прямом направлении. Чем больше величина K, тем больше “глубина” протекания окислительно-восстановительной реакции.
Пример 7.3. Рассчитать термодинамическую константу равновесия реакции
![]()
![]()
если
![]() ,
,
![]()
![]()
![]()
7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
Температура влияет как на константу равновесия окислительно-восстановительных реакций, так и на их скорость. Как правило, окислительно-восстановительные реакции обладают большим тепловым эффектом, поэтому изменение температуры оказывает значительное влияние на константу равновесия. Однако, часто константы равновесия окислительно-восстановительных реакций настолько велики, что и при увеличении температуры на несколько десятков градусов реакция остаётся практически необратимой.
Многие окислительно-восстановительные реакции идут при комнатной температуре медленно (например, реакция окисления оксалат-ионов перманганат-ионами), и для их проведения требуется нагревание. Иногда, наоборот, нагревание является нежелательным, так как приводит к улетучиванию реагирующих или образующихся веществ (например, при использовании в качестве окислителя иода), повышению скорости реакции окисления веществ кислородом воздуха и т.д.
