
Лабораторная работа №61
Определение коэффициента взаимодиффузии паров воды и воздуха
Составитель: Г. А.Бугнина, к.ф.-м.н., доцент
Рецензент: К. А. Иойлева, к.ф.-м.н., доцент
Цели работы:
Изучить основные закономерности явлений переноса в газах.
Ознакомиться с молекулярно-кинетической теорией диффузии в газах.
Определить опытным путем коэффициент взаимодиффузии паров воды и воздуха.
Сравнить экспериментальное и теоретическое значение коэффициента взаимодиффузии паров воды и воздуха.
Оборудование:
Установка ФПТ-4 – лабораторный модуль, который содержит:
тонкий капилляр,
микроскоп для измерения скорости испарения жидкости,
датчик температуры жидкости и пара в капилляре,
таймер для измерения времени испарения,
Лабораторный термометр для измерения комнатной температуры.
Лабораторный барометр для измерения атмосферного давления.
Теоретическое введение
Диффузия в газах
Диффузия может возникать в любом веществе (жидком, твердом и газообразном), если в нем имеется несколько различных компонентов, концентрация которых меняется от точки к точке. Каждый из компонентов смеси переходит из тех частей, где его концентрация больше, туда, где она меньше, т.е. в направлении падения концентрации.
Количество
перенесенной вследствие диффузии массы
вещества за единицу времени через
единицу площади, перпендикулярной
направлению переноса, называется
плотностью потока массы (![]() )
)
 (кг/c·м2);
– это средняя плотность потока;
(кг/c·м2);
– это средняя плотность потока;
 – это мгновенное
значение локальной плотности потока
массы.
– это мгновенное
значение локальной плотности потока
массы.
Аналогично можно
выразить плотность потока числа молекул
перенесенных при диффузии:
![]() .
.
Основной закон диффузии – закон Фика
Закон Фика установлен опытным путем. Опыт показывает, что диффузионный поток какого-либо компонента смеси пропорционален градиенту концентрации этого компонента (или градиенту его плотности).
Градиентом какой-либо скалярной величины называется вектор, характеризующий быстроту изменения этой величины в пространстве и направленный в сторону наиболее быстрого ее возрастания.
Если концентрация (n) диффундирующего вещества меняется только вдоль оси х, а вдоль y и z остается неизменной, то градиент концентрации равен:
![]()
![]() ;
Аналогично,
;
Аналогично,
![]() ,
,
где – плотность диффундирующего вещества.
и n
связаны очевидным соотношением:
![]() = m0n,
где m0
– масса одной молекулы.
= m0n,
где m0
– масса одной молекулы.
Таким образом, закон Фика может быть записан так:
![]() или
или
![]() (1)
(1)
Знак – в законе Фика указывает на то, что направления диффузионного потока и градиента противоположны: газ диффундирует в сторону меньшей концентрации, а градиент направлен в сторону большей концентрации.
Коэффициент пропорциональности в законе Фика называется коэффициентом диффузии. Его физический смысл в том, что он численно равен плотности диффузионного потока при единичном градиенте, равном единице.
Исходя из закона Фика можно выразить массу продиффундировавшего вещества:
![]() (2)
(2)
Процесс диффузии может быть стационарным и нестационарным. Стационарная диффузия имеет место при постоянном (не меняющемся со временем) градиенте концентрации. Следовательно, остается постоянным во времени и диффузионный поток. Такую ситуацию надо поддерживать специальными мерами, например, подавать диффундирующий газ с одной стороны сосуда и отбирать его с другой.
Молекулярно-кинетическая теория идеального газа позволяет объяснить эмпирический закон Фика и получить теоретическую формулу для коэффициента диффузии идеальных газов:
![]() , (3)
, (3)
где
![]() – средняя длина свободного пробега
молекул,
– средняя длина свободного пробега
молекул,![]() – средняя статистическая скорость
молекул.
– средняя статистическая скорость
молекул.
Учитывая формулы молекулярно-кинетической теории (МКТ) идеального газа для и , а именно:
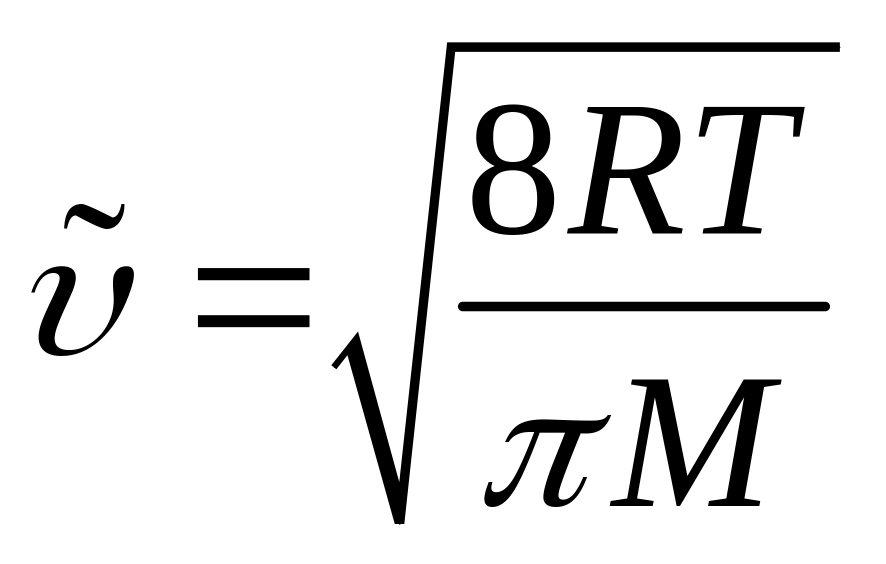 ,
,
 ,
,
![]() ,
,
(где Р и Т – параметры
состояния (давление и абсолютная
температура газа),
![]() и
и
![]() – молярная масса и эффективное сечение
столкновения молекул газа), можно видеть,
что коэффициент диффузии газа
– молярная масса и эффективное сечение
столкновения молекул газа), можно видеть,
что коэффициент диффузии газа
![]() и
и
![]() .
.
Эти теоретические выводы соответствуют опыту.
Нестационарная диффузия имеет место в тех случаях, когда по каким-либо причинам меняется со временем градиент концентрации (и плотности) диффундирующего вещества. Типичным примером является диффузия в замкнутом объеме. В процессе диффузии градиент концентрации каждой компоненты будет уменьшаться, пока не станет равным нулю. В конце процесса каждая компонента смеси за счет диффузии займет весь объем сосуда плотностью и равномерно.
Взаимная диффузия газов.Коэффициент взаимной диффузии
Рассматривая диффузию газов, надо принимать во внимание, что одновременно происходят два процесса: диффузия первого газа во втором и второго газа в первом, т.е. имеет место взаимная диффузия газов.
Коэффициент взаимной диффузии двух газов D12 выражается следующей теоретической формулой:
 (4)
(4)
где ρ – плотность смеси,
![]() и
и
![]() – парциальные плотности первой и второй
компонент смеси или относительные
плотности компонент смеси.1
– парциальные плотности первой и второй
компонент смеси или относительные
плотности компонент смеси.1
![]() ,
,
![]() – средние длины свободного пробега
молекул первой и второй компонент смеси,
– средние длины свободного пробега
молекул первой и второй компонент смеси,
![]() и
и
![]() –
средние скорости молекул соответственно.
–
средние скорости молекул соответственно.
Из формулы ()
видно, что если относительная плотность
какой-либо компоненты мала, например
![]() ,
то для другой компоненты
,
то для другой компоненты
![]() .
Следовательно, вторым слагаемым в ()
можно пренебречь.
.
Следовательно, вторым слагаемым в ()
можно пренебречь.
Тогда:
 (5)
(5)
В данной лабораторной работе изучается диффузия водяного пара в атмосферном воздухе. При комнатных температурах давление водяного пара (Рнп) много меньше атмосферного давления воздуха Рат. Для сравнения: при t = 20С, Рнп = 2,33·103 Па, а Рат = 105 Па. Из этого примера можно видеть, что при температурах, близких к комнатным, водяной пар в атмосферном воздухе является малой примесью.
