
- •Изучение распределения Максвелла на модели газа
- •Теоретическая часть Распределение молекул идеального газа по скоростям
- •Характерные скорости распределения Максвелла
- •Распределение Максвелла – равновесное распределение
- •Практическая часть Идея метода
- •Контрольные вопросы
- •Распределение молекул по компонентам скорости
- •Распределение молекул по скоростям
- •Список литературы
Лабораторная работа №49
Изучение распределения Максвелла на модели газа
Составитель: О. В. Сергеева, к.ф.-м.н., доцент
Рецензент: И. А. Малиненко, к.ф.-м.н., доцент
Цель работы
Изучить распределение молекул газа по скоростям.
Изучить влияние температуры и массы молекул на вид распределения.
Изучить характерные скорости распределения.
Сравнить полученный для модели газа результат распределения молекул по скоростям с теоретическим распределением Максвелла.
Задачи
Получить распределение молекул по скоростям для модели газа.
Рассчитать характерные скорости распределения для модели газа.
Изучить влияние рабочих параметров ни вид распределения для модели газа.
Сравнить полученный вид распределения для модели газа с распределением Максвелла.
Оборудование
Устройство для моделирования распределения молекул газа по скоростям.
Приемники с ячейками для сбора шариков.
Блок питания на 0-12 В или 0-20 В.
Соединительные провода.
Кюветы.
Емкости для взвешивания.
Набор стеклянных шариков.
Весы.
Секундомер.
Линейка.
Теоретическая часть Распределение молекул идеального газа по скоростям
После достижения равновесного состояния в системе, состоящей из огромного количества частиц, например, в некотором объеме газа, при отсутствии внешних воздействий не происходит макроскопических изменений. Макропараметры системы остаются постоянными. Однако в системе происходят микропроцессы: непрерывные столкновения молекул между собой, в результате чего меняется скорость каждой молекулы, как по своему значению, так и по направлению. В газе из-за хаотического движения все направления движения молекул равновероятны. Иначе обстоит дело со значениями скоростей. Можно предположить, что по абсолютному значению скорости молекул изменяются от нуля до бесконечности. Но будут ли все эти значения равновероятны?
Согласно молекулярно-кинетической теории, как бы не изменялись скорости молекул при столкновениях, средняя квадратичная скорость υкв молекул массой mo в газе, находящемся в состоянии равновесия при постоянной температуре Т, остается постоянной и равной
 (1)
(1)
Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется определенному статистическому закону.
Пусть
данная масса газа содержит N
молекул. Тогда число молекул dN,
скорости которых имеют значения от υ
до υ + dυ,
должно быть
пропорционально рассматриваемому
количеству молекул. Вместе с тем, оно
должно быть пропорционально величине
заданного интервала d![]() и зависеть
от самого значения скорости: υ.
и зависеть
от самого значения скорости: υ.
dN = N·F(υ)·dυ, (2)
где F(υ) – функция, характеризующая распределение молекул газа по скоростям. Функция F(υ) определяет долю молекул (или относительное число молекул dN/N), приходящихся на некоторый интервал скоростей dυ. Из соотношения (2) получим, что
![]() (3)
(3)
Функцию F(υ), определенную таким образом, называют функцией распределения или плотностью вероятности. Функция F(υ) удовлетворяет условию нормировки:
 (4)
(4)
Интеграл
 представляет собой вероятность того,
что молекула имеет одно из значений
скорости в пределах от 0 до
представляет собой вероятность того,
что молекула имеет одно из значений
скорости в пределах от 0 до
![]() .
Так как скорость молекулы всегда имеет
какое-то определенное значение, то
вероятность указанного события – это
вероятность достоверного события,
которая равна единице.
.
Так как скорость молекулы всегда имеет
какое-то определенное значение, то
вероятность указанного события – это
вероятность достоверного события,
которая равна единице.
Для того чтобы найти dN при любых значениях υ, необходимо знать вид функции распределения F(υ). Распределение молекул по скоростям, описываемое этой функцией, впервые было установлено в 1859 году Джеймсом Кларком Максвеллом и поэтому называется распределением Максвелла. Эта функция распределения определяется как
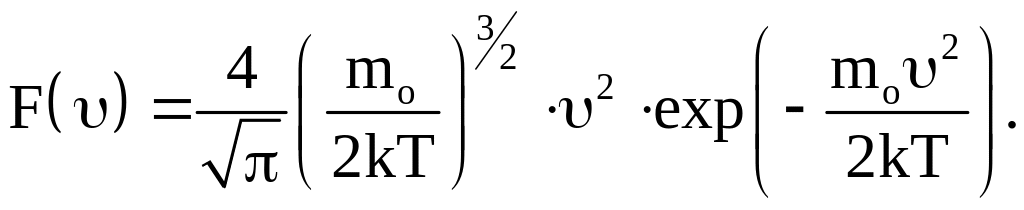 (5)
(5)
Вид функции Максвелла зависит от температуры и от массы молекул. Показатель экспоненты равен отношению кинетической энергии молекулы к ее энергии теплового движения. Вывод формулы (5) приведен в Приложении 1.
Закон распределения Максвелла по абсолютным значениям скоростей выполняется для макросистемы при соблюдении следующих условий:
состояние системы равновесно, T = const;
внешние поля отсутствуют;
газ однороден по составу, mo = const;
движение частиц системы подчиняется законам классической механики.
Закон Максвелла – статистический, то есть выполняется тем точнее, чем к большему числу объектов (частиц) применяется.
Графический
вид распределения Максвелла представлен
сплошной линией на рис. 1. Поскольку
множитель
 при возрастании υ убывает быстрее, чем
возрастает множитель υ2,
то кривая F(υ) ассиметрична. Она начинается
от нуля, достигает максимума, а затем
асимптотически стремится к нулю. Слева
от максимума кривая идёт круче, чем
справа.
при возрастании υ убывает быстрее, чем
возрастает множитель υ2,
то кривая F(υ) ассиметрична. Она начинается
от нуля, достигает максимума, а затем
асимптотически стремится к нулю. Слева
от максимума кривая идёт круче, чем
справа.
Относительное число молекул dN/N, скорости которых лежат в интервале от υ до υ + dυ, находится как площадь dS заштрихованной полоски на рис. 2. Площадь, ограниченная всей кривой распределения и осью абсцисс, равна единице. Это означает, что функция F(υ) удовлетворяет условию нормировки (4).
Из того, что кривая асимптотически приближается к оси абсцисс при бесконечно больших скоростях, следует, что молекул с очень большими скоростями мало. Для того чтобы молекула могла приобрести при столкновениях очень большую скорость, ей необходимо совершить много таких столкновений, при которых она получает энергию, и ни одного столкновения, при котором она ее теряет. Такая ситуация маловероятна, поэтому большие и слишком малые значения скорости молекул по сравнению с максимальным значением должны быть крайне редки.
Р ис.1.
Распределение
Максвелла по абсолютным значениям
ис.1.
Распределение
Максвелла по абсолютным значениям
скоростей.
