
- •Е. И. Степановских, л. А. Брусницына, т. А. Алексеева физическая химия Примеры решения задач
- •Рекомендации по оформлению решений
- •2. Способы линеаризации опытных данных.
- •Термодинамические свойства простых веществ и соединений
- •3. Расчет изменений энтропии, энтальпии и энергии гиббса чистого вещества
- •5. Расчеты экстенсивных свойств системы с химическим превращением. Химическое равновесие
- •6. Фазовые равновесия
- •6.1. Фазовые равновесия в однокомпонентных системах
- •6.2. Фазовое равновесие в двухкомпонентных системах
- •Приложения
- •Часть 1
- •620002, Екатеринбург, Мира, 19
3. Расчет изменений энтропии, энтальпии и энергии гиббса чистого вещества
Расчеты изменений
энтропии в различных процессах основаны
на использовании неравенства Клаузиуса,
которое связывает изменение энтропии
![]() с количеством теплоты
с количеством теплоты
![]() ,
которым система обменивается с окружающей
средой при температуре
,
которым система обменивается с окружающей
средой при температуре
![]()
![]() .
(3.1)
.
(3.1)
В данном случае знак равенства имеет место при обратимых, а неравенства – при необратимых процессах.
Величину энтропии данной системы нельзя измерить непосредственно на опыте, но ее можно вычислить, пользуясь формулой
![]() .
(3.2)
.
(3.2)
Эта формула позволяет найти не абсолютную величину энтропии, а разности энтропий в двух состояниях системы, т.е. изменение энтропии при переходе системы из состояния 1 в состояние 2.
Изменение энтропии при постоянном давлении можно найти интегрированием частной производной энтропии по температуре при постоянном давлении
![]() ,
(3.3)
,
(3.3)
где
![]()
изобарная теплоемкость системы, Дж/К.
изобарная теплоемкость системы, Дж/К.
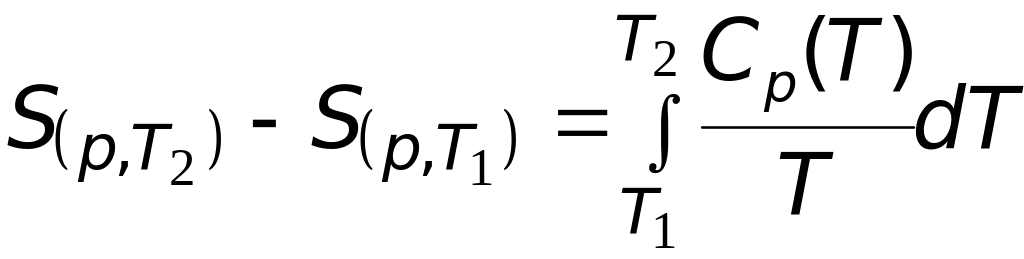 .
(3.4)
.
(3.4)
При решении уравнения (3.4) возможно два случая.
Случай 1.
Теплоемкость вещества в интервале
температур
![]() −
−![]() не зависит от температуры. Тогда после
интегрирования (3.4) имеем:
не зависит от температуры. Тогда после
интегрирования (3.4) имеем:
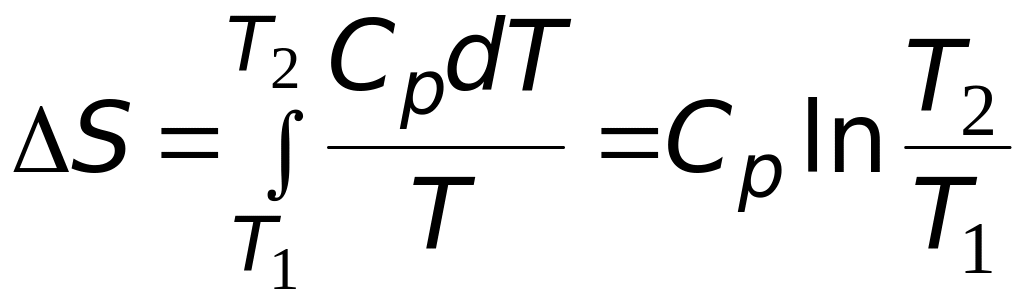 .
(3.5)
.
(3.5)
Случай 2. Теплоемкость является некоторой функцией температуры, например для мольной изобарной теплоемкости известны так называемые температурные ряды
![]() ,
(3.6)
,
(3.6)
где
![]()
эмпирически найденные коэффициенты.
Их значения приводятся в справочной
литературе.
эмпирически найденные коэффициенты.
Их значения приводятся в справочной
литературе.
Подстановка выражения (3.6) в (3.4) позволяет после интегрирования получить следующее выражение
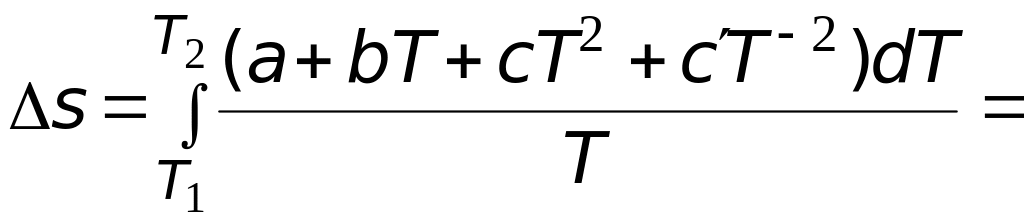
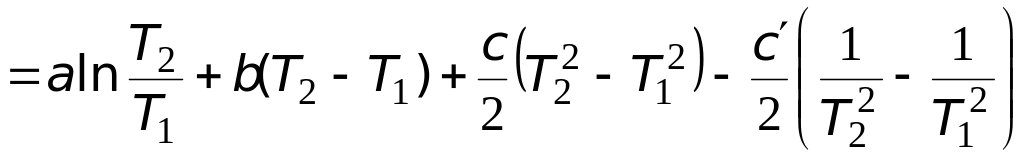 .
(3.7)
.
(3.7)
Разность энтропий в двух состояниях вычисляется просто, если обратимый переход из одного состояния в другое происходит при постоянной температуре. Это имеет место, например, при переходах из одного агрегатного состояния в другое, при фазовых переходах. Равновесные фазовые превращения (испарение, плавление, возгонка и т.д.) происходят в условиях постоянства температуры и давления. Они возможны только при подведении (или отводе) теплоты, затрачиваемой на проведения фазового превращения. Тогда формула (3.4) принимает вид
![]() ,
(3.8)
,
(3.8)
где
![]()
скрытая теплота фазового превращения.
скрытая теплота фазового превращения.
При постоянном давлении скрытая теплота превращения равна изменению энтальпии, т.е. например, для фазового превращения испарения − формула (3.8) примет вид
![]() ,
(3.9)
,
(3.9)
где
![]()
энтальпия испарения, Дж;
энтальпия испарения, Дж;
![]()
температура
кипения, К.
температура
кипения, К.
Если вещество в
указанном диапазоне температур
претерпевает фазовое превращение, то
общее изменение энтропии будет
складываться из нескольких слагаемых.
Например, пусть некое условное вещество
А
переходит из твердого состояния при
температуре
![]() в жидкое состояние при температуре
в жидкое состояние при температуре
![]() .
Из условия задачи видно, что при
определенной температуре имеет место
фазовое превращение (фазовый переход)
плавление. Находим в справочнике эту
температуру, обозначим ее в общем виде
.
Из условия задачи видно, что при
определенной температуре имеет место
фазовое превращение (фазовый переход)
плавление. Находим в справочнике эту
температуру, обозначим ее в общем виде
![]()
![]() .
Общее изменение энтропии будет равно
сумме трех слагаемых (так называемых
вкладов).
.
Общее изменение энтропии будет равно
сумме трех слагаемых (так называемых
вкладов).
![]() .
(3.10)
.
(3.10)
Первый вклад в общее изменение энтропии это изменение энтропии при нагреве твердого вещества от температуры до температуры плавления
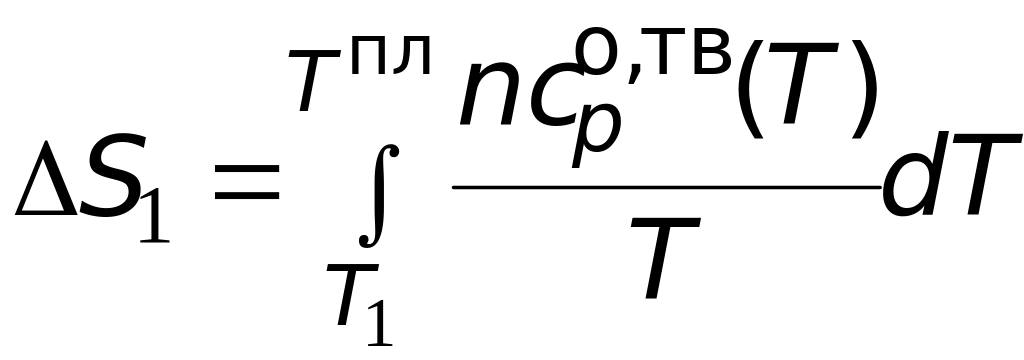 .
(3.11)
.
(3.11)
При температуре плавления твердое состояние переходит в жидкое, при этом наблюдается изменение энтропии. Изменение энтропии при фазовом превращении:
![]() .
(3.12)
.
(3.12)
И, наконец, последний вклад в общее изменение энтропии внесет изменение энтропии при дальнейшем нагреве уже образовавшейся жидкости от температуры плавления до температуры
 .
(3.13)
.
(3.13)
Абсолютная мольная энтропия газообразного вещества в стандартном состоянии при температуре Т может быть найдена как сумма изменений мольной энтропии в следующих процессах: нагрев исследуемого вещества в твердом состоянии от нуля до температуры плавления; процесс плавления; нагрев жидкого вещества до температуры кипения; испарение жидкости; нагрев полученного газообразного вещества до нужной температуры.

+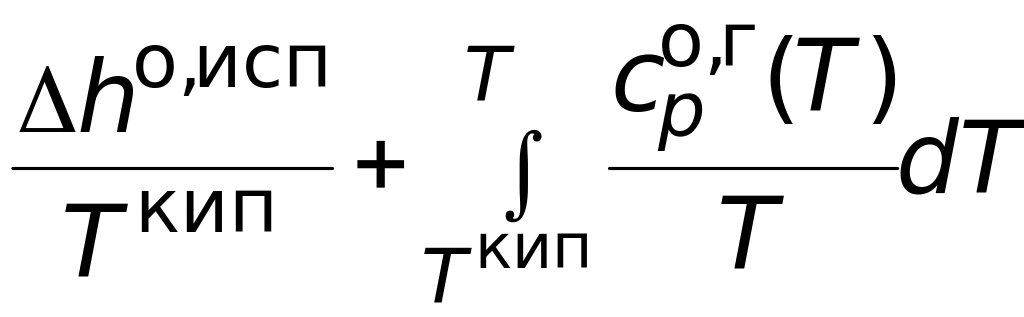 .
(3.14)
.
(3.14)
В справочных термодинамических таблицах обычно приводят значения абсолютной энтропии в стандартном состоянии при температуре 298 К . Тогда расчет абсолютного значения энтропии при какой-либо другой температуре можно произвести исходя из значения энтропии при 298 К, используя формулу (3.14) и учитывая агрегатное состояние исследуемого вещества при 298 К.
Для расчета изменения энтальпии системы, в которой нет химической реакции, а только происходит изменение температуры, например, при постоянном давлении, воспользуемся определительным выражением изобарной теплоемкости
![]() ,
отсюда
,
отсюда
![]() .
(3.15)
.
(3.15)
Так же как и при расчете энтропии, тут возможно два случая.
Случай 1.
Теплоемкость
вещества в интервале температур
![]() −
не
зависит от температуры. Тогда после
интегрирования (3.15) имеем:
−
не
зависит от температуры. Тогда после
интегрирования (3.15) имеем:
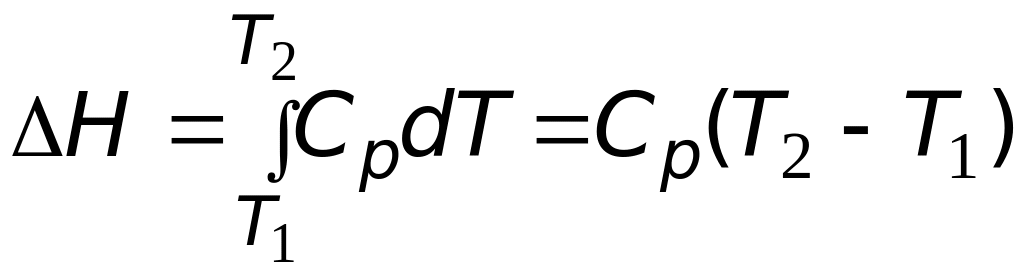 .
(3.16)
.
(3.16)
Случай 2. Теплоемкость является некоторой функцией температуры. Подстановка выражения (3.6) в (3.16) позволяет после интегрирования получить следующее выражение
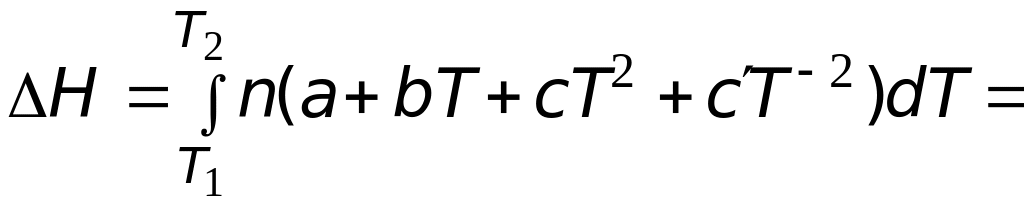
![]() .
(3.17)
.
(3.17)
Если в указанном
диапазоне температур возможно фазовое
превращение, как это было рассмотрено
в вышеприведенном примере с нагревом
твердого вещества А,
то все изменение энтальпии
![]() будет равно сумме
будет равно сумме
![]() ,
(3.18)
,
(3.18)
где
![]()
вклад в общее изменение энтальпии за
счет процесса нагрева
твердого вещества от температуры
вклад в общее изменение энтальпии за
счет процесса нагрева
твердого вещества от температуры
![]() до температуры плавления
до температуры плавления
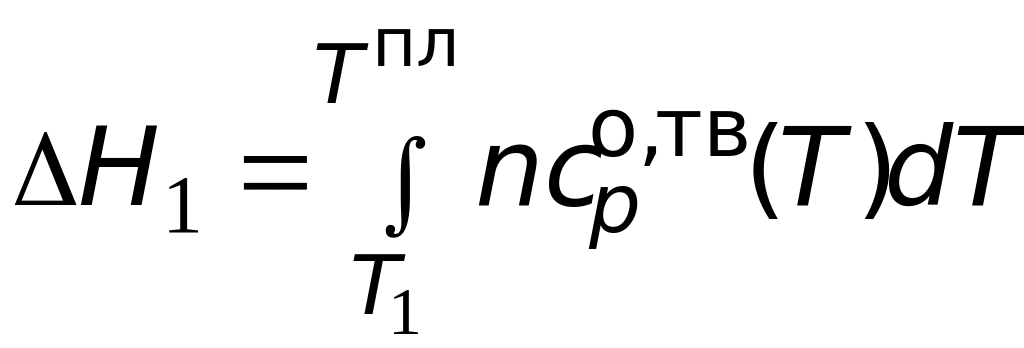 ,
(3.19)
,
(3.19)
![]() изменение
энтальпии за счет фазового превращения,
это энтальпия фазового перехода,
находится в справочниках;
изменение
энтальпии за счет фазового превращения,
это энтальпия фазового перехода,
находится в справочниках;
![]()
изменение энтальпии
за счет дальнейшего нагрева системы
от температуры фазового перехода до
нужной температуры. Очевидно, что форма
уравнения для расчета
будет аналогичной (3.19), только
коэффициенты температурного ряда
теплоемкости нужно брать для жидкого
вещества А.
изменение энтальпии
за счет дальнейшего нагрева системы
от температуры фазового перехода до
нужной температуры. Очевидно, что форма
уравнения для расчета
будет аналогичной (3.19), только
коэффициенты температурного ряда
теплоемкости нужно брать для жидкого
вещества А.
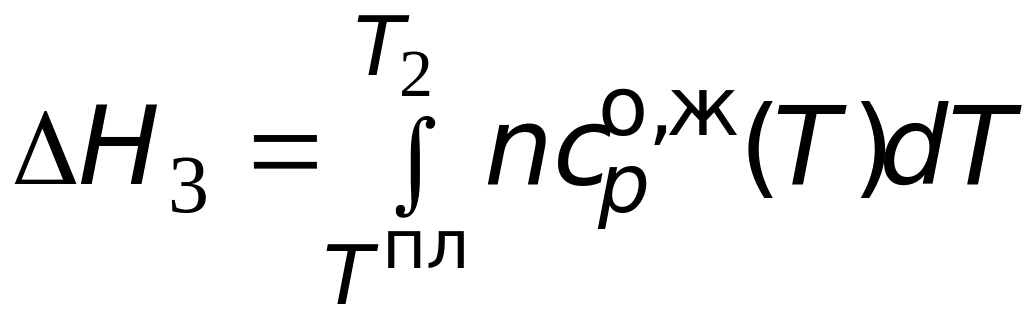 .
.
Для расчета изменения энергии Гиббса чистого вещества при переходе его из состояния I в состояние II удобно использовать расчетную формулу:
![]() .
(3.20)
.
(3.20)
Более подробно расчет изменения энергии Гиббса будет рассмотрен при решении задачи.
Примеры задач
Пример 1. Вычислите изменение энтропии 1 кг этиленгликоля при его нагреве от температуры 100 до 300 оС.
Решение. Используя справочную литературу, определим коэффициенты температурных зависимостей теплоемкостей жидкого и газообразного этиленгликоля, температуру фазового превращения и величину мольной энтропии фазового превращения.
![]() =
151,0 Дж/(мольК).
=
151,0 Дж/(мольК).
![]() =
=
= 46,26 + 0,2005T 77,90106 T 2 Дж/(мольК).
= 479,4 К.
Мольная энтропии
испарения
![]() = 103,4 Дж/(моль·К).
= 103,4 Дж/(моль·К).
Производим расчеты.
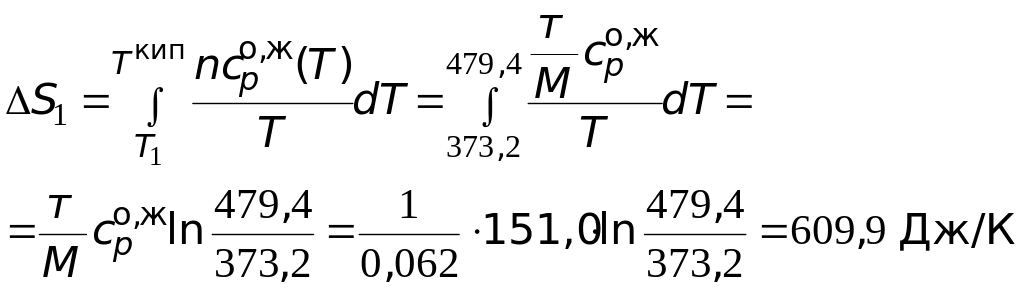
![]() =
=![]() 1667,7 Дж/К.
1667,7 Дж/К.
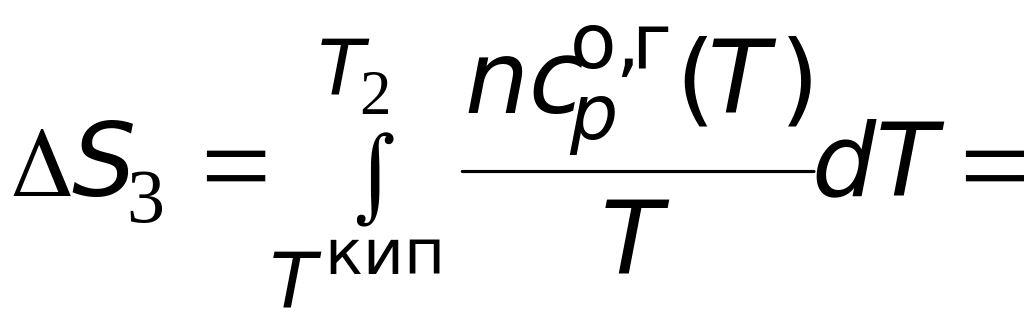
![]() =
=
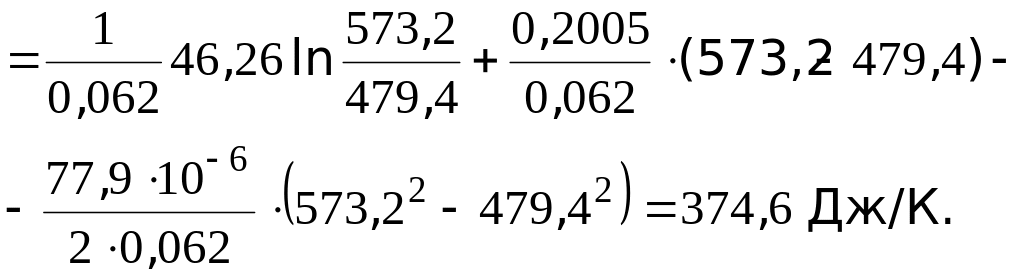
= 2652,2 Дж/К = 2,65 кДж/К.
Пример 2. Чему равна мольная энтропия этиленгликоля при температуре 350 К?
Решение.
Формула
(3.14) для расчета абсолютного значения
энтропии при определенной температуре
в рассматриваемом примере упрощается.
В качестве
нижнего уровня отсчета можно использовать
абсолютное значение энтропии при 298 К
и давлении 1 атм. Это справочная величина,
она равна
![]() = 167,32 Дж/(мольК).
Выражение для расчета абсолютного
значения мольной энтропии этиленгликоля
при 350 К будет иметь вид
= 167,32 Дж/(мольК).
Выражение для расчета абсолютного
значения мольной энтропии этиленгликоля
при 350 К будет иметь вид
![]() .
.
И при 298 К, и при
350 К этиленгликоль находится в одинаковом
фазовом состоянии − жидком − т.е. в
температурном интервале 298−350 К нет
фазовых превращений. Мольная изобарная
теплоемкость жидкого этиленгликоля в
исследуемом температурном интервале
постоянна и равна
![]() =
151,0 Дж/(мольК).
=
151,0 Дж/(мольК).
![]() 191,6
Дж/(мольК).
191,6
Дж/(мольК).
Пример 3. Чему равно изменение энтальпии при нагреве 1 моля этиленгликоля от 350 К до 500 К?
Решение.
В
указанный в условии диапазон температур
попадает температура фазового превращения
479,4 К, следовательно, до этой температуры
изменение энтальпии происходит за счет
нагревания жидкости, затем следует
изменение энтальпии при фазовом
превращении, а далее изменение энтальпии
связано с нагреванием газа. Расчет
проводим по формуле (3.18), перейдя к
мольным величинам, температурные
зависимости теплоемкости нам известны.
Мольную энтальпию фазового перехода
находим в справочной литературе, она
равна
![]() 48,6103
Дж/моль.
48,6103
Дж/моль.
![]() ;
;
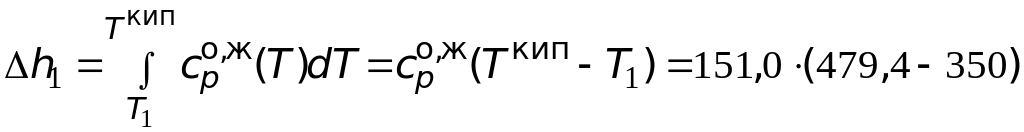 =
=
= 19 539,4 Дж/моль;
![]() 48,6103
Дж/моль;
48,6103
Дж/моль;
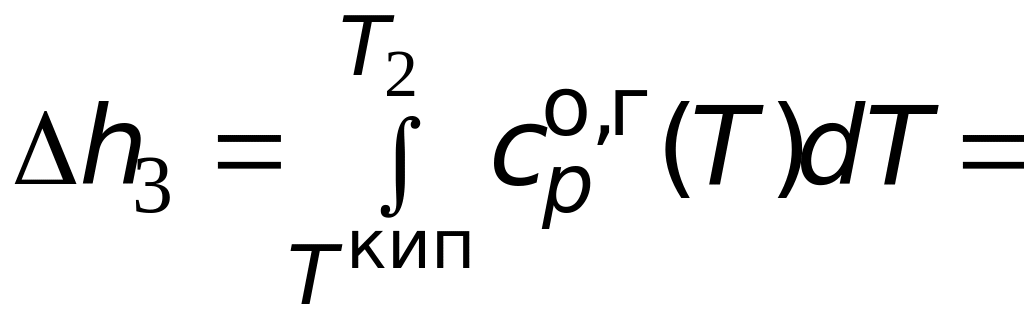
![]() =
=
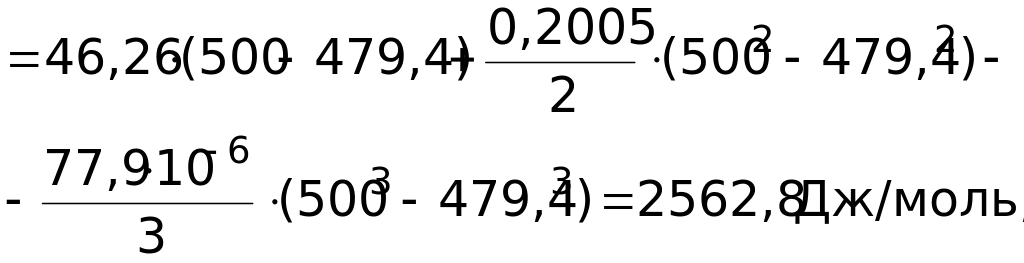
![]() 70
702,2 Дж/моль = 70,7 кДж/моль.
70
702,2 Дж/моль = 70,7 кДж/моль.
Пример 4. Вывести уравнение зависимости мольной энтропии от температуры для газообразного бензола при давлении 1 атм. Определить величину стандартной мольной изобарной теплоемкости бензола при 500 К двумя способами.
Решение. Зависимость мольной энтропии вещества от температуры можно найти после интегрирования выражений
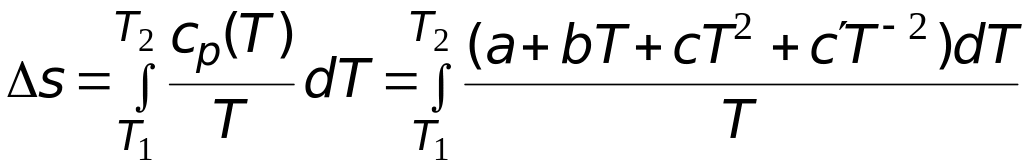 .
(3.21)
.
(3.21)
Слева в уравнении
(3.21) стоит разность
![]() .
Если в качестве первого состояния
вещества выбрать его состояние при 298
К и 1 атм, то величину мольной энтропии
(
.
Если в качестве первого состояния
вещества выбрать его состояние при 298
К и 1 атм, то величину мольной энтропии
(![]() )
этого вещества легко найти в справочнике.
)
этого вещества легко найти в справочнике.
Тогда из уравнения (3.21) имеем
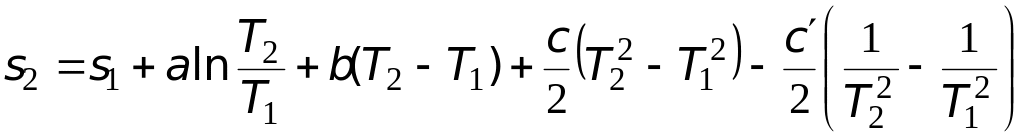 .
(3.22)
.
(3.22)
Уравнения (3.22) −
это уже зависимость мольной энтропии
от температуры, но её нужно обязательно
преобразовать, учитывая, что известно
числовое значение
![]() ,
а также значение Т1
= 298 К.
Необходимо учитывать, что уравнение
(3.22) написано в общем виде, поэтому
включает и эмпирический коэффициент
,
а также значение Т1
= 298 К.
Необходимо учитывать, что уравнение
(3.22) написано в общем виде, поэтому
включает и эмпирический коэффициент
![]() ,
и эмпирический коэффициент
,
и эмпирический коэффициент
![]() .
Когда уравнение будет записано для
конкретного вещества, тогда в зависимости
от природы этого вещества в уравнении
будет слагаемое или с коэффициентом
(для органических веществ), или с
коэффициентом
(для
неорганических веществ).
.
Когда уравнение будет записано для
конкретного вещества, тогда в зависимости
от природы этого вещества в уравнении
будет слагаемое или с коэффициентом
(для органических веществ), или с
коэффициентом
(для
неорганических веществ).
В рамках данной задачи имеем следующие данные:
Вещество |
, кДж / моль
|
,
Дж/(моль∙К) |
Коэффициенты уравнения
|
|||
а |
103 |
|
10−5 |
|||
C6H6 (г) бензол |
82,93 |
269,2 |
21,09 |
400,12 |
169,87 |
|
Следовательно, энтропия газообразного бензола при любой произвольной температуре Т
![]() .
.
После подстановки числовых значений и преобразований имеем выражение температурной зависимости мольной энтропии газообразного бензола
![]() .
(3.23)
.
(3.23)
Используя уравнение
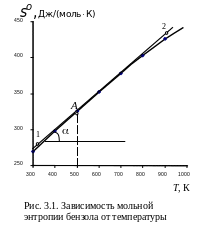
(3.23), можно графически изобразить
зависимость мольной энтропии газообразного
бензола от температуры (рис. 3.1), а далее
по этой зависимости определить величину
изобарной теплоемкости бензола при
температуре 500 К. Мольная изобарная
теплоемкость связана с частной
производной энтропии по температуре
![]() .
.
С
1 ледовательно,
для того чтобы графически найти
теплоемкость, нужно определить частную
производную
ледовательно,
для того чтобы графически найти
теплоемкость, нужно определить частную
производную
 зависимости
энтропии от температуры в точке,
соответствующей 500 К. Графически
производную находят, проводя к
интересующей нас точке на кривой
касательную, а затем определяя угловой
коэффициент а
этой касательной. Чтобы
найти угловой коэффициент касательной,
нужно взять на прямой две достаточно
удаленные друг от друга точки и определить
их координаты. Угловой коэффициент
численно равен тангенсу угла наклона
прямой (для рассматриваемого случая):
зависимости
энтропии от температуры в точке,
соответствующей 500 К. Графически
производную находят, проводя к
интересующей нас точке на кривой
касательную, а затем определяя угловой
коэффициент а
этой касательной. Чтобы
найти угловой коэффициент касательной,
нужно взять на прямой две достаточно
удаленные друг от друга точки и определить
их координаты. Угловой коэффициент
численно равен тангенсу угла наклона
прямой (для рассматриваемого случая):
![]() .
.
Затем находим
изобарную теплоемкость
![]() .
.
Из анализа рис. 3.1 видно, что зависимость энтропии от температуры имеет слабо выраженную кривизну, и если точек для построения кривой мало, то кажется, что такую зависимость можно описать прямой линией. Однако зависимость мольной энтропии от температуры − это все-таки кривая линия, и к ней можно провести касательную. Рекомендованный шаг по температуре для построения зависимости составляет 50 К. В случае если какой-то участок зависимости носит явно линейный характер, угловой коэффициент касательной будет совпадать с угловым коэффициентом самой линии.
Следующий способ определения мольной изобарной теплоемкости газообразного бензола расчетный, по формуле температурной зависимости изобарной теплоемкости, которая имеет вид:
![]() = −21,09 +
0,4T
− 0,000 169Т
2
.
= −21,09 +
0,4T
− 0,000 169Т
2
.
По этому способу мольная изобарная теплоемкость бензола при 500 К равна 136,66 Дж/(моль∙К). Значения теплоемкости, вычисленные разными способами, должны быть близки.
Пример 5. Углекислый газ массой 200 г находится в состоянии 1 при температуре 600 К и давлении 2,5 атм. Его перевели в состояние 2, при котором температура равна 298 К, а давление 1 атм.
Принимая свойства углекислого газа близкими к свойствам идеального газа, найти изменения мольных и полных 1) объема; 2) энтропии; 3) энтальпии; 4) внутренней энергии и 5) энергии Гиббса системы при этом переходе.
Решение. Из справочных таблиц определяем форму уравнения и значения коэффициентов температурной зависимости мольной изобарной теплоемкости углекислого газа
Вещество |
кДж / моль
|
Дж/(моль∙К) |
Коэффициенты уравнения
|
|||
а |
103 |
|
10−5 |
|||
CО2 (г) |
−393,51 |
213,66 |
44,14 |
9,04 |
− |
−8,54 |
![]() = a
+ bT
+ c’T
−2
= 44,14 + 9,04∙10−3
T
8,54∙105
T
−2
.
= a
+ bT
+ c’T
−2
= 44,14 + 9,04∙10−3
T
8,54∙105
T
−2
.
1. Используя уравнение состояния идеального газа, находим изменение мольного объема следующим образом:
![]() =
=
= 4,74 ∙10−3 м3/моль.
Полное изменение
объёма углекислого газа при рассматриваемом
переходе составит
![]() .
.
Число молей находим
по формуле
![]() 4,55
моль.
4,55
моль.
![]() 4,55∙4,74∙10−3
= 2,16∙10−2
м3.
4,55∙4,74∙10−3
= 2,16∙10−2
м3.
2. Расчет мольного изменения энтропии углекислого газа при переходе из состояния 1 в состояние 2 производится по формуле
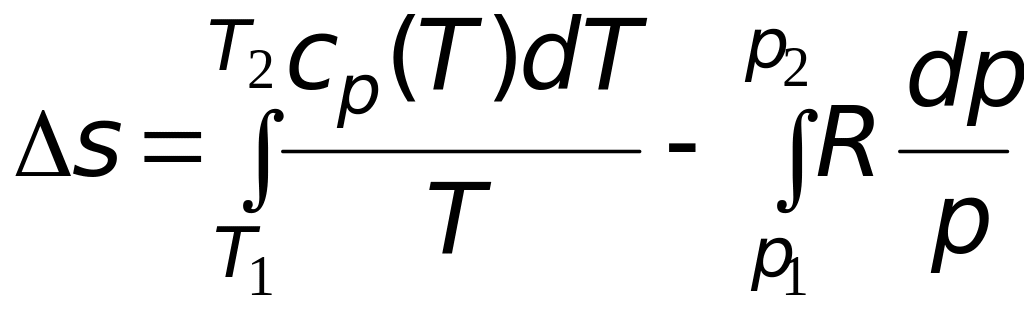
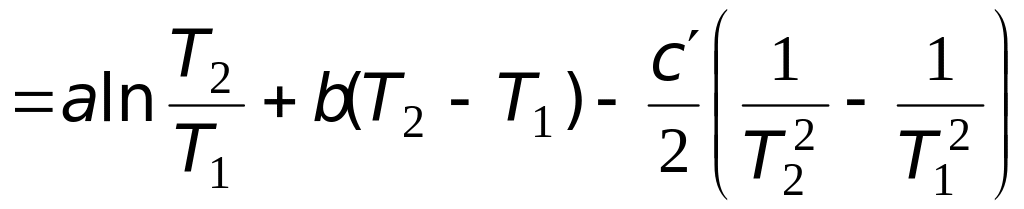
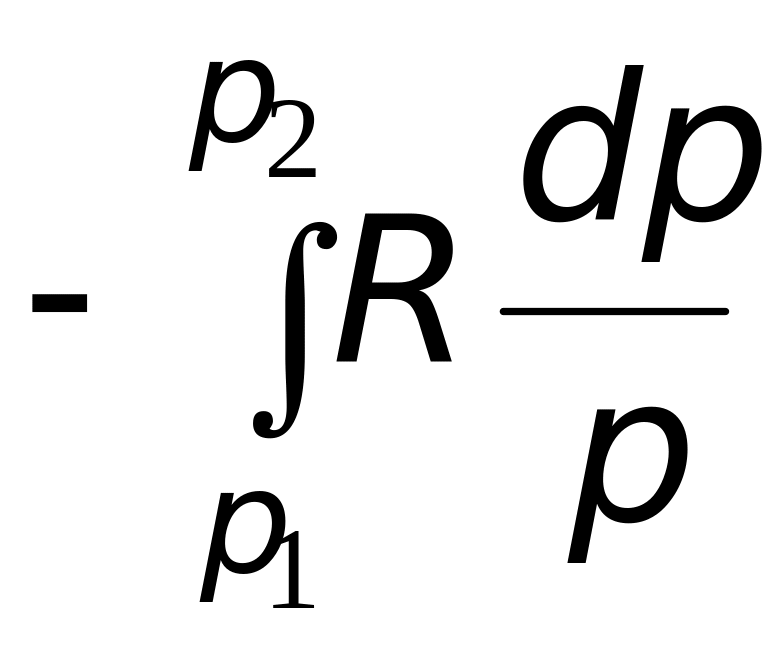 =
=
![]() =
=
= −46,89 Дж/(мольК).
Полное изменение энтропии равно
![]() −213,32 Дж/К.
−213,32 Дж/К.
3. Для идеального газа изменение энтальпии не зависит от давления, поэтому формула для расчета мольного изменения энтальпии имеет вид:
![]()
![]()
=
![]() Дж/моль.
Дж/моль.
Полное изменение энтальпии равно
![]() =
4,55∙(−15998,5) = −72793,18 Дж.
=
4,55∙(−15998,5) = −72793,18 Дж.
4. Для идеального газа мольное изменение внутренней энергии связано с мольным изменением энтальпии
![]()
Следовательно,
![]() = −15998,5−8,314(298−600)=
−13487,7 Дж/моль.
= −15998,5−8,314(298−600)=
−13487,7 Дж/моль.
Полное изменение внутренней энергии найдем как
![]() =4,55(−13487,7)
= − 61369 Дж.
=4,55(−13487,7)
= − 61369 Дж.
5. Мольное изменение
энергии Гиббса при переходе углекислого
газа из состояния 1 в состояние 2 определим
как
![]() .
.
Но известно, что
![]() ,
а
,
а
![]() .
Кроме того,
.
Кроме того,
![]() .
.
Тогда
![]() =
=
=
![]() =
=![]() .
.
Мольные изменения
энтальпии и энтропии определены ранее,
значение мольной энтропии в состоянии
2 можно найти по справочнику, т.к. это
состояние 298 К и 1 атм:
![]() 213,66
Дж/(моль∙К).
213,66
Дж/(моль∙К).
![]() −15998,5
−213,66(298−600)−600∙(−46,89) =76660,8 Дж/моль.
−15998,5
−213,66(298−600)−600∙(−46,89) =76660,8 Дж/моль.
4. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
Для характеристики раствора применяют следующие виды концентраций.
![]() − мольная
доля компонента k
(часто – молярная доля),
− мольная
доля компонента k
(часто – молярная доля),
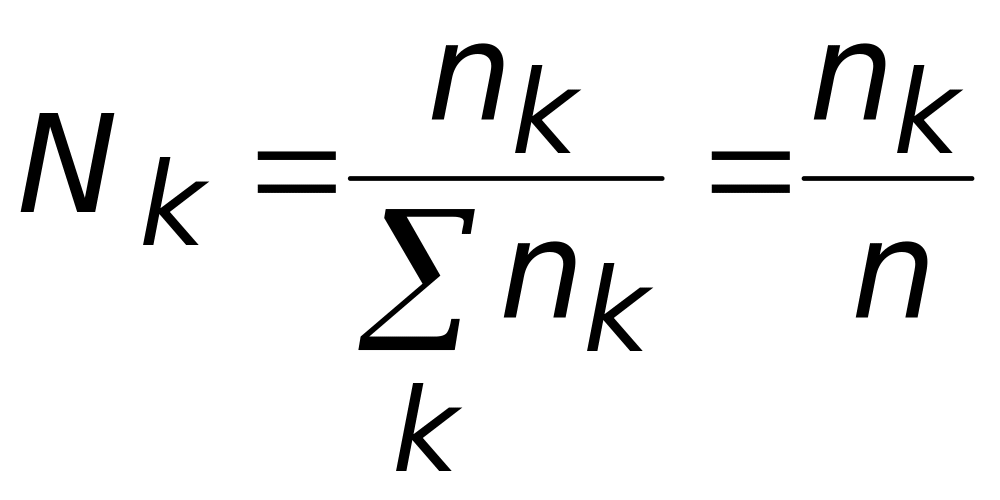 .
.
![]() − массовая
доля компонента,
− массовая
доля компонента,
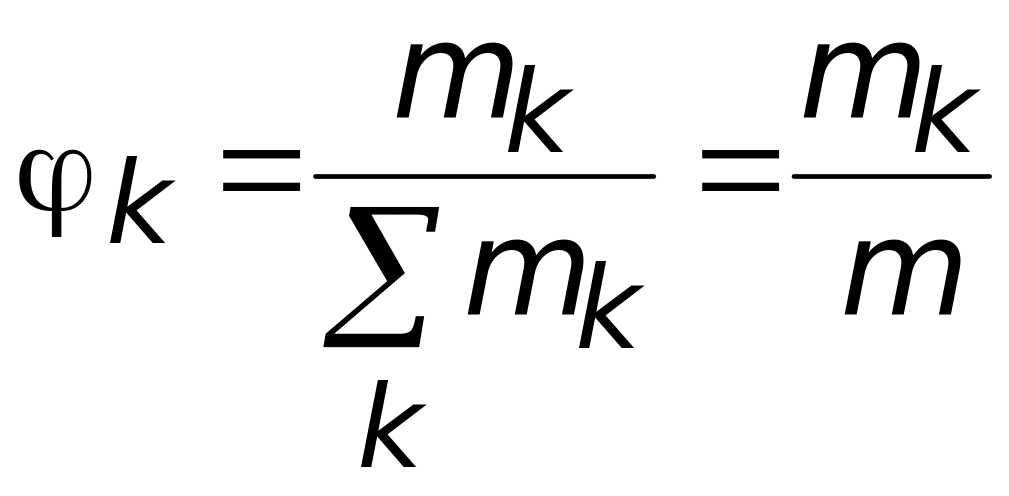 .
.
![]() − молярная
концентрация (c),
другое название − плотность числа
молей,
− молярная
концентрация (c),
другое название − плотность числа
молей,
![]() . [c
] = моль/м3
.
. [c
] = моль/м3
.
![]() − массовая
концентрация, другое название –
плотность массы компонента k,
− массовая
концентрация, другое название –
плотность массы компонента k,
![]() .
[
]
= кг/м3.
.
[
]
= кг/м3.
![]() − моляльная
концентрация раствора, или мольно-массовая
концентрация, другое название –
мольно-массовое отношение,
− моляльная
концентрация раствора, или мольно-массовая
концентрация, другое название –
мольно-массовое отношение,
![]() . [ d
] = моль/кг.
. [ d
] = моль/кг.
Состояние компонента
k
в растворе нельзя описать функциями,
отвечающими чистому компоненту k.
Для описания свойств компонента в
растворе вводится понятие
парциальных
мольных свойств
компонента.
Если обозначить полное экстенсивное
свойство раствора, образованного
компонентами в общем виде, как
![]() ,
то мольное экстенсивное свойство
раствора, состоящего из компонентов
k,
будет
обозначаться как
,
то мольное экстенсивное свойство
раствора, состоящего из компонентов
k,
будет
обозначаться как
![]() ,
причем
,
причем
![]() .
Вклад компонента k
в любое экстенсивное свойство E
раствора определяется его парциальной
мольной (ПМ) величиной
.
Вклад компонента k
в любое экстенсивное свойство E
раствора определяется его парциальной
мольной (ПМ) величиной
![]() ,
которая равна
,
которая равна
![]() .
(4.1)
.
(4.1)
Следует отметить,
что парциальные мольные величины
отражают изменение
свойств и их нельзя уподоблять
соответствующим мольным величинам.
Парциальные мольные величины могут
принимать значения, которые немыслимы
для мольных величин; например, парциальный
мольный объем может быть отрицательным.
Парциальные мольные величины могут
быть образованы от любой экстенсивной
величины. В общем случае экстенсивное
свойство Е
однородной системы, состоящей из k
компонентов,
можно представить в виде функции
температуры, давления и чисел молей
компонентов, т.е.
![]() .
Если зафиксировать постоянными давление
и температуру, то получим
.
Если зафиксировать постоянными давление
и температуру, то получим
![]() .
.
Образуем полный дифференциал этого выражения:
![]() .
(4.2)
.
(4.2)
С учетом (4.1) из уравнения (4.2) можно получить
![]()
или
![]() .
(4.3)
.
(4.3)
Учитывая, что E − однородная функция первой степени от независимых аргументов nk, и привлекая теорему Эйлера об однородных функциях, получаем из (4.3) выражение
![]() .
(4.4)
.
(4.4)
Если раствор двухкомпонентный, или как еще говорят, бинарный, т.е. число компонентов k = 2, то соотношения, получающиеся в этом случае, имеют вид:
![]() .
(4.5)
.
(4.5)
При делении выражения (4.5) на общее число молей получим
![]() ,
(4.6)
,
(4.6)
с учетом определительного выражения для мольной доли компонента k (4.6) можно записать как
![]() .
(4.7)
.
(4.7)
Используем эти
же выражения для объема
![]() .
.
![]() ,
,
![]() ,
,
где V – полный объем раствора; 1 и 2 парциальные мольные объемы 1 и 2 компонентов раствора; n1 и n2 – числа молей компонентов 1 и 2; N1 и N2 – мольные доли компонентов 1 и 2 в растворе; – мольный объем раствора.
Способы определения парциальных мольных величин рассмотрим на примере определения парциальных мольных объемов в бинарном растворе.
Первый способ. Определение парциального мольного объема по зависимости полного объема раствора от числа молей одного из компонентов.
С огласно
определительному выражению для
парциальной мольной величины (4.1),
парциальный мольный (ПМ) объем второго
компонента − это величина
2
=
огласно
определительному выражению для
парциальной мольной величины (4.1),
парциальный мольный (ПМ) объем второго
компонента − это величина
2
=![]() ,
а ПМ объем первого компонента − это
1
=
,
а ПМ объем первого компонента − это
1
=![]() .
Если известно уравнение зависимости,
например
.
Если известно уравнение зависимости,
например
![]() ,
то для получения
2
=
нужно продифференцировать его.
Если
зависимость дана в форме таблицы или
в виде графика, то нужно определить
угловой коэффициент касательной к
кривой зависимости
,
то для получения
2
=
нужно продифференцировать его.
Если
зависимость дана в форме таблицы или
в виде графика, то нужно определить
угловой коэффициент касательной к
кривой зависимости
![]() в той точке, в которой нам требуется
определить ПМ объем. При графическом
определении частной производной нужно
найти угловой коэффициент касательной,
проведенной к кривой зависимости в
определенной точке (рис. 4.1).
в той точке, в которой нам требуется
определить ПМ объем. При графическом
определении частной производной нужно
найти угловой коэффициент касательной,
проведенной к кривой зависимости в
определенной точке (рис. 4.1).
Рис. 4.1. Зависимость полного
объема раствора от числа молей
второго компонента (p,T, n1 – const)
Частная производная полного объема по числу молей второго компонента в условиях постоянства давления, температуры и остального состава равна
![]() .
.
Угловой коэффициент касательной находится
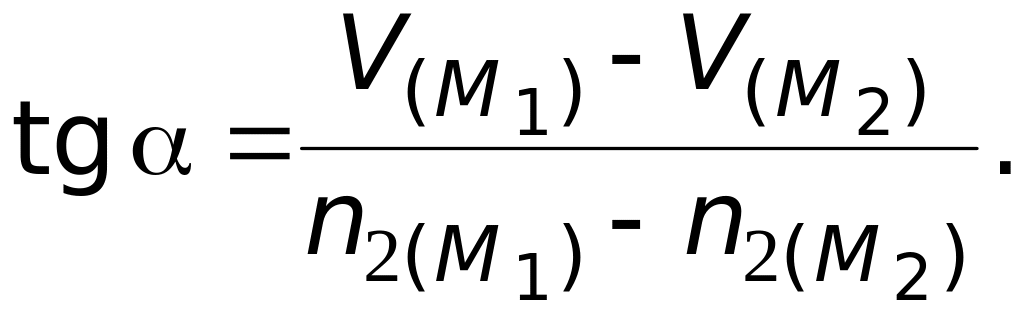
Второй способ. Определение ПМ объемов по зависимости мольного объема раствора от состава.
Парциальные мольные объемы компонентов бинарной смеси следующим образом связаны с мольным объемом смеси
1
=
N2
![]() .
(4.8)
.
(4.8)
2 = + (1 N2) . (4.9)
Из данных выражений следует, что для вычисления парциальных мольных объемов по этому методу необходимо по зависимости мольного объема от мольной доли второго компонента определить частную производную мольного объема раствора по мольной доле второго компонента при постоянных давлении и температуре в интересующем нас растворе. Для определения производной, например, графическим способом, нужно к зависимости мольного объема раствора от состава (см. рис. 4.2, линия ВАС) в соответствующей точке провести касательную и определить угловой коэффициент этой касательной по координатам двух достаточно удаленных друг от друга точек, лежащих на касательной
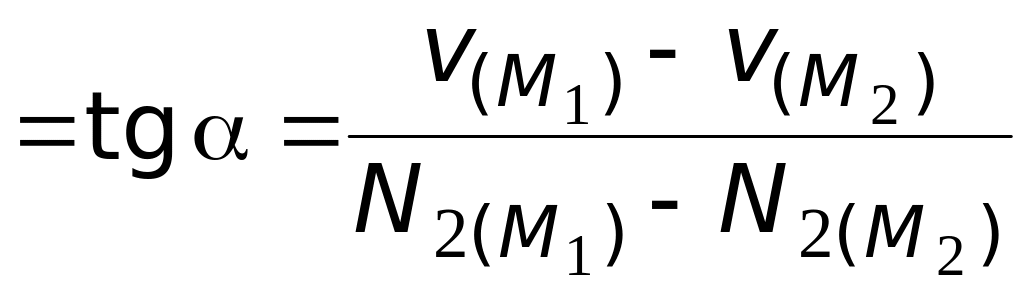 .
.
Далее по уравнениям (4.8) и (4.9) вычислить парциальные мольные объемы обоих компонентов.
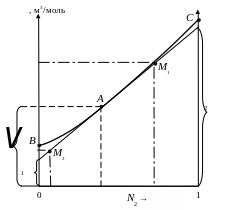
Рис. 4.2. Зависимость мольного объема раствора от состава раствора
Третий способ. Определение ПМ объемов по методу Розебома
(метод отрезков).
Из анализа рис. 4.2 и уравнений (4.8−4.9) видно, что касательная к зависимости = f (N2) отсекает на левой оси ординат отрезок, равный парциальному мольному объему первого компонента в растворе концентрации N2, а на правой оси отрезок, равный парциальному мольному объему второго компонента в растворе той же концентрации.
Примеры задач
Пример 1
Жидкий бензол массой 500 г занимает объем 568,8 см3 (293 К, 1 атм). Вычислить его мольный и удельный объемы и плотность массы.
Дано:
Чистое вещество – бензол
M = 0,078 кг/моль
m = 500 г = 0,5 кг
V = 568,8 см3 = 5,688∙10−4 м3.
Найти:
![]() .
.
Решение
![]() = 8,887∙10−5
м3/моль
= 8,887∙10−5
м3/моль
![]() =
1,138∙10-4
м3/кг
=
1,138∙10-4
м3/кг
![]() =
=![]() =8,787∙102
кг/м3.
=8,787∙102
кг/м3.
Пример 2. Общее число молей в водно-ацетоновом растворе составляет 12,58 моль. Плотность массы раствора и плотность числа молей ацетона в нем равны соответственно 916 кг/м3 и 7897 моль/м3 при 298 К и 1 атм. Определить массу и объем раствора, его мольную массу и удельное число молей.
Дано: двухкомпонентный раствор. Компонент 1 – вода, H2O. Компонент 2 – ацетон, (CH3)2CO. M1 = 0,018 кг/моль; M2 = 0,058 кг/моль; n2 = 12,58 моль; ρ = 918 кг/м3; c2 = 7897 моль/м3.
Найти: m, V, M, nуд.
Решение. Решение основано на взаимосвязи между концентрационными шкалами.
Масса раствора:
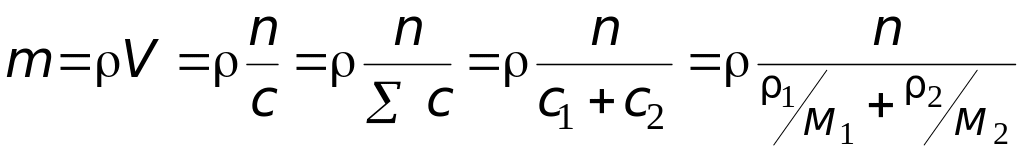 =
=
=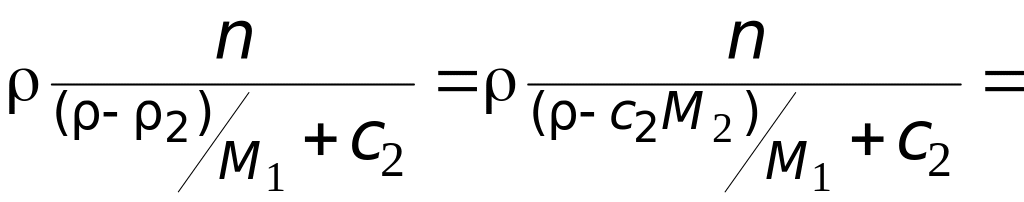
![]() .
.
Объем раствора:
![]() =
=
=![]() м3.
м3.
Мольная масса раствора:
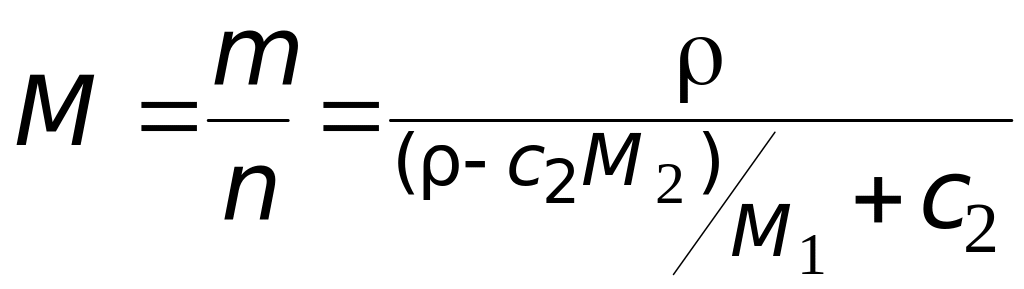 =
=
=
![]() кг/моль.
кг/моль.
Удельное число молей раствора:
![]() =
=
=
![]() моль/кг.
моль/кг.
Пример 3. Для двухкомпонентного водно-аммиачного раствора приведена в табличной форме зависимость объема раствора от числа молей аммиака при постоянных параметрах: температуре 293 К, давлении 1 атм и числе молей воды 5,556 моль.
|
0 |
0,392 |
0,682 |
1,498 |
2,521 |
·104, м3 |
1,00 |
1,10 |
1,17 |
1,34 |
1,48 |
Вычислите парциальные мольные объемы обоих компонентов при мольной доле аммиака, равной 0,15.
Дано: двухкомпонентный раствор. Компонент 1 − вода, H2O.
M1
= 0,018 кг/моль.
Компонент 2 – аммиак, NH3.
M2
= 0,017 кг/моль. n1=
5,556 моль. N2
= 0,15. Найти:
![]() .
.
Решение. Изобразим графически данную в условии задачи зависимость объема системы от числа молей второго компонента.
П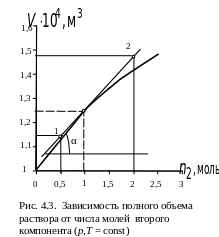 о
определению парциальный мольный объем
компонента 2 – это частная производная
полного объема по числу молей второго
компонента в условиях постоянства
температуры, давления и числа молей
первого компонента, т.е.
о
определению парциальный мольный объем
компонента 2 – это частная производная
полного объема по числу молей второго
компонента в условиях постоянства
температуры, давления и числа молей
первого компонента, т.е.
![]() =
=![]() .
.
Полный объем
бинарного раствора может быть найден
как
![]() .
.
По рис. 4.3 найдем
частную производную объема по числу
молей второго компонента
![]() .
Для этого определим угловой коэффициент
касательной, проведенной к нашей
зависимости в определенной точке.
Данная точка должна показывать число
молей второго компонента в растворе
при мольной доле его, равной 0,15. Найдем
значение
n2
из
соотношения
.
Для этого определим угловой коэффициент
касательной, проведенной к нашей
зависимости в определенной точке.
Данная точка должна показывать число
молей второго компонента в растворе
при мольной доле его, равной 0,15. Найдем
значение
n2
из
соотношения
![]() .
.
![]() =
=
![]() моль.
моль.
При числе молей второго компонента 0,98 восстанавливаем перпендикуляр к кривой и проводим к точке пересечения перпендикуляра с кривой касательную. Затем находим угловой коэффициент касательной
![]() м3/моль,
м3/моль,
= 2,210 −5 м3/моль.
Примечание. Если зависимость полного объема от числа молей второго компонента представляет собой прямую линию, то касательная будет совпадать с ходом этой прямой.
Чтобы найти
![]() ,
воспользуемся соотношением
,
воспользуемся соотношением
![]() ,
причем значение полного объема системы
при числе молей второго компонента,
которое соответствует мольной доле
его 0,15, определим по графику. V
= 1,2510
−4
м3.
,
причем значение полного объема системы
при числе молей второго компонента,
которое соответствует мольной доле
его 0,15, определим по графику. V
= 1,2510
−4
м3.
=
![]() = 1,8610−5
м3/моль.
= 1,8610−5
м3/моль.
N2 |
0,0 |
0,255 |
0,424 |
0,617 |
0,870 |
1,000 |
∙105, м3/моль |
7,600 |
7,982 |
8,359 |
8,790 |
9,378 |
9,800 |
Пример 4. Для двухкомпонентного жидкого раствора ацетон (1-й компонент) трихлорметан (2-й компонент) представлена в табличной форме (Т = 298 К, р = 1 атм) зависимость мольного объема раствора от мольной доли второго компонента N2 .
Определите для обоих компонентов парциальные мольные объемы 1 и 2 при мольной доле второго компонента N2 = 0,6.
Решение.
Изображаем
данные, приведенные в условии задачи,
в виде графической зависимости мольного
объема от состава (мольная доля второго
компонента). Проводим касательную к
точке на кривой, при к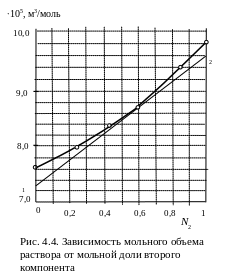 оторой
мольная доля трихлорметана (компонент
2) равна 0,6. Касательную проводим до
пересечения с осями ординат и по
величине, отсекаемой на каждой из осей,
находим значения парциальных мольных
объемов.
оторой
мольная доля трихлорметана (компонент
2) равна 0,6. Касательную проводим до
пересечения с осями ординат и по
величине, отсекаемой на каждой из осей,
находим значения парциальных мольных
объемов.
1 = 7,3∙10−5 м3/моль; 2 = 9,6∙10−5 м3/моль.
Пример 5. Для двухкомпонентного жидкого раствора вода Н2О (1-й компонент) уксусная кислота С2Н4О2 (2-й компонент) имеется полученная на опыте в табличной форме зависимость изобарной теплоемкости Ср от массы кислоты m2 (Т = 298 К, р = 1 атм) при постоянной массе воды m1 = 0,5 кг:
m2 |
0,0 |
0,057 |
0,088 |
0, 103 |
0,161 |
0,260 |
Сp, Дж/К |
2090 |
2238 |
2314 |
2352 |
2476 |
2682 |
Удельные
изобарные теплоемкости чистых компонентов
1 и 2 (![]() )
равны
4180 и 2056 Дж/(Кмоль).
)
равны
4180 и 2056 Дж/(Кмоль).
Требуется 1) построить график зависимости изобарной теплоемкости смешения раствора Срm от числа молей кислоты n2; 2) определить для обоих компонентов их парциальные мольные изобарные теплоемкости смешения ср1m и ср2m при мольной доле второго компонента N2 = 0,05; 3) вычислить для тех же компонентов при той же N2 парциальные мольные изобарные теплоемкости ср1 и ср2.
Решение
1. Для получения зависимости изобарной теплоемкости смешения раствора Срm от числа молей кислоты n2 (Срm = f(n2)) в табличной и графической формах необходимо преобразовать табличные данные по зависимости изобарной теплоемкости Ср от массы второго компонента (Ср= f (m2)) . Используя определительные выражения для понятий число молей и функция смешения, получим:
![]() ;
;
![]() .
.
Пример расчета:
![]() моль;
моль;
![]() 2238
− (4180∙0,5 +
2056∙0,057)
= 30,81 Дж/К.
2238
− (4180∙0,5 +
2056∙0,057)
= 30,81 Дж/К.
n2 |
0 |
0,95 |
1,47 |
1,72 |
2,68 |
4,33 |
Срm, Дж/К |
0 |
30,81 |
43,07 |
50,23 |
54,98 |
57,44 |
Г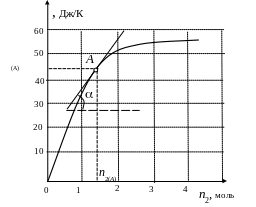 рафический
образ зависимости Срm
= f
(n2)
приведен на рис.4.5.
рафический
образ зависимости Срm
= f
(n2)
приведен на рис.4.5.
Рис. 4.5. Зависимость изобарной теплоемкости смешения раствора Срm от числа молей кислоты n2
2. В
основе определения
![]() и
и
![]() лежит система вида
лежит система вида
![]() ,
,
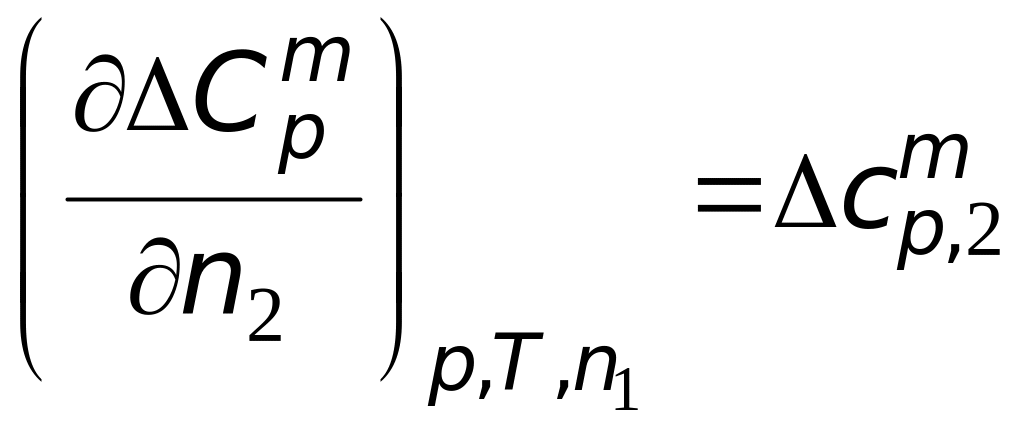 .
.
По заданной мольной доле найдем координаты точки на кривой Срm =f(n2) (рис.4.5), к которой нужно проводить касательную):
![]() и
и
![]() (А)
в точке А
на кривой :
(А)
в точке А
на кривой :
![]() =
=![]() =1,46
моль.
=1,46
моль.
(А) = 43 Дж/К (определили по графику при n2 =1,46 моль).
Примечание. Следует отметить, что числовые значения, которые в этой задаче определяются по графику, при приближенном построении графика, конечно, не являются точными. При графических решениях нужно использовать миллиметровую бумагу и достаточно крупный масштаб, тогда значения получатся более точными.
Определим по
угловому коэффициенту касательной
тангенсу угла наклона касательной tg
2
в точке А величину парциальной мольной
изобарной теплоемкости смешения второго
компонента
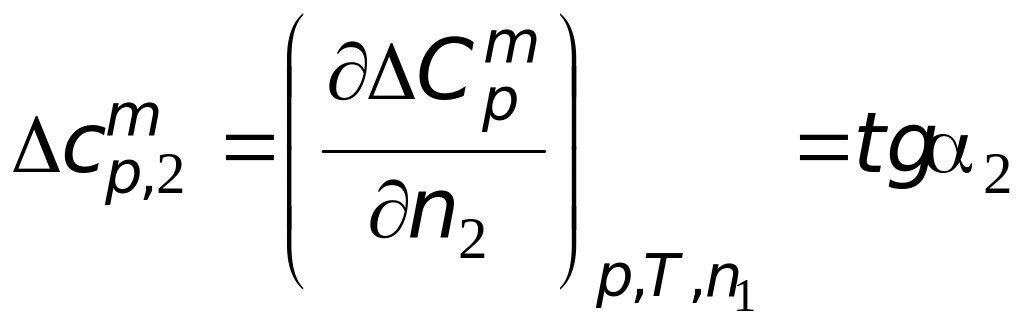 =
=
![]() Дж/(моль∙К).
Дж/(моль∙К).
Затем можно найти :
![]() =
=![]() =0,496
Дж/(моль∙К).
=0,496
Дж/(моль∙К).
3).
Каждую из величин ср1
и ср2
находим
с помощью выражения для
![]() :
:
![]() ;
;
![]() = 0,496 +4180∙ 0,018
=75,736 Дж/(моль∙К).
= 0,496 +4180∙ 0,018
=75,736 Дж/(моль∙К).
![]() = 20+ 2056∙ 0,060= 143,36 Дж/(моль∙К).
= 20+ 2056∙ 0,060= 143,36 Дж/(моль∙К).
