
- •Е. И. Степановских, л. А. Брусницына, т. А. Алексеева физическая химия Примеры решения задач
- •Рекомендации по оформлению решений
- •2. Способы линеаризации опытных данных.
- •Термодинамические свойства простых веществ и соединений
- •3. Расчет изменений энтропии, энтальпии и энергии гиббса чистого вещества
- •5. Расчеты экстенсивных свойств системы с химическим превращением. Химическое равновесие
- •6. Фазовые равновесия
- •6.1. Фазовые равновесия в однокомпонентных системах
- •6.2. Фазовое равновесие в двухкомпонентных системах
- •Приложения
- •Часть 1
- •620002, Екатеринбург, Мира, 19
6. Фазовые равновесия
6.1. Фазовые равновесия в однокомпонентных системах
Фаза это часть системы с одинаковыми свойствами, ограниченная границей раздела, на которой свойства меняются скачком. По правилу равновесия фаз Гиббса вариантность системы ()
= k f + 2.
Задачи на фазовое равновесие в однокомпонентной системе решаются с использованием уравнения КлаузиусаКлапейрона. Это уравнение в дифференциальной форме имеет вид
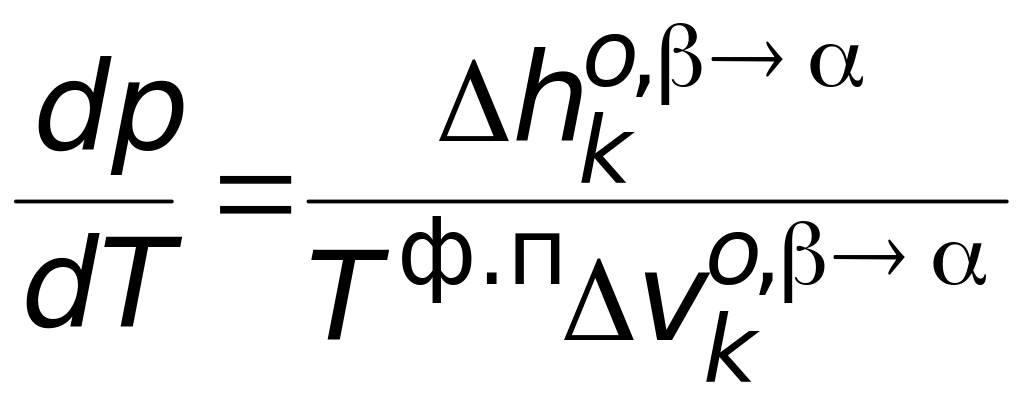 ,
(6.1)
,
(6.1)
где
![]()
мольная энтальпия фазового перехода
чистого вещества k;
мольная энтальпия фазового перехода
чистого вещества k;
![]()
температура фазового перехода (часто
верхний индекс опускают);
температура фазового перехода (часто
верхний индекс опускают);
![]()
изменение мольного объема при фазовом
переходе.
изменение мольного объема при фазовом
переходе.
Для фазовых переходов, в которых одной из фаз является пар, справедливы следующие формы уравнения КлаузиусаКлапейрона
![]() ,
(6.2)
,
(6.2)
![]() ,
(6.3)
,
(6.3)
где p давление насыщенного пара, Па. Насыщенный пар это пар, находящийся в равновесии с жидкостью (или с твердым веществом в случае процесса возгонки).
Пример 1. Для чистого вещества А известны температурные зависимости давления насыщенного пара над жидким веществом А (т.е. при равновесии жидкостьпар) и давление насыщенного пара над кристаллами вещества А (т.е. при равновесии кристаллыпар). По этим данным найдите координаты тройной точки; определите графически мольные теплоты испарения и возгонки, полагая, что они не зависят от температуры; рассчитайте мольную теплоту плавления в тройной точке.
Решение.
Зависимости
![]() для указанных равновесий представляют
собой кривые линии, поэтому нахождение
тройной точки (точка пересечения этих
двух зависимостей) будет не совсем
точным. Для решения задачи экспериментальные
данные нужно представить в таком виде,
чтобы получаемые зависимости были
линейными. Это можно сделать, если
рассмотреть интегральную
форму уравнений Клаузиуса−Клапейрона
для указанных равновесий представляют
собой кривые линии, поэтому нахождение
тройной точки (точка пересечения этих
двух зависимостей) будет не совсем
точным. Для решения задачи экспериментальные
данные нужно представить в таком виде,
чтобы получаемые зависимости были
линейными. Это можно сделать, если
рассмотреть интегральную
форму уравнений Клаузиуса−Клапейрона
![]() ,
(6.4)
,
(6.4)
![]() ,
(6.5)
,
(6.5)
где уравнение
(6.4) соответствует зависимости
натурального логарифма давления
насыщенного пара от обратной температуры
для равновесия жидкостьпар,
а уравнение (6.5)
для равновесия кристаллыпар.
Изобразив на одном рисунке зависимости
![]() для обоих равновесий (рис. 6.1), по угловым
коэффициентам прямых легко найти
мольные энтальпии испарения и возгонки,
а по координатам точки пересечения
прямых линий − координаты тройной
точки.
для обоих равновесий (рис. 6.1), по угловым
коэффициентам прямых легко найти
мольные энтальпии испарения и возгонки,
а по координатам точки пересечения
прямых линий − координаты тройной
точки.
М ольные
теплоты испарения и возгонки находят
по соотношениям
ольные
теплоты испарения и возгонки находят
по соотношениям
![]() ;
;
![]() .
.
Зная, что мольная
энтальпия возгонки равна сумме мольных
энтальпий испарения и плавления
![]() =
=![]() +
+![]() ,
далее определяют величину мольной
энтальпии плавления.
,
далее определяют величину мольной
энтальпии плавления.
