
- •Е. И. Степановских, л. А. Брусницына, т. А. Алексеева физическая химия Примеры решения задач
- •Рекомендации по оформлению решений
- •2. Способы линеаризации опытных данных.
- •Термодинамические свойства простых веществ и соединений
- •3. Расчет изменений энтропии, энтальпии и энергии гиббса чистого вещества
- •5. Расчеты экстенсивных свойств системы с химическим превращением. Химическое равновесие
- •6. Фазовые равновесия
- •6.1. Фазовые равновесия в однокомпонентных системах
- •6.2. Фазовое равновесие в двухкомпонентных системах
- •Приложения
- •Часть 1
- •620002, Екатеринбург, Мира, 19
5. Расчеты экстенсивных свойств системы с химическим превращением. Химическое равновесие
Интенсивными называются свойства, значение которых не зависит от массы (удельные свойства, температура, давление и т.д.), экстенсивными называются те свойства, значение которых зависит от массы системы (масса, объем, энергия, энтальпия). Химическое превращение – процесс преобразования одних компонентов в другие. При этом происходит изменение чисел молей компонентов.
Изменение
экстенсивного свойства
![]() при постоянных давлении и температуре
за счет протекания химической реакции
находится по формуле
при постоянных давлении и температуре
за счет протекания химической реакции
находится по формуле
![]() ,
(5.1)
,
(5.1)
где − парциальное мольное экстенсивное свойство компонента k в реакционной смеси.
После интегрирования (5.1) можно найти интегральное изменение экстенсивного свойства Е. Обычно парциальное мольное свойство вещества k представляют как
![]() ,
(5.2)
,
(5.2)
где
![]() – стандартное мольное свойство
вещества
– стандартное мольное свойство
вещества
![]() ;
;
![]() –
изменение
стандартного мольного свойства за счет
образования смеси реагирующих веществ.
–
изменение
стандартного мольного свойства за счет
образования смеси реагирующих веществ.
Стандартное свойство вещества k характеризует данное вещество в стандартном состоянии. В соответствии с рекомендациями ИЮПАК стандартное состояние вещества выбрано следующим образом: температура вещества в стандартном состоянии равна температуре системы; давление над веществом (или давление газообразного вещества) равно 1 бар (105 Па). Следовательно, понятие стандартного мольного свойства системы никак не связано с какой-либо конкретной температурой. Исторически сложилось так, что для единообразия справочных данных стандартные мольные величины стали определять и табулировать при давлении 1 атм и температуре 298 К. Именно эти условия стали называть стандартными условиями.
Первое слагаемое в уравнении (5.2) зависит только от давления и температуры, а второе слагаемое зависит от концентрации раствора.
Если в качестве
стандартного мольного свойства
использовать мольное свойство Е
компонента в виде чистого вещества
(![]() ),
то второе слагаемое уравнения (5.2) будет
соответствовать парциальной мольной
функции смешения (
),
то второе слагаемое уравнения (5.2) будет
соответствовать парциальной мольной
функции смешения (![]() )
)
![]() .
(5.3)
.
(5.3)
Известно, что
обычно
![]() <<
<<![]() ,
поэтому в уравнении (5.3) часто учитывают
только стандартную часть, и подстановка
полученного выражения в (5.1) приводит
к выражению для расчета изменения
экстенсивного свойства за счет протекания
химической реакции
,
поэтому в уравнении (5.3) часто учитывают
только стандартную часть, и подстановка
полученного выражения в (5.1) приводит
к выражению для расчета изменения
экстенсивного свойства за счет протекания
химической реакции
![]() ,
(5.4)
,
(5.4)
где
![]() −
стандартное мольное свойство Е
реакции.
−
стандартное мольное свойство Е
реакции.
В справочниках приводятся значения стандартных мольных энтропий чистых веществ при температуре 298 К и давлении 1 атм ( ). Эти данные позволяют рассчитать стандартное мольное изменение энтропии реакции при температуре 298 К
![]() .
.
Стандартные мольные энтальпии и функции Гиббса чистых веществ найти невозможно, т.к. нельзя определить абсолютное значение внутренней энергии вещества, а следовательно, и любых других термодинамических функций, включающих внутреннюю энергию. Поэтому для расчета стандартной мольной теплоты реакции обычно прибегают к линейным комбинациям стандартных мольных энтальпий других реакций. Так, например, стандартную мольную энтальпию реакции A + 2B = C находят как комбинацию реакций образования компонентов реакции (химических соединений) из простых веществ
![]() ,
,
где
![]() – стандартная мольная теплота реакции
образования вещества k.
– стандартная мольная теплота реакции
образования вещества k.
Справочники содержат данные по при температуре 298 К и давлении 1 атм. Это позволяет рассчитать стандартную мольную теплоту любой реакции при этих условиях:
![]() .
.
Для расчета
стандартных мольных энтропий и энтальпий
реакций при любых температурах, отличных
от 298 К, нужно располагать данными о
зависимости стандартной мольной
изобарной теплоемкости реакции от
температуры. Эта зависимость
![]() в общем виде дается следующим степенным
рядом
в общем виде дается следующим степенным
рядом
![]() ,
(5.5)
,
(5.5)
где
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Уравнение для расчета стандартного мольного изменения энтальпии в ходе химического превращения называется уравнением Кирхгофа:
![]() .
(5.6)
.
(5.6)
Разделяя переменные и проводя интегрирование, можно получить
![]() .
(5.7)
.
(5.7)
![]()
![]() =
=
![]() .
.
Расчет стандартной
мольной энтропии реакции
![]() при произвольной температуре T
основан на соотношении:
при произвольной температуре T
основан на соотношении:
![]() .
(5.8)
.
(5.8)
![]() .
(5.9)
.
(5.9)
![]()
Зная функции
![]() и
и
![]() ,
можно рассчитать значение стандартного
мольного изменения энергии Гиббса в
ходе химической реакции
,
можно рассчитать значение стандартного
мольного изменения энергии Гиббса в
ходе химической реакции
![]() при любой температуре. Определив
стандартную мольную энергию Гиббса в
результате протекания химической
реакции при различных температурах
процесса, можно вычислить величины
констант химического равновесия данной
реакции при этих же температурах
при любой температуре. Определив
стандартную мольную энергию Гиббса в
результате протекания химической
реакции при различных температурах
процесса, можно вычислить величины
констант химического равновесия данной
реакции при этих же температурах
![]() .
(5.10)
.
(5.10)
Знание константы равновесия реакции позволяет рассчитать состав равновесной системы, т.е. определить максимально возможный, или теоретический, выход желаемого продукта. Для этого необходимо решить уравнение закона действия масс (закона химического равновесия). В предположении идеального поведения газов оно примет вид
![]() ,
(5.11)
,
(5.11)
где давление выражено как отношение парциального давления к единице размерности давления, т.е. оно не имеет размерности.
Парциальное давление каждого участника реакции по закону Дальтона равно произведению общего давления и мольной доли компонента Nk
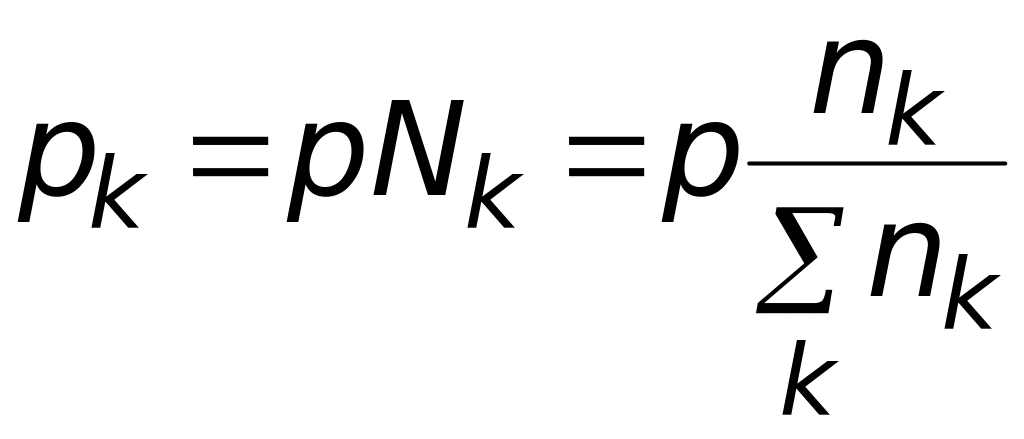 .
(5.12)
.
(5.12)
Если теперь выразить числа молей всех компонентов через начальное количество и глубину реакции, то при известном общем давлении в системе и известной величине константы равновесия будем иметь одно уравнение с одной неизвестной величиной – глубиной реакции:
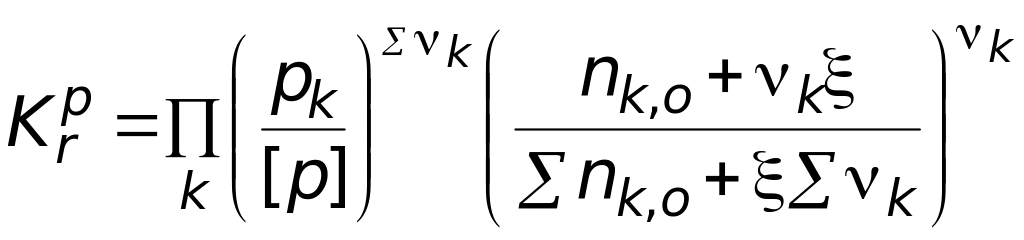 .
(5.13)
.
(5.13)
Для газовой реакции, если газы близки к идеальным, известно уравнение изотермы химической реакции
![]() ,
(5.14)
,
(5.14)
которое позволяет определить возможность протекания процесса в том или ином направлении при известных начальных условиях.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобара Вант-Гоффа)
![]() ( дифференциальная
форма);
( дифференциальная
форма);
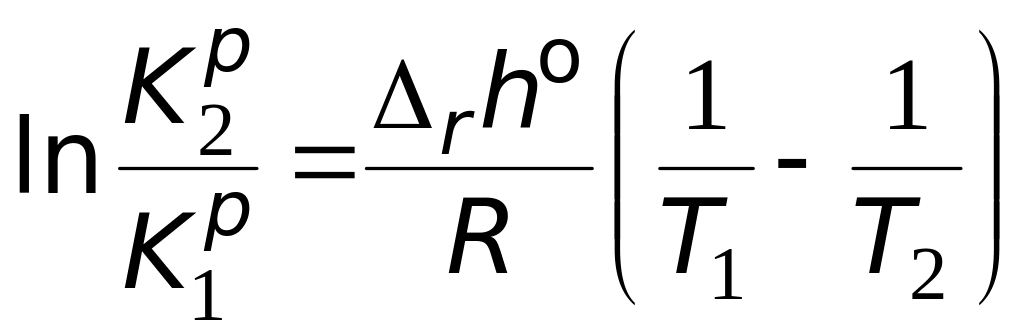 (интегральная
форма) . (5.15)
(интегральная
форма) . (5.15)
По
этому уравнению, зная константы
равновесия при двух разных температурах,
можно рассчитать
![]() реакции. Зная
реакции. Зная
![]() реакции и константу равновесия при
одной температуре, можно рассчитать
константу равновесия при другой
температуре. А в случае, когда известны
величины констант равновесия при
нескольких температурах, строят
графическую зависимость
реакции и константу равновесия при
одной температуре, можно рассчитать
константу равновесия при другой
температуре. А в случае, когда известны
величины констант равновесия при
нескольких температурах, строят
графическую зависимость
![]() .
Угловой коэффициент получаемой прямой
позволит определить величину стандартной
мольной энтальпии реакции.
.
Угловой коэффициент получаемой прямой
позволит определить величину стандартной
мольной энтальпии реакции.
Примеры задач
Пример 1. При гидрокрекинге н-додекана возможно протекание реакции C12H26 + H2 ⇄ 2 нC6H14 . Учитывая то, что все вещества газообразные, и то, что их свойства близки к свойствам идеальных газов, найти выражения зависимостей стандартных мольных энтропии и энтальпии реакции от температуры; стандартные мольные энтропию, энтальпию и энергию Гиббса реакции при температуре 900 К.
Решение. Расчет стандартных мольных энтальпии и энтропии реакции, протекающей при 298 К, производим по ранее приведенным формулам, используя значения стандартных мольных энтропий компонентов при 298 К и стандартных мольных энтальпий образования компонентов при 298 К. Эти величины находим в справочниках и формируем таблицу со справочными данными по всем компонентам этой реакции.
Таблица 5.1
Данные для расчета стандартных мольных энтропий и энтальпий реакции
Вещество k |
νk |
Стандартная мольная энтальпия образования вещества k,
|
Стандартная мольная энтропия вещества k,
|
C12H26 |
1 |
286,69 |
622,54 |
H2 |
1 |
0,0 |
130,52 |
C6H14 |
2 |
167,19 |
388,40 |
![]() =
=
= (1)(286,69) + (1)0 + 2(167,19) = 47,69 кДж/моль;
![]() = (1)622,54
+ (1)130,52
+ 2388,4
=
= (1)622,54
+ (1)130,52
+ 2388,4
=
= 23,74 Дж/(мольК).
Составляем еще одну таблицу исходных данных для расчета величин Δra, Δrb, Δrc, Δrc'.
Таблица 5.2
Коэффициенты температурной зависимости теплоемкости
Вещество k |
νk |
|
|||
ak |
bk 103 |
ck 106 |
c'k 10 5 |
||
C12H26 |
1 |
14,19 |
844,82 |
593,08 |
0,0 |
H2 |
1 |
27,28 |
3,26 |
0,0 |
0,5 |
C6H14 |
2 |
8,66 |
505,85 |
184,43 |
0,0 |
![]() =
(1)∙14,19
+(1)∙27,28
+ 28,66
=
24,15 Дж/(мольК);
=
(1)∙14,19
+(1)∙27,28
+ 28,66
=
24,15 Дж/(мольК);
![]() =
(1)∙0,84482
+(1)∙0,00326
+ 20,50585
= 0,16 362
Дж/(мольК2);
=
(1)∙0,84482
+(1)∙0,00326
+ 20,50585
= 0,16 362
Дж/(мольК2);
![]() =
(1)∙5,93110
4
+(1)0
+ 2∙(1,84410
4)
=
=
(1)∙5,93110
4
+(1)0
+ 2∙(1,84410
4)
=
= 9,62104 Дж/(мольК3);
![]() =
(1)0
+ (1)∙50
000 + 20
= 50
000 ДжК/моль.
=
(1)0
+ (1)∙50
000 + 20
= 50
000 ДжК/моль.
Найденные коэффициенты позволяют записать зависимость стандартной мольной изобарной теплоемкости реакции от температуры:
![]() ;
;
![]() (T)
= 24,15
+ 0,1636 Т
– 9,6210
4
Т2
5104
Т
2
Дж/(мольК).
(T)
= 24,15
+ 0,1636 Т
– 9,6210
4
Т2
5104
Т
2
Дж/(мольК).
Именно эта зависимость в дальнейшем будет использоваться при интегрировании. По уравнению Кирхгофа:
![]() .
.
Разделим переменные и проинтегрируем:
![]() ;
;
![]()
![]()
![]() = 47
690 – 24,15(Т
298) +
0,16 362 (Т
2
2982)
= 47
690 – 24,15(Т
298) +
0,16 362 (Т
2
2982)
0,339,6192104
(Т 3
2983)
+ 50 000
![]() .
.
Проведя дальнейшие преобразования, получим температурную зависимость стандартной мольной энтальпии данной химической реакции:
= 39 440 24,15Т + 0,08 181Т 2 – 3,20610 4Т 3 + 5104Т –1.
Стандартную
мольную энтропию реакции при любой
температуре
![]() найдем после интегрирования соотношения
найдем после интегрирования соотношения
.
Разделим переменные и произведем интегрирование:
![]() .
.
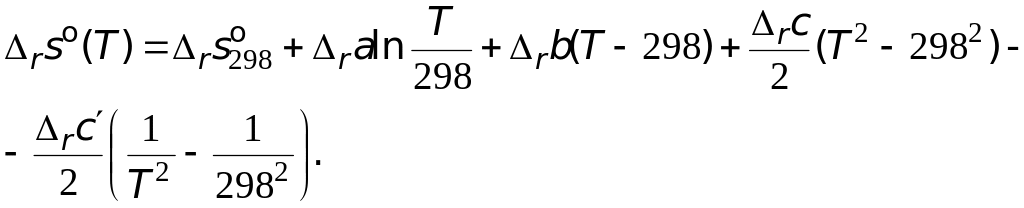
Подстановка значений температурной зависимости стандартной мольной изобарной теплоемкости реакции приводит к следующему виду уравнения
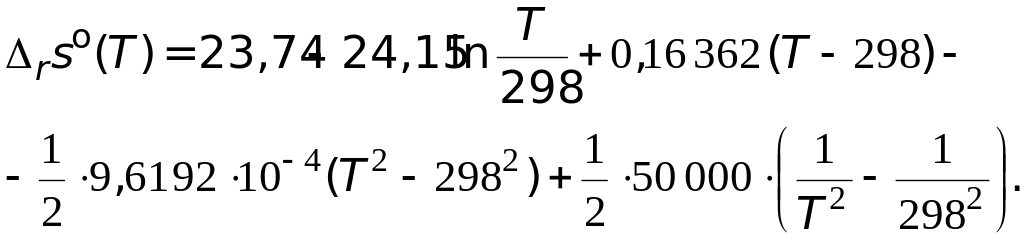
Проведя преобразования, находим температурную зависимость энтропии данной реакции
![]() =
154,996 – 24,15 ln
Т
+ 0,16 362 Т
– 4,81104
Т 2
+ 25 000 Т
2
.
=
154,996 – 24,15 ln
Т
+ 0,16 362 Т
– 4,81104
Т 2
+ 25 000 Т
2
.
Воспользовавшись выведенными зависимостями стандартных мольных энтропии и энтальпии реакции от температуры, найдем значения этих функций, а также значение энергии Гиббса при 900 К.
![]() =
39 440
24,15∙900 + 0,08 181∙9002
– 3,20610
4∙9003
+
=
39 440
24,15∙900 + 0,08 181∙9002
– 3,20610
4∙9003
+
+5104∙900 –1 = − 228 570 Дж/моль;
![]() =
154,996 – 24,15ln
900
+ 0,16 362 ∙900
– 4,81104
∙900
2+
=
154,996 – 24,15ln
900
+ 0,16 362 ∙900
– 4,81104
∙900
2+
+25 000∙900 2 = −251,57 Дж/(моль∙К);
![]() −
−
![]() =
−228 570 − 900∙(−251,57) =
=
−228 570 − 900∙(−251,57) =
= −2157,0 Дж/моль.
Пример 2. Рассчитайте величину константы равновесия реакции, рассматриваемой в примере 1 и равновесный состав при температуре 900 К. В начальный момент времени в системе присутствуют по 1 молю н-додекана и водорода. Продуктов реакции в начальный момент времени нет.
Решение. Располагая данными о значении стандартной мольной энергии Гиббса реакции при 900 К, найдем по формуле (5.10) величину константы равновесия
![]() =
=![]() =
1,33.
=
1,33.
Формируем
таблицу для дальнейшей работы.
При этом вводим символьное обозначение
реактантов, для составления балансовых
соотношений руководствуемся формулой
![]() ,
а для определения мольных долей
формулой
,
а для определения мольных долей
формулой
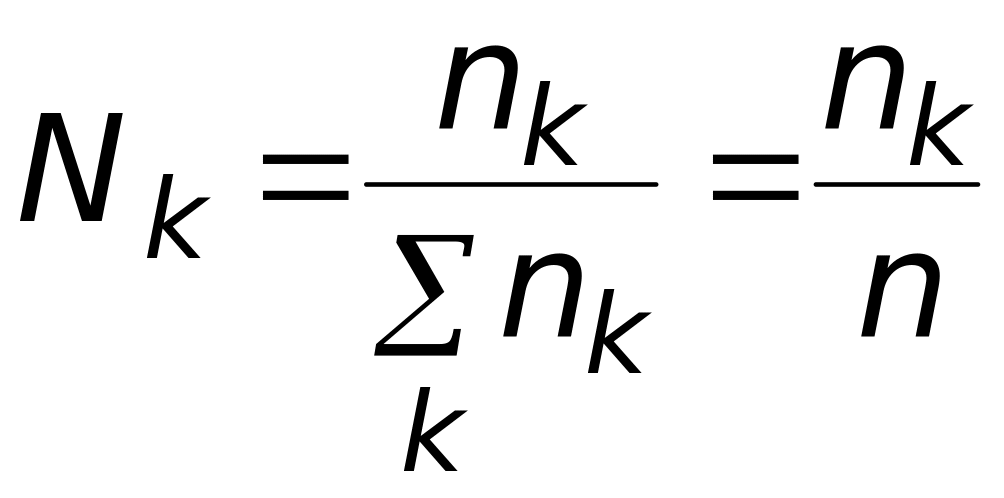 .
.
Таблица 5.3
Данные для составления закона равновесия
Характеристики |
Компонент |
||
C12H26 (А) |
H2 (В) |
C6H14 (С) |
|
Начальное
число молей,
|
1 |
1 |
0 |
Число
молей в момент равновесия,
|
1 ξ |
1 ξ |
2ξ |
Суммарное
число молей,
|
|
||
Равновесные мольные доли компонентов, |
|
|
ξ |
Закон химического равновесия для рассматриваемой реакции
![]() .
.
Решение квадратного уравнения относительно глубины химической реакции дает значение ξ = 0,266. Теперь легко определить состав в шкале мольных долей. Находим выражение для равновесных мольных долей компонентов и, располагая значениями глубины реакции, вычисляем их значения.
![]() =
0,367;
=
0,367;
![]() =
= 0,266.
=
= 0,266.
Примечание. В этом примере давление не входит в закон химического равновесия, однако для реакций, в которых число молекул исходных веществ в стехиометрическом уравнении не равно числу молекул продуктов, давление обязательно будет присутствовать в уравнении.
Пример
3. Реакция
A
+ B
= C
+ 2D
протекает в газовой фазе. Составьте
уравнение закона химического равновесия,
если начальные количества веществ: 1)
равны стехиометрическим коэффициентам,
продуктов реакции в начальный момент
нет; 2) не равны стехиометрическим
коэффициентам. Рассчитайте равновесный
состав смеси, если известно, что константа
равновесия при температуре опыта равна
0,54 ([p]
= 1 атм), начальные количества веществ
равны
![]() моль;
моль;
![]() моль;
моль;
![]() моль;
моль;
![]() ,
а давление в системе 2 атм.
,
а давление в системе 2 атм.
Решение. Для составления выражения закона химического равновесия в случае, когда начальные количества исходных веществ равны стехиометрическим коэффициентам, сформируем таблицу, в которой запишем балансовые соотношения и выражения для мольных долей участников реакции.
Таблица 5.4
Данные для составления закона равновесия
Характеристики |
Компонент |
||||
А |
В |
С |
D |
||
Начальное число молей, |
1 |
1 |
0 |
0 |
|
Равновесное число молей, |
1 ξ |
1 ξ |
ξ |
2ξ |
|
Суммарное число молей, |
+ ξ |
||||
Равновесные мольные доли компонентов, |
|
|
|
|
|
Закон химического равновесия для рассматриваемой реакции и случая, когда начальный состав соответствует стехиометрическому,
![]() .
(5.16)
.
(5.16)
Решение уравнения (5.16) позволит определить равновесную глубину химической реакции и равновесный состав в мольных долях. Однако прежде чем будет рассмотрен метод вычисления равновесного состава по полученному закону химического равновесия, рассмотрим случай, когда в газовой смеси наблюдается нестехиометрическое соотношение между исходными веществами. Для составления закона химического равновесия сформируем таблицу, в которой запишем балансовые соотношения и выражения для мольных долей реактантов.
Таблица 5.5
Данные для составления закона равновесия
Характеристики |
Компонент |
||||||
А |
В |
С |
D |
||||
Начальное
число молей
|
2 |
0,5 |
1 |
0 |
|||
Равновесное число молей |
2 ξ |
0,5ξ |
1+ ξ |
2ξ |
|||
Суммарное
число молей
|
|
||||||
Равновесные мольные доли компонентов |
|
|
|
|
|||
Выражение закона химического равновесия будет иметь вид
![]()
![]() .
(5.17)
.
(5.17)
Уравнение (5.17) после подстановки в него данных из условия задачи примет вид:
![]() .
(5.18)
.
(5.18)
Подобные
уравнения решают или методами
последовательного приближения, или
графически. Задавая в разумных пределах
значение
с некоторым шагом и вычисляя правую
часть уравнения (5.18), можно получить
графическую зависимость
![]() от ξ.
Очевидно, что
не может быть отрицательна, следовательно,
в нашем примере
от ξ.
Очевидно, что
не может быть отрицательна, следовательно,
в нашем примере
![]() <
0,5. Несложные расчеты (не надо раскрывать
скобки ни в числителе, ни в знаменателе!)
приводят к следующим значениям:
<
0,5. Несложные расчеты (не надо раскрывать
скобки ни в числителе, ни в знаменателе!)
приводят к следующим значениям:
0,1 0,2 0,25 0,3 0,35
0,128 0,192 0,380 0,724 1,388
Наносим эти данные на график (рис. 5.1).
Если отметить на графике зависимости точку с ординатой (соответствующей значению константы равновесия при исследуемой температуре), то решением уравнения (5.18) будет являться значение абсциссы этой точки.
В
общем случае на графике зависимости
может быть несколько точек с заданной
ординатой
,
все они являются решениями уравнения
![]() ,
и полученные
значения
нуждаются в дополнительной проверке.
,
и полученные
значения
нуждаются в дополнительной проверке.
П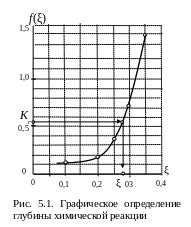 о
графику определяем, что при f(ξ)
=
=
0,54 значение глубины химической реакции
равно
= 0,28.
о
графику определяем, что при f(ξ)
=
=
0,54 значение глубины химической реакции
равно
= 0,28.
Равновесный состав смеси − это равновесные мольные доли всех компонентов. Подставляя полученное значение глубины реакции в выражения мольных долей компонентов, получаем:
NA = 0,455; NB = 0,058;
NC = 0,339; ND = 0,148.
Иногда в качестве переменной удобно использовать степень термической диссоциации. Реакции термической диссоциации, это реакции типа:
A = B + C ;
A = B + C + D;
A = 2B + C + D и т.д.
Представим, что константа равновесия реакции известна.
Введем обозначение:
обозначим число молей исходного,
термически разлагающегося вещества,
через
![]() .
.
Степень термической диссоциации находится по формуле
![]() =
=![]() .
.
Отсюда можно связать глубину химической реакции со степенью термической диссоциации
![]() ,
(5.14)
,
(5.14)
где относится к исходному веществу, которое в реакции термической диссоциации обычно записано с единичным стехиометрическим коэффициентом.
Для любого участника реакции k балансовое соотношение можно записать по формуле
![]() .
.
Для исходного вещества в реакции термической диссоциации равновесное количество исходного вещества равно
![]() .
.
Запишем данные для расчета равновесного состава реакции
A= 2B + C
![]()
![]() ,моль
0 0
,моль
0 0
![]() ,
моль
,
моль
![]() 2
2![]()
![]() =
+ 2
+
=
=
+ 2
+
=
![]()
![]()
![]()
![]()
![]()
Следует обратить внимание на то, что при правильной записи балансовых соотношений введенное нами число молей исходного вещества должно сократиться. Закон химического равновесия имеет вид
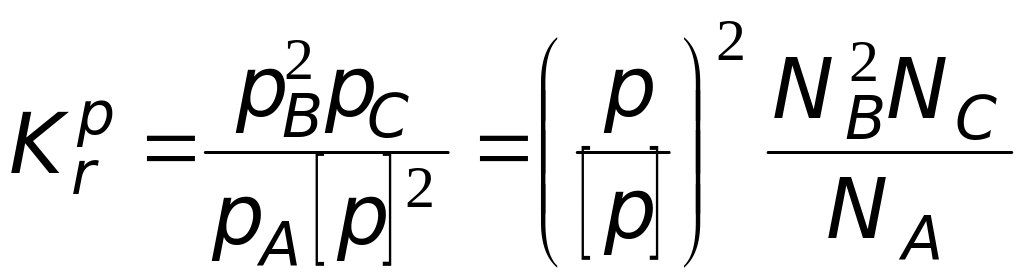 .
.
Уравнения для расчета состава равновесной смеси
![]() .
.
Аналогично
предыдущему примеру определяем степень
термической диссоциации графически
по рассчитанной зависимости
![]() и известному значению константы
равновесия или аналитически, если
выражение закона химического равновесия
не содержит высоких степеней при степени
термической диссоциации.
и известному значению константы
равновесия или аналитически, если
выражение закона химического равновесия
не содержит высоких степеней при степени
термической диссоциации.
Пример 4. Для реакции N2 + 3H2 = 2NH3, протекающей в газовой фазе при 298 К, константа равновесия при выражении давления в паскалях равна 6,0105, а стандартная мольная энтальпия реакции равна –92,2 кДж./моль. Найти константу равновесия при 500 К.
Решение. Из интегральной формы уравнения изобары имеем
![]() =
=
=
![]() =
–1,73,
=
–1,73,
откуда
![]() = 0,18.
= 0,18.
Пример 5. Имеется
смесь следующих идеальных газов: SO2,
O2,
SO3.
Известны парциальные давления компонентов
газовой смеси при 727 оС
:
![]() =0,25
атм,
=0,25
атм,
![]() =0,125
атм ,
=0,125
атм ,
![]() =0,625
атм. Определите, в каком направлении
( прямом или обратном) будет протекать
следующая реакция: 2SO2
+O2
= 2SO3
, а также определите, в каком направлении
( в сторону исходных веществ или в
сторону продуктов) будет смещаться
равновесие при изобарном повышении
температуры.
=0,625
атм. Определите, в каком направлении
( прямом или обратном) будет протекать
следующая реакция: 2SO2
+O2
= 2SO3
, а также определите, в каком направлении
( в сторону исходных веществ или в
сторону продуктов) будет смещаться
равновесие при изобарном повышении
температуры.
Решение
О направленности реакции судят по уравнению изотермы Вант-Гоффа

Если бы была
известна
![]()
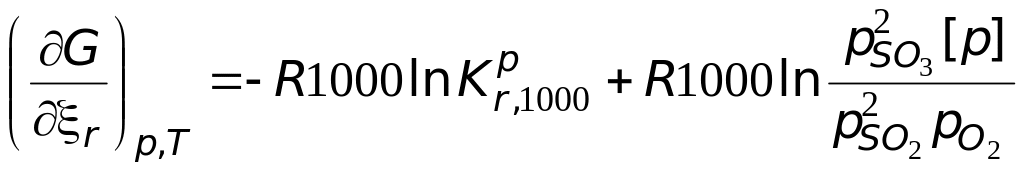
Если сродство реакции положительно (дифференциальное мольное изменение функции Гиббса отрицательно), то реакция может идти слева направо
Если константа
равновесия при данной температуре
неизвестна, то находим
![]() (например, по методу Темкина-Шварцмана):
(например, по методу Темкина-Шварцмана):
![]() ,
а затем
,
а затем
 .
.
Пример 6. Известно, что для реакции СO2 = СО + 0,5 O2 при 1227 C и давлении 1,013 10 5 Па равновесная степень термической диссоциации составляет 4,810 −4 . Определите, в каком направлении пойдет процесс, и рассчитайте химическое сродство реакции, если парциальные давления CO2 , CO и O2 равны 1,013 10 5 Па; 1,013 10 5 Па; 1,013 10 5 Па.
Решение. Аналогично предыдущему примеру, воспользуемся уравнением изотермы Вант-Гоффа. Для того чтобы ответить на вопрос задачи, нужно располагать данными о значении константы равновесия данной реакции при 1227 C и давлении 1,013 10 5 Па. Причем, раз в задаче указана равновесная степень диссоциации, то её нужно использовать для нахождения величины константы равновесия. Запишем данные для нахождения константы равновесия по величине степени термической диссоциации (т.е. решения обратной задачи химического равновесия).
![]()
,моль 0 0
, моль 0,5
=
+
+ 0,5
=
![]()
![]()
![]()
![]()
Закон химического равновесия имеет вид:
![]()
![]() .
Подставляя значение ,
вычисляем
.
Подставляя значение ,
вычисляем
![]() .
.
