
- •Классификация неорганических соединений
- •1. Основные классы неорганических соединений
- •1.1.1. Классификация оксидов
- •1.1.2. Номенклатура оксидов.
- •1.1.3. Графическое изображение формул оксидов.
- •1 .1.4. Физические свойства оксидов.
- •1.1.5. Химические свойства оксидов.
- •1.1.6. Способы получения оксидов
- •1.1.7. Области применения оксидов.
- •1.1.8. Вопросы для самоконтроля по теме оксиды
- •1.2. Основания
- •1.2.1. Классификация оснований
- •1.2.2. Графическое изображение формул оснований.
- •1 .2.3. Номенклатура оснований.
- •1.2.4. Химические свойства оснований
- •1.2.5. Амфотерные гидроксиды
- •С кислотами,
- •1.2.6. Способы получения оснований
- •1.2.7. Области применения оснований.
- •1.2.8. Вопросы для самоконтроля по теме основания
- •1.3.2. Номенклатура кислот.
- •Традиционные названия некоторых кислородсодержащих кислот
- •Сиcтематические названия некоторых кислот
- •1.3.3. Графическое изображение формул кислот.
- •1.3.4. Физические свойства кислот.
- •1.3.5. Химические свойства кислот.
- •1.3.6. Способы получения кислот.
- •1.3.7. Области применения кислот.
- •1.3.8. Вопросы для самоконтроля по теме кислоты
- •1.4. Соли
- •1.4.1. Классификация солей.
- •1.4.2. Номенклатура солей.
- •Традиционные названия кислотных остатков наиболее распространенных кислот
- •1.4.3. Графическое изображение формул солей
- •1.4.4. Физические свойства солей.
- •1.4.5. Химические свойства солей.
- •1.4.6. Способы получения солей.
- •Применение солей.
- •1.4.8. Вопросы для самоконтроля по теме соли
- •1.5. Генетическая связь между основными классами неорганических соединений
- •1.6. Тривиальные названия некоторых индивидуальных веществ, смесей и сплавов. Названия некоторых минералов.
- •2. Неосновные классы неорганических соединений.
- •Бинарные соединения, содержащие водород.
- •Названия некоторых бинарных соединений
- •3.1. Варианты тестированного контроля знаний по теме « Основные классы неорганических соединений» Вариант № 1
- •1. Азотноватистая 3. Азотная
- •2. Азотоводородная 4. Азотистая
- •1) Синий 2) желтый 3) бесцветный 4) малиновый.
- •Ответы на вопросы теста на стр. 53 Вариант № 2
- •Ответы на вопросы теста на стр. 53 Вариант № 3
- •Ответы на вопросы теста на стр. 54
- •3.2. Ответы на вопросы тестированного контроля знаний по теме « Основные классы неорганических соединений» Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •4. Вопросы и упражнения для самоподготовки.
- •1) Оксид натрия 2) серная кислота 4) вода 8) соляная кислота 16) гидроксид бария 32) гидроксид натрия
- •1) Взаимодействие основания с кислотой 2) взаимодействие активного металла с водой 4) взаимодействие основных оксидов с водой 8) взаимодействие солей со щелочами
- •16) Электролиз водных растворов солей 32) взаимодействие амфотерных оксидов с водой.
- •1) Соляная кислота 2) гидроксид калия 4) оксид кремния (IV)
- •8) Серная кислота 16) гидроксид бария 32) вода
- •1) Синий 2) желтый 3) бесцветный 4) малиновый.
- •1) Синий 2) желтый 3) бесцветный 4) малиновый.
- •1) Синий 2) желтый 3) бесцветный 4) малиновый.
- •1) Добавить раствор хлорида натрия 2) добавить раствор соляной кислоты 4) добавить раствор гидроксида калия 8) добавить раствор азотной кислоты.
- •1) Гашеная известь 2) негашеная известь 3) натронная известь 4) каустик 5) едкий натр
- •1) Цинк 2) медь 4) натрий 8) серебро
- •16) Алюминий 32) золото?
- •1) HBr 2) hClO4 4) h2so4 (разбавл.) 8) ch3cooh
- •16) Hno3 (разбавл.) 32) h2so4 (концентр.)
- •1) Азотная кислота 2) хлорная кислота 3) хлорноватая кислота 4) хлорноватистая кислота 5) серная кислота.
- •1) Koh (раствор) 2) NaOh (расплав)
- •4) BaO тв. (при нагревании) 8) н2so4 16) Al2o3
- •1) Пропусканием через раствор гидроксида калия
- •2) Пропусканием через известковую воду 4) пропусканием через раствор нитрата серебра 8) пропусканием через раствор гидросульфида калия 16) пропусканием через раствор перманганата калия
- •Цинк и магний 2) медь и цинк 4) железо и медь
- •8) Ртуть и серебро 16) натрий и никель
- •Лабораторная работа
- •1. Разделы теоретического курса для повторения.
- •2. Вопросы и упражнения.
- •Экспериментальная часть §1. Химические свойства кислот. А) Ознакомление со свойствами кислот
- •Б) Взаимодействие растворов обычных кислот с металлами.
- •В) Взаимодействие растворов кислот с основными оксидами.
- •§2 Химические свойства оснований. А) Ознакомление со свойствами оснований.
- •Б) Получение и термическое разложение оснований.
- •§3 Получение и свойства амфотерных гидроксидов.
- •§6 Генетическая связь между классами неорганических соединений.
- •Справочные материалы
- •Относительная электроотрицательность элементов по Полингу
- •Стандартные электродные потенциалы металлов при 250с
- •Тривиальные названия
- •Тривиальные названия некоторых смесей веществ.
- •Названия некоторых сплавов.
- •Названия некоторых распространенных минералов.
- •Оглавление Теоретическая часть.
- •1. Основные классы неорганических соединений
- •1.1. Оксиды.
- •1.2. Основания.
- •1.3. Кислоты
- •1.4. Соли
1.1.1. Классификация оксидов
Оксиды подразделяются на солеобразующие и несолеобразующие (безразличные).
Солеобразующими называют такие оксиды, которые в результате химических реакций способны образовывать соли.
Несолеобразующие оксиды такой способностью не обладают. Примером несолеобразующих оксидов могут служить следующие вещества: СО, SiO, N2O, NO.
Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и амфотерные.
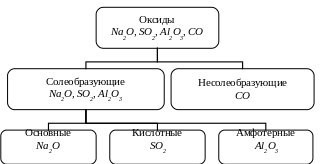
Рис.3 Схема классификации оксидов
Основными оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения воды) соответствуют основания.
Например:
Na2O +H2O = 2NaOH
Формула основного оксида |
Соответствующая гидратная форма (основание) |
Na2O |
NaOH |
BaO |
Ba(OH)2 |
CaO |
Ca(OH)2 |
FeO |
Fe(OH)2 |
Основные оксиды образуются металлами при проявлении ими невысокой валентности (обычно I или II).
Оксиды таких металлов, как Li, Na, К, Rb, Сs, Fr, Са, Sr, Ва непосредственно взаимодействуют с водой с образованием растворимых в воде оснований - щелочей.
Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей (косвенным путем).
Кислотными оксидами называются такие оксиды, которым в качестве гидратов соответствуют кислоты. Кислотные оксиды называют также ангидридами кислот.
Например:
SO3 + H2O = H2SO4
-
Формула кислотного оксида
Соответствующая гидратная форма (кислота)
SO2
H2SO3
SO3
H2SO4
P2O5
H3PO4
CrO3
H2CrO4
Mn2O7
HMnO4
V2O5
HVO3
Кислотные оксиды образуются при окислении неметаллов и металлов, если последние имеют в полученном оксиде высокое значение валентности. Например, оксид марганца (VII) - кислотный оксид, так как это оксид металла с высокой валентностью (VII). В качестве гидрата этому оксиду будет соответствовать кислота - НMnО4.
Большинство кислотных оксидов могут непосредственно взаимодействовать с водой и при этом образовывать кислоты.
Например:
СО2 + Н2О = Н2СО3
P2O5 +3Н2О = 2Н3РO4
SO3 + Н2О = Н2SО4
Некоторые оксиды непосредственно с водой не взаимодействуют. Такого типа оксиды сами могут быть получены из кислот.
Например:
SiO2 + H2O реакция не идет
H2SiO3
![]() SiO2
+ H2O
SiO2
+ H2O
Это подтверждает названия кислотных оксидов - ангидриды, то есть "не содержащие воду". Одно из названий SiO2 – ангидрид кремниевой кислоты.
Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий проявляют свойства как основных (в кислой среде), так и кислотных (в щелочной среде) оксидов.
К амфотерным оксидам относятся оксиды некоторых металлов. Например:
BeO, Al2O3, PbO, SnO, ZnO, PbO2, SnO2, Cr2O3.
При реакциях с кислотами амфотерные оксиды проявляют свойства основных оксидов:
РbО + 2НNО3 = Рb(NО3)2 + Н2О
При реакциях со щелочами амфотерные оксиды проявляют свойства кислотных оксидов:
РbО +2NaOН Na2PbO2 + Н2О
Амфотерные оксиды с водой непосредственно не взаимодействуют, следовательно, их гидратные формы получают косвенно - из солей.
Несолеобразующие (индифферентные, или безразличные) оксиды - небольшая группа оксидов, которые не вступают в химические реакции с образованием солей.
К несолеобразующим оксидам относятся, например, СО, N2O, NO, SiO.
