
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Лабораторная работа № 1
- •Лабораторная работа № 2
- •Лабораторная работа № 3 Зависимость степени гидролиза солей от температуры
- •Лабораторная работа № 4
- •Лабораторная работа № 5 Полный гидролиз солей
- •Упражнения и задачи:
Лабораторная работа № 5 Полный гидролиз солей
Оснащение опыта: пробирки, растворы алюминий сульфата, натрий карбоната, соляной кислоты, натрий гидроксида.
Выполнение опыта: В пробирку внесите 5–7 капель раствора алюминий сульфата и такое же количество натрий карбоната. Отметьте образование осадка и выделение пузырьков газа. Какими реакциями можно доказать, что образовавшееся малорастворимое соединение представляет собой алюминий гидроксид, а не продукт обменного взаимодействия исходных солей? Проведите эти превращения.
ФОРМА ОТЧЕТА:
1. Составьте молекулярное и молекулярно-ионное уравнения взаимодействия алюминий сульфата и натрий карбоната в водной среде.
2. Объясните, почему при взаимодействии этих солей гидролиз протекает практически необратимо.
3. Сделайте вывод об условиях протекания полного гидролиза солей.
4. Составьте уравнение реакций растворения алюминий гидроксида в соляной кислоте и в растворе натрий гидроксида.
ХОД ЗАНЯТИЯ:
Важнейшей биосредой является вода. Описание процессов, протекающих в водных растворах, возможно с позиций теории химического равновесия. Многие обратимые процессы, играющие важную роль в метаболизме живых организмов, связаны с обратимым переносом протонов.
Вода – слабый электролит, диссоциацию которого можно представить схемой:
Н2О
![]() Н+ + ОН‾
Н+ + ОН‾
Вода – очень слабый природный электролит: при комнатной температуре из 5 млн. молекул воды диссоциирует на ионы только одна молекула.
Поскольку [Н2О]>>[Н+] [ОН‾], то можно считать, что [Н2О] = const
![]()
Кс [Н2О] = [Н+] [ОН‾]
Kс[Н2О] = KW – ионное произведение воды, константа равновесия, описывающая обратимую диссоциацию воды:
Кw = [H+][OH-] = 10-14 (t = 25oC)
Гидролиз (гидролитическое разложение) – это реакция разложения сложных веществ на более простые вещества под воздействием воды.
Гидролиз солей – это реакция ионного обмена между составными частями соли и воды, протекающая с изменением кислотности раствора
Гидролиз соли, образованной слабым основанием и сильной кислотой:
NH4Cl+ H2O NH4OH + HCl
![]() +
H2O
NH4OH
+ H+
+
H2O
NH4OH
+ H+
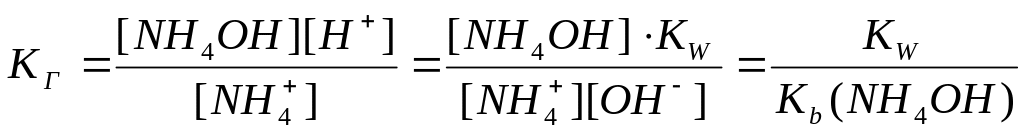
Гидролиз соли, образованной слабой кислотой и сильным основанием:
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + H2O CH3COOH + OH-
![]()
Гидролиз соли, образованной слабым основанием и слабой кислотой:
CH3COONH4 + H2O NH4OH + CH3COOH
![]()
Способность соли к гидролизу характеризуется при помощи степени гидролиза (h):
![]()
![]()
Чем больше константа гидролиза, тем сильнее гидролизуется соль.
6. вопросы ДЛЯ САМОконтроля знаний:
6.1 Понятие о гидролизе солей. Влияние гидролиза на кислотность среды водных растворов солей.
6.2 Понятие о константе гидролиза. Расчет константы гидролиза для различных типов гидролизующихся солей.
6.3 Степень гидролиза, взаимосвязь константы и степени гидролиза, факторы, влияющие на гидролиз.
Упражнения и задачи:
1) Какие из перечисленных солей будут подвергаться гидролизу: хром (III) хлорид, калий гидрокарбонат, барий сульфид, цезий иодид? Составьте молекулярные и молекулярно-ионные уравнения гидролиза.
2) При гидролизе какой соли в водном растворе среда щелочная: а) к2CO3, б) FeBr3, в) KClO4? Ответ подтвердите соответствующими уравнениями реакций.
3) Какую окраску будет иметь метилоранж в водных растворах следующих солей: а) Na3PO4, б) NiSO4, в) NaI, г) Co(NО3)2? Ответ подтвердить соответствующими уравнениями реакций.
4) Закончите составление уравнений реакций и расставьте коэффициенты:
а) CrCl3 + Na2CО3 + H2O →
б) Fe2(SO4)3 + K2S + H2O →
5) Подберите по два уравнения в молекулярном виде к каждому из молекулярно-ионных уравнений:
а) NH4+ + H2O NH4OH + H+
б) Fe3+ + 2H2O Fe(OH)2+ + 2H+
в) S2ˉ + H2O HSˉ + OHˉ
6) Вычислите константу и степень гидролиза 0,1 М раствора натрия цианида. Ка (HCN) = 1,0∙10ˉ9.
7. ЛИТЕРАТУРА
ОСНОВНАЯ:
1. Конспект лекций.
2. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – М.: Высш. шк., 2005. – с. 80-95, с. 107-108, с. 120-131;
3. Ленский, А.С. Введение в бионеорганическую и биофизическую химию: Учебн. пособие для студ. мед. вузов /А.С. Ленский. − М.: Высш. шк, 1989. – с. 146-150.
ДОПОЛНИТЕЛЬНАЯ:
1. Суворов, А.В. Общая химия. /А.В. Суворов, А.Б. Никольский. – СПб: Химия, 1994 г. – с. 241-259;
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студ. мед. спец. вузов/ Ю.А. Ершов, А.М. Кононов, С.А. Попков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 2005. - с. 39-42.
Авторы: Зав. кафедрой, доцент, к.х.н. Лысенкова А.В., доцент, к.х.н. Филиппова В.А., ст. преподаватели Прищепова Л.В. Чернышева Л.В., Одинцова М.В., ассистенты Короткова К.И., Перминова Е.А
28.08.2010
