- •Вид используемого электромагнитного излучения
- •Абсорбционные спектроскопические методы анализа Основной закон поглощения электромагнитного излучения
- •Практическое применение
- •Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •Фотометрические реакции
- •74 Продолжение Дифференциальная (разностная) фотометрия
- •Производная спектрофотометрия
- •Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •Измерение аналитического сигнала
- •Практическое применение
- •Процессы, приводящие к появлению аналитического сигнала
- •Измерение аналитического сигнала
- •Практическое применение
- •Природа вещества
- •Глава 22
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •22.3. Хроматографические параметры
- •Хроматографические характеристики, используемые для идентификации веществ (характеристики удерживания)
- •Хроматографические характеристики, используемые для количественного определения веществ
- •22.4. Теории хроматографического разделения
- •Глава 23
- •23.1. Общая характеристика
- •23.2. Устройство газового хроматографа
- •Хроматографическая колонка
- •Детекторы
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Неподвижные и подвижные фазы
- •24.4.2. Эксклюзионная хроматография
- •Глава 25
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •В табл. 25.1 приведена классификация основных электрохимических методов анализа в зависимости от измеряемого параметра.
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.2. Условия измерения аналитического сигнала
- •26.1.3. Индикаторные электроды
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
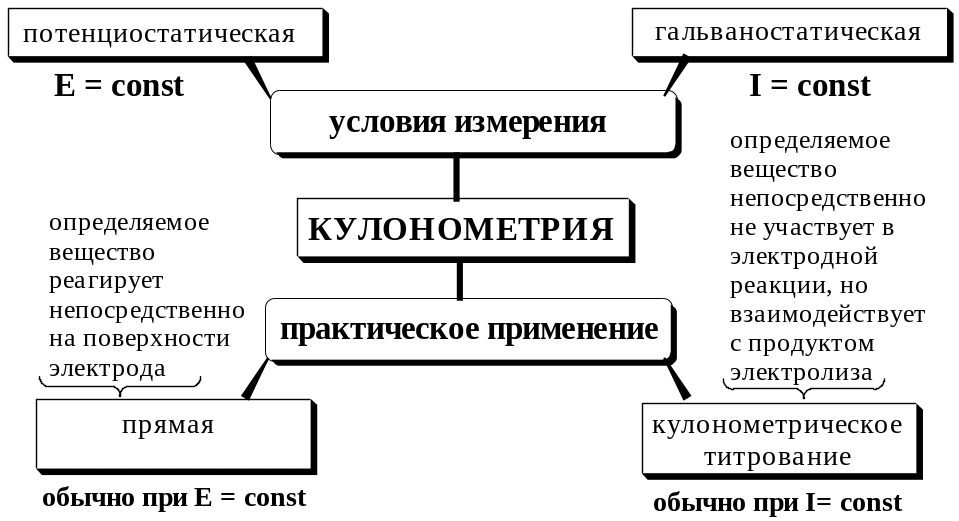
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •1) Рабочий электрод;
- •2) Электрод сравнения;
- •3) Вспомогательный электрод
- •26.2.3. Кулонометрическое титрование
- •Глава 27
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •27.3. Некоторые современные разновидности вольтамперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
26.1.4. Прямая потенциометрия
В прямой потенциометрии концентрацию (активность) определяемого вещества рассчитывают, исходя из величины ЭДС гальванического элемента. Чаще всего индикаторным в прямой потенциометрии является ионоселективный электрод. Прямые потенциометрические измерения, в которых используется ионоселективный электрод, называются ионометрией. Данный метод анализа характеризуется простотой и экспрессностью методик, недорогой аппаратурой

26.1.5. Потенциометрическое титрование
Потенциометрическим титрованием называется метод анализа, основанный на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым веществом и титрантом.
В основе потенциометрического титрования могут лежать различные протолитические, окислительно-восстановительные, осадительные реакции и реакции комплексообразования, протекающие количественно, стехиометрично и с приемлемой скоростью. Выбор индикаторного электрода для выполнения потенциометрического титрования зависит от используемой реакции. Например, при кислотно-основном титровании обычно используют стеклянный рН-чувствительный электрод, при окислительно-восстановительном может быть использован инертный платиновый электрод, при комплексонометрическом – электрод, чувствительный по отношению к ионам определяемого металла и т.д.
Конечную точку титрования обнаруживают с использованием кривой титрования, её производных, а также методом Грана. На рис. 26.3 показаны различные варианты обнаружения конечной точки титрования фосфорной кислоты гидроксидом натрия. Конечной точке титрования на исходной кривой титрования соответствует точка максимального наклона (точка перегиба) кривой, на её первой производной – точка максимума, второй производной – точка пересечения прямой, соединяющей две ветви кривой, с осью абсцисс. При использовании метода Грана конечной точке титрования соответствует точка пересечения прямых.
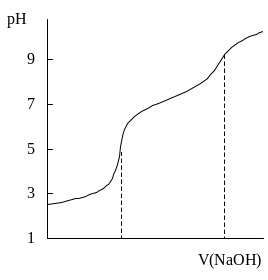
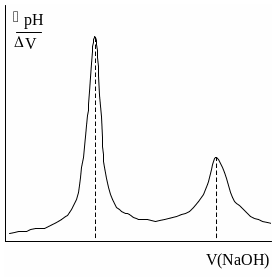
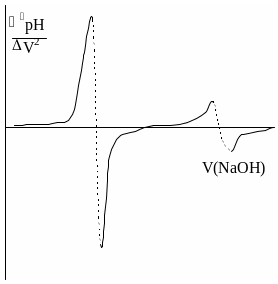
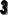
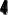
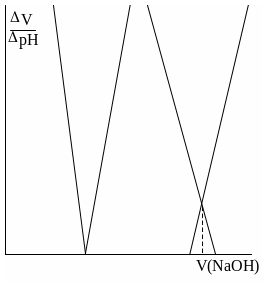
Рис. 26.3. Кривая потенциометрического титрования фосфорной кислоты (1), её первая (2) и вторая (3) производные, а также обнаружение конечных точек титрования методом Грана (4).
Преимущества потенциометрического титрования перед титрованием с визуальным обнаружением конечной точки титрования заключаются в том, что:
отсутствует субъективная ошибка обнаружения конечной точки титрования
определение веществ может проводиться в окрашенных и мутных растворах;
имеется возможность дифференцированного титрования компонентов смеси (в особенности, при использовании неводного титрования);
возможна автоматизации процесса титрования.
26.2. Кулонометрический метод анализа
Кулонометрическими называют электрохимические методы анализа, основанные на измерении количества электричества, прошедшего через электролитическую ячейку при электрохимическом окислении или восстановлении вещества на рабочем электроде.
26.2.1. Общая характеристика и классификация
Кулонометрия – это безэталонный метод анализа. Массу определяемого вещества при кулонометрических определениях рассчитывают непосредственно из величины аналитического сигнала. В основе кулонометрии лежат законы Фарадея для электролиза. Математическое выражение объединённого закона Фарадея имеет вид
![]()
где m – масса вещества, окисленного (восстановленного) в процессе электролиза; M – молярная масса вещества; n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея (F = 96487 Кл/моль 9,65104 Кл/моль), Q – количество электричества, Кл.
При проведении кулонометрических определений необходимо, чтобы:
отсутствовали побочные химические и электрохимические процессы, и выход по току был равен 100%;
определяемый элемент окислялся (восстанавливался) только до одной точно известной степени окисления;
был известен способ определения количества электричества или момента завершения реакции.