
- •Раздел 2
- •Глава 11
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием Расчёты, связанные с приготовлением растворов
- •Расчёты, связанные с титрованием
- •Глава 13
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •Метиловый красный
- •Тимолфталеин (бесцветный синий)
- •Феноловый красный
- •13.3. Кривые титрования
- •0,10 М раствором NaOh
- •Расчёты для построения кривой титрования
- •Расчёты для построения кривой титрования
- •0,10 М Na2co3 0,10 м раствором hCl
- •13.4. Факторы, влияющие на величину скачка титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.2. Критерии выбора растворителя для кислотно-основного титрования
- •14.3. Применение в фармацевтическом анализе Титрование в кислотных растворителях
- •Глава 15
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •1,010-3 М раствором эдта при рН 9,50 в присутствии 510-2 м nh3
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •Глава 16
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •Расчёты для построения кривой титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •Метод Мора
- •Метод Фольгарда
- •Особенность определения хлоридов
- •Особенность определения иодидов
- •Метод Фаянса
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •Титранты и стандартные вещества
- •Обнаружение конечной точки титрования
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
Химические
методы анализа![]()
Раздел 2


Глава 11

11.1. Общая характеристика
Гравиметрией (от лат. gravis – тяжёлый и греч. metreo – измеряю) называется совокупность методов количественного анализа, основанных на измерении массы определяемого вещества или его составных частей, выделенных в чистом виде или в виде соединений точно известного состава.
Устаревшее название гравиметрии – «весовой метод анализа». Такое название не совсем верно, поскольку аналитическим сигналом в гравиметрии является масса, а не вес.
Гравиметрия является одним из немногих представителей безэталонных методов анализа. Её используют в качестве метода сравнения при проверке правильности определений, выполненных другими методами; в качестве арбитражного метода анализа; для проверки стандартных образцов и т.п. Неопределённость результатов гравиметрических определений зависит, главным образом, от неопределённости измерения массы и составляет, в среднем, 0,1%.
11.2. Виды гравиметрических определений
В методе осаждения навеску определяемого вещества растворяют в воде, к полученному раствору добавляют необходимое количество реагента, реакция которого с определяемым веществом сопровождается выпадением осадка. Образовавшийся осадок отделяют от раствора, отмывают от посторонних веществ, высушивают, если необходимо прокаливают и затем измеряют его массу.
Соединение, в виде которого определяемый компонент осаждают из раствора, называется осаждаемой формой. Соединение, масса которого является аналитическим сигналом, называют гравиметрической формой.

Вещества, претендующие на роль осаждаемой и гравиметрической формы, должны обладать определёнными свойствами.

В методе отгонки часть анализируемого объекта является летучей, либо летучее соединение получается из определяемого вещества в процессе химической реакции.

Реже встречается вариант гравиметрического определения, называемый методом выделения, в котором определяемое вещество отделяют от других компонентов смеси фильтрованием, центрифугированием, экстракцией. К такого рода гравиметрическим определениям можно отнести также процесс определения зольности органических материалов. Органическое вещество разрушают с образованием летучих продуктов, и затем измеряют массу оставшейся золы
Наряду с перечисленными известны такие гравиметрические методы как термогравиметрия и электрогравиметрия, которые обычно относят к инструментальным методам анализа. При термогравиметрических определениях с помощью специальных термовесов измеряют изменение массы вещества при его нагревании. В электрогравиметрии в результате протекания процесса электролиза определяемое вещество осаждается на электроде (например, Ag+ в виде Ag на катоде или свинец в виде PbO2 на аноде). Аналитическим сигналом является увеличение массы электрода.
11.3. Понятие о механизме образования осадка
Необходимым условием для образования осадка является превышение произведением концентраций ионов, входяших в его состав, произведения растворимости. Образование осадка является сложным процессом, протекающим во времени и включающим в себя несколько стадий.
Момент смешивания реактивов и визуально заметное появление осадка разделяет некоторый промежуток времени, называемый индукционным периодом. Его величина зависит от химической природы образующегося осадка, концентрации реагентов, методики проведения эксперимента, чистоты реактивов и т.д.
Образованию осадка предшествует образование пересыщенного раствора. Максимальная концентрация вещества в пересыщенном растворе, при которой последний ещё остаётся устойчивым, называется сверхрастворимостью. Возможная зависимость растворимости и сверхрастворимости от температуры приведена на рис. 11.1.

Рис. 11.1. Возможная зависимость растворимости (1) и сверхрастворимости (2) от температуры
А – ненасыщенный раствор, Б – устойчивый (метастабильный)
пересыщенный раствор, В – неустойчивый пересыщенный раствор
Разность между сверхрастворимостью и растворимости зависит от природы вещества. Например, у BaSO4 сверхрастворимость превышает растворимость примерно в тысячу раз, т.е. о данном веществе можно сказать то, что оно склонно образовывать пересыщенные растворы, у AgCl сверхрастворимость больше растворимости всего лишь в 5 раз.
Процесс образования осадка начинается с образования первичных центров кристаллизации (первичных зародышей).

Размер критического зародыша зависит от природы образующих его ионов и составляет по одним данным 2-9 ионов, по другим – до 100 ионов.
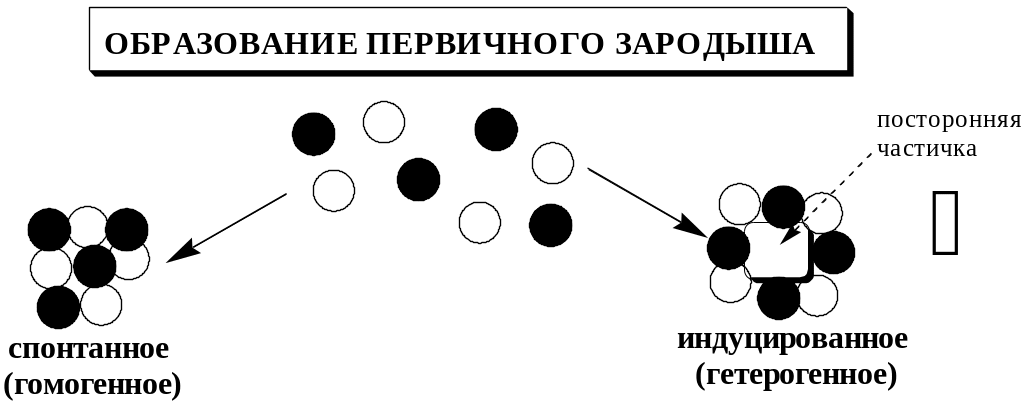
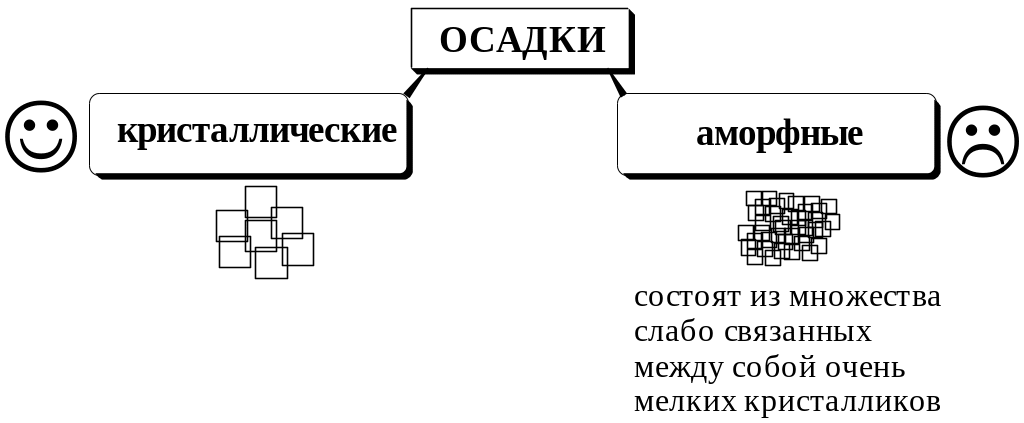
Образующиеся осадки могут быть:
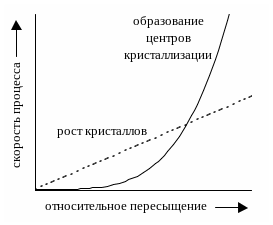
Характер образующегося осадка зависит от соотношения скоростей двух процессов: образования зародышей и роста первичных центров кристаллизации, которые зависят от относительного пересыщения раствора, возникающего при добавлении осадителя.
ОП =
![]()
где Q - концентрация осаждаемого компонента в какой-то момент времени в пересыщенном растворе; S - концентрация осаждаемого компонента в насыщенном растворе («растворимость»).
Рис.
11.2.
Зависимость
скоростей процессов образования
первичных центров кристаллизации и
роста кристаллов от величины ОП
![]() .
Для второго процесса n
= 1, а для первого
4, но величина k
для процесса роста кристаллов больше,
чем для процесса образования центров
кристаллизации
.
Для второго процесса n
= 1, а для первого
4, но величина k
для процесса роста кристаллов больше,
чем для процесса образования центров
кристаллизации
Примерная зависимость скорости процесса образования первичных зародышей и роста образовавшихся кристаллов от относительного пересыщения приведена на рис. 11.2. При малых значениях относительного пересыщения преобладает рост кристаллов, вследствие чего образуется немного крупных кристаллов, при больших - образование новых первичных центров кристаллизации, поэтому образуется множество мелких кристалликов.
Для образования крупнокристаллического осадка необходимо, чтобы величина относительного пересыщения при добавлении осадителя была незначительной.

Очень медленного поступления осадителя можно добиться с помощью приёма, называемого методом возникающих реагентов или осаждением из гомогенного раствора. К раствору добавляют вещество, образующее осадитель в процессе медленно протекающей реакции.

Метод «возникающих реагентов» позволяет получать кристаллические осадки таких веществ, которые при обычном осаждении образуют лишь аморфные осадки.
После охлаждения кристаллические осадки оставляют на 2 - 24 часа для «старения». При этом происходит растворение мелких кристаллов, укрупнение и самоочищение кристаллов. Созревший осадок является более чистым и легко отделяется от маточного раствора при фильтровании.
