Фармация, 2 курс, лекции биохимии / 14
.docВОЕННО-МЕДИЦИНСКАЯ АКАДЕМИЯ
Экз №__
Кафедра клинической биохимии и лабораторной диагностики
«УТВЕРЖДАЮ»
ИО начальника кафедры
клинической биохимии и
лабораторной диагностики
полковник медицинской службы
В.ПАСТУШЕНКОВ
«___» _____________ 2008 г.
доцент кафедры клинической биохимии и лабораторной диагностики
кандидат медицинских наук доцент Р.ГРАШИН
_____________________________________________________________________
должность, ученая степень, ученое звание, воинское звание, инициал имени, фамилия автора (авторов)
ЛЕКЦИЯ № 14
_________________________________________
(номер по тематическому плану изучения дисциплины)
по дисциплине: «Биохимия»
___________________________________________________________
(наименование учебной дисциплины)
на тему: «Обмен белков и аминокислот №1»
________________________________________________
(наименование темы занятий по тематическому плану изучения дисциплины)
с курсантами и студентами 2 курса факультетов подготовки врачей
(военно-медицинских специалистов иностранных армий)
Обсуждена и одобрена на заседании кафедры
«____» ____________ 200___ г.
Протокол №______
Уточнено (дополнено):
«____» ____________ 200___ г.
_____________________________________
(воинское звание, подпись, инициал имени, фамилия)
Цель лекции: рассмотреть вопросы обмена простых белков, начиная с потребления их с пищей, расщепления их в ЖКТ, проследить дальнейшее пищеварение образовавшихся в кишечнике и тканях аминокислот, уделив основное внимание процессам трансаминирования, окислительного дезаминирования, дальнейшим преобразованием -кетокислот. Рассмотреть метаболические превращения аминокислот в тканях, в результате которых происходит синтез биогенных аминов, креатина, незаменимых аминокислот, возможность образования из аминокислот глюкозы, липидов, энергии. Остановиться на конечных продуктах белкового обмена, на путях обезвреживания аммиака в организме.
Вопросы лекции:
1. Введение.
2.Азотистый баланс, биологическая ценность белков, нормы белка в питании;
3. Переваривание белка в ЖКТ;
4. Гниение белков в кишечнике;
5. Пути превращения аминокислот в тканях;
6. Окисление, трансаминирование.
7.Превращение аминокислот в углеводы и липиды. Использование углеродного скелета -кетокислот в интеграции белков с обменом веществ
Заключение.
Время лекции - 2 часа.
Литература
а) использованная при подготовке лекции:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. -М. Медицина 1990, сс. 318-368
2. Ленинджер А. Основы биохимии. М., Мир, 1985, т.2, сс. 571-597
3. Марри Р., Треннер Д. и др. Биохимия человека. М., Мир, сс. 167-168,306-319,
б) рекомендуемая курсантам и слушателям для подготовки к занятию:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. -М. Медицина 1990, сс. 345-354, 357-359, 364-368
ТЕХНИЧЕСКИЕ СРЕДСТВА ОБУЧЕНИЯ
-
Кодоскоп
-
Компьютер, программное и мультимедийное обеспечение
Введение.
Обмен белков занимает особое место в обмене веществ организма. Это объясняется не столько тем, что белки являются основными компонентами структуры клеток, тканей, органов, сколько природой, разнообразием физико-химических и прежде всего биологических свойств белков, присущих им как носителям жизни.
Белки также как и углеводы и липиды, поступая в организм с пищей, распадаясь, могут служить источниками энергии (при сгорании 1 г. белка освобождается 16,8 кДж энергии). Однако эта энергия без всякого ущерба для организма может быть компенсирована энергией распада жиров и углеводов. Опыты показывают, что длительное исключение углеводов и липидов из пищевого рациона не вызывает тяжёлых расстройств, в то время как безбелковая диета приводит к серьёзным нарушениям в организме. При этом белковая недостаточность проявляется прежде всего не в уменьшении массы органов и тканей, а в уменьшении активности ферментов, обусловленной замедлением синтеза их, так как помимо пластической, белки выполняют уникальную каталитическую функцию. Белковую природу имеют все ферменты и ряд таких важных регуляторов как гормоны. То есть через ферменты и гормоны белки регулируют превращение углеводов и липидов.
Белковый обмен координирует, регулирует и интегрирует химические превращения в целом организме.
Азотистый баланс
Интегральным показателем белкового обмена является азотистый баланс. Азотистый баланс - это соотношение азота поступающего в организм с пищей к азоту, выводимому из него с мочой, калом, потом, слезами и т.д. Различают три формы азотистого баланса: 1) положительный, когда количество вводимого в организм азота превышает количество азота выводимого из организма (свидетельствует о задержке азота в организме в результате усиления синтетических процессов; физиологическая форма наблюдается при беременности, лактации, у детей и молодёжи в период роста, у занимающихся атлетической гимнастикой - культуристов; при патологии - нарушение функции почек - суперпатология) 2) отрицательный, когда количество выводимого из организма азота превышает количество поступающего в организм азота (свидетельствует о недостатке поступления или усилении процессов деструкции, деградации; физиологически наблюдается у пожилых людей, в основном наблюдается при патологических процессах, сопровождающихся распадом тканей, потерей белка с мочой) 3) азотистое равновесие, когда количество азота, поступающего в организм равно количеству, выделяющегося из него (здоровый взрослый человек находится в состоянии азотистого равновесия, если получает достаточное количество белка с пищей). При увеличении количества белка с пищей увеличивается и количество выводимого из организма азота и наоборот, отсюда актуальным становится вопрос о пределах возможного увеличения и уменьшения содержания белка в пище, то есть о норме белка в питании.
Нормы белка в питании
Этот вопрос издавна волновал учёных. В организме постоянно идёт распад и синтез собственных белков тканей, органов. За сутки в организме взрослого человека обновляется до 400 г. белка. Продолжительность жизни индивидуальных белков различна, так - гемоглобина - 120 дней, белков плазмы - месяц, усреднённый период полураспада всех белков организма составляет 80 суток. Опытами установлено, что взрослый человек после 8-10 дней безбелкового питания, достаточного по общей калорийности начинает выделять постоянное количество азота, близкое 53 мг\сут\кг. Для человека весом 70 кг. Это составляет 3,71 г. азота или 6,25 3,71=23,2 белка в сутки - это минимальное количество белка постоянно распадающееся в организме. Рубнер назвал эту величину коэффициентом изнашивания. Эта величина является отправной точкой в определении нормы белка в питании, которая зависит от физиологического состояния организма, условий среды, энерготрат. Установлено, что организму необходимо 100-120 г. белка в сутки при энерготратах - 12000 кДж. При этом важно не только количество белка, но и его качество, 100-120 г. полноценного белка. При установлении биологической ценности белка также используется азотистое равновесие. Полноценный белок - белок, содержащий все незаменимые аминокислоты, в определённом соотношении, способный перевариваться и усваиваться. Эталон полноценного белка - яичный альбумин. Известно, что запасным углеводом в организме является гликоген, а липидов - триацилглицериды. Среди белков нет белка выполняющего подобную миссию, белки не способны запасаться, но при недостатке белка в питании источником могут служить белки плазмы крови, отчасти печени и мышц.
Переваривание белков в желудочно-кишечном тракте
Проблемы пароэнтерального питания показали, что белки могут быть использованы только после предварительного переваривания в желудочно-кишечном тракте. Значение этого процесса заключается в том, что при переваривании белки распадаются до мономеров-аминокислот, способных всасываться в кровь через кишечную стенку, а главное индифферентных по свойствам, лишённых видовой и тканевой специфичности.
Ферменты, расщепляющие белки - протеолитические ферменты, протеиназы (класс гидролаз), часто ещё называют пептидазами, но более корректно пептидазами называть ферменты, расщепляющие пептиды.
К протеиназам относятся: пепсин, реннин, гастриксин желудочного сока, аминопептидазы и пептидазы кишечного сока. Все протеиназы разделяют на эндо, т.е. расщепляющие пептидные связи внутри молекулы белка до пептонов и экзопептидазы, катализирующие разрыв концевых пептидных связей с освобождением одной аминокислоты. Особенностью протеиназ является то, что вырабатываются они в неактивной форме, в виде проферментов: пепсиноген, трипсиноген..., проэластаза, прокарбоксипептидаза и требует активирования. Способ активации довольно распространён в организме и называется частичный или ограниченный протеолиз того фермента полипептидной цепи фермента, который маскирует активный центр. Процесс осуществляется в присутствии активаторов: HCl для пепсиногена, энтерокиназы для трипсиногена и аутокаталитически, т.е. сам пепсин и сам трипсин активируют своего предшественника. Например, при активации трипсиногена энтерокиназой или аутокаталитически от него отщепляется гексопептид, а активный трипсин вызывает активацию хемотрипсиногена, проэластазы и прокарбоксипептидазы. Протеиназы обладают широкой субстратной специфичностью, т.е. гидрализуют пептидные связи свевозможных белков, но вместе с тем каждая отдаёт предпочтение и с большей скоростью разрывает связи, образованные определёнными аминокислотами. Так пептидную связь, образованную N-концевой аминокислотой разрывает аминопептидаза, С-концевой - карбоксипептидаза, пептин предпочитает пептидную связь, образованную аминогруппами ароматических аминокислот, а хемотрипсин - карбоксильными группами этих же кислот, трипсин - карбоксильными группами лизина и аргинина, эластаза - пептидные связи, образованные короткоцепочными аминокислотами (глицин, аланин, серин, пролин). Процесс переваривания пептидов и их расщепления до свободных аминокислот завершается пептидазами, дипептидазами. Набор протеолитических ферментов с подобной специфичностью имеется и в тканях, внутриклеточно в лизосомах - катепсины, тканевые протеиназы.
Превращения аминокислот под действием микрофлоры кишечника. Гниение.
Основная масса аминокислот всасываются в кишечнике в кровь, но 5-10% могут использоваться микрофлорой кишечника. Особенно этот процесс усиливается при застойных явлениях в кишечнике и носит название гниение в кишечнике.
Симбиоз микрофлоры и организма очень важен для жизнедеятельности человека, так как микрофлора осуществляет синтез витаминов К и В12 на 100%, частично витамины В1, В2, биотин, фолиевая кислота и другие.
Ферменты микроорганизмов кишечника осуществляют очень много реакций. К основным относятся: 1) реакции дезаминирования (из существующих 4 типов в анаэробных условиях кишечника протекают по крайней мере 3 типа: восстановительное, гидролитическое и внутримолекулярное). В результате их образуется аммиак и различные кислоты, которые используются, а аммиак обезвреживается печенью. При болезнях печени эта функция может нарушаться и концентрация NН3 периферической крови может повышаться до токсических уровней. Считают, что аммонийная интоксикация может играть роль в возникновении у некоторых больных печёночной комы. Показано, что оральное введение неомицина понижает количество аммиака, поступающего из кишечника в кровь благодаря антимикробному действию этого вещества. У больных с тяжёлым поражением печени диета с высоким содержанием белка, а так же желудочно-кишечными кровотечениями могут способствовать интоксикации NН3. В этих случаях также показан неомицин.
Реакции декарбоксилирования некоторых аминокислот под влиянием декарбоксилаз микроорганизмов приводят к образованию токсических продуктов. Так: а) из лизина в кишечнике может образоваться кадаверин, из орнитина - путресцин. Эти вещества относятся к так называемым “трупным ядам”, они всасываются, могут окисляться в печени с помощью моноаминооксидаз, а могут выделяться из организма в неизменном виде с мочой. В норме их в крови нет и появляются в значительных количествах при холере, кишечной непроходимости, перетоните. б) при деградации серосодержащих аминокислот образуются такие токсичные вещества как сероводород (Н2S), метил-(СН3SН) и этил-(СН3СН2SН) меркаптаны. в) при укорочении боковых цепей ароматических аминокислот, таких как тирозин, образуются ядовитые крезол и фенол, которые поступают в портальную вену с кровью - в печень, где происходит их обезвреживание путём взаимодействия с УДФГК (активной формой глюкуроновой кислоты) с образованием фенолглюкуронидов, менее токсичных и хорошо растворимых, которые и выводятся с мочой. При деградации аминокислоты триптофан образуются токсичные скатол и индол, которые, поступая в печень с портальной кровью, вначале окисляются с помощью микросомального окисления до индоксила, а затем обезвреживаются путём взаимодействия с ФАФС (фосфоаденозинфософосульфат - активная форма серной кислоты), образуя индоксилсерную кислоту, которая поступает в кровь, где нейтрализуется, образуя К или Nа соль индоксилсерной кислоты, называемую “живой индикан”. Количество животного индикана в крови является клинико-диагнозтическим тестом, характеризующим уровень гниения в кишечнике, обезвреживающую функцию печени и выделительную функцию почек. Информацию об обезвреживающей функции печени даёт и так называемая проба Квика, когда испытуемому дают выпить 4 г. бензойной кислоты, которая в печени взаимодействует с глицерином, образуя гиппуровую кислоту, выводимую с мочой, где её и определяют и количественно оценивают взвешиванием.
Пути превращений аминокислот в тканях
Основная масса - 95% аминокислот, образовавшихся в кишечнике, всасываются через стенку кишечника в кровь. Современные представления не позволяют точно охарактеризовать молекулярный механизм транспорта аминокислот, но можно предполагать, что он осуществляется с помощью специальных транспортных систем для аминокислот, что процесс является активным и требует необходимого градиента ионов Nа+, создаваемого N+, К+ -АТФ-азот мембраны эпителия кишечника. Но есть и другие разновидности транспорта аминокислот через клеточную мембрану, например -глютамильный цикл: перенос осуществляется с помощью специального фермента -глутамил-трансферазы, которая находится в мембране кишечного эпителия и других клеток. Кофактором этого фермента служит трипептид-глутатион. На первом этапе фермент осуществляет перенос -глутамильного остатка глутатиона на транспортируемую аминокислоту с образованием дипептида, который и проникает в клетку. Далее с помощью пяти внутриклеточных ферментов -глутамилтрансферазного цикла происходит освобождение из дипептида свободной аминокислоты и ресинтез затраченного на транпорт аминокислоты молекулы глутатиона.
Аминокислоты, всосавшиеся через стенку кишечника в результате переваривания белков, образовавшиеся в тканях под влиянием катепсинов и те заменимые аминокислоты, которые синтезировались в организме, все вместе составляют пул (фонд) аминокислот. Эти аминокислоты используются: на синтез специфичных белков и пептидов, синтез гормонов - производных аминокислот, на образование биогенных аминов, азотсодержащих небелковых веществ (креатин, гем, коферменты, нуклеотиды, синтез заменимых аминокислот, подвергаются специфическому метаболизму; излишек аминокислот, неиспользованных на пластические нужды организма может пойти на синтез из них углеводов и липидов путём глюконеогенеза; наконец, приблизительно 1/4 часть аминокислот может окисляться, служа источником энергии (особенно этот процесс усиливается при голодании, диабете). В сущности все эти пути использования аминокислот мы и должны будем рассмотреть в ближайшее время на лекциях, а начнём с окисления аминокислот в тканях.
Окисление аминокислот в тканях
Каждая аминокислота имеет свой метаболизм, именно сбои в спицефическом метаболизме реализуются в различных формах патологии (очень распространены энзимопатии, например фенилкетонурия, алкаптонурия и др.). Мы остановимся на рассмотрении общих путей метаболизма аминокислот. Окисление большинства аминокислот начинается с дезаминирования - окислительного дезаминирования (в природе существуют 4 типа: окислительное, восстановительное, внутримолекулярное, гидролитическое). Мы рассмотрим окислительное дезаминирование, суммарное уравнение которого:
NH3


 R - CH - COOH
R - C - COOH
R - CH - COOH
R - C - COOH
NH2 1\2 O2 O
в результате его аминокислота переходит в кетокислоту и выделяет аммиак. Осуществляют реакцию ферменты - оксидазы аминокислот, которые относятся к автоокисляемым флавопротеидам, т.е. коферменты их: ФМНН2 у аминокислот L-ряда и ФАДН2 у Д-ряда непосредственно окисляются молекулярным кислородом с образованием перекиси водорода, которая затем распадается с участием каталазы. Но надо обратить внимание, что природные, а ими являются L-аминокислоты имеют рН оптимум равный 10, в то время как в организме рН равен 7,4 в крови, а в тканях сдвинут ещё в более кислую сторону, т.е. в физиологических условиях эти ферменты малоактивны и практически не работают. Исключение составляет только одна аминокислота - глютаминовая, которая в физиологических условиях подвергается окислительному дезаминированию, но фермент, осуществляющий эту реакцию называется не оксидаза, а дегидрогеназа - глутаматдегидрогеназа и коферментом её является НАД или НАДФ, а не ФМН и ФАД. Фермент хорошо изучен, состоит из 6 субъединиц-олигомер и осуществляет реакцию только когда эти 6 субъединиц вместе, фермент регулярный: его аллостерическими ингибиторами являются АТФ, ГТФ, НАДН2, активатором АДФ. Реакция называется - прямое окислительное декарбоксилирование глютаминовой кислоты и протекает в два этапа, где на первом происходит дегидрирование глютаминовой кислоты с восстановлением НАДН2 и образованием аминокислоты, которая затем спонтанно при участии молекулы воды превращается в кетокислоты и освобождается аммиак. Правомерным становится вопрос: каким же образом подвергаются окислительному декарбоксилимированию другие аминокислоты? Чтобы ответить на него мы должны рассмотреть ещё одну группу реакций, которым подвергаются аминокислоты.
Трансаминирование аминокислот (переаминирование)
Большой вклад в изучение трансаминирования аминокислот внесли советские учёные Браунштейн и Крицман, открывшие их в 1937 году.
Трансаминирование или переаминирование - это реакции межмолекулярного переноса аминогруппы аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты. Осуществляют этот перенос ферменты - аминотрансферазы, сложные ферменты, коферментами которых служат производные витамина В6 - пиридоксаль-5 фосфат и пиридоксамин-5 фосфат. Оба в ходе реакции в активном центре фермента обратимо переходят друг в друга (реакция протекает с образованием промежуточных продуктов - шиффовых оснований). Таким образом обязательными участниками реакций трансаминирования являются аминокислота и кетокислота. Чаще всего в реакциях принимают участие три кетокислоты: пировиноградная, оксалоацетат и -кетоглутарат. Если мы напишем парциальные реакции с их участием, то увидим, что благодаря им аминогруппы большинства аминокислот оказываются в составе трёх аминокислот: аланина, аспарагиновой и глутаминовой кислот. Аминотрансферазы чрезвычайно широко распространены в природе, их насчитывают около пятидесяти, но наиболее активны и изучены две: аланин- и аспартатаминотрансферазы. Участником обоих является -кетоглутарат и аминогруппы аланина и аспаргиновой кислоты. Т.о. эти пять реакций показывают, что коллектором аминогрупп всех аминокислот является -кетоглутарат и образуется глутаминовая кислота, единственная подвергающаяся прямому окислительному дезаминированию. Объединение этих двух процессов и даёт путь окислению всех остальных аминокислот. Этот путь называется непрямое окислительное декарбоксилирование или трансдезаминирование, которое состоит из двух этапов: I этап - трансаминирование аминокислоты с выходом на глуталиновую кислоту; II этап - прямое окислительное дезаминирование глутаминовой кислоты, что может быть выражено схемой:


 АК
-кетоглутаровая
НАДН2
АК
-кетоглутаровая
НАДН2
 кислота
NH3
кислота
NH3
H2O
-кетокислота глютаминовая НАД
кислота
Т.о. на первом этапе из аминокислоты образуется -кетокислота, а на втором этапе образуется второй продукт окислительного дезаминирования - аммиак.
Аспартат и аланинаминотрансферазы кроме своего значения в осуществлении реакции непрямого окислительного дезаминирования имеют и клинико-диагностическое значение. Активность их определяют при диагностике таких патологий как вирусный гепатит (при нём в большей степени возрастает АлАТ) и инфаркт миокарда (в большей степени возрастает АсАТ). При диагностике инфаркта определяют и изоферменты АсАТ - их два: цитозольная и митохондриальная, появление в кровяном русле митохондриальной АсАТ - плохой диагностический признак.
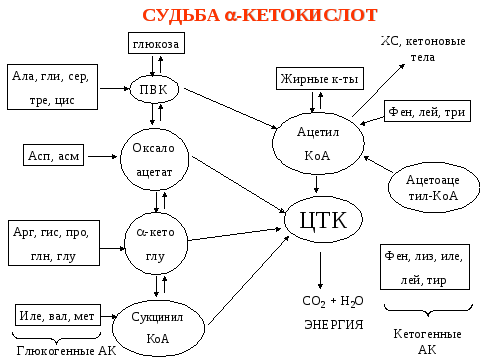
Использование углеродного скелета -кетокислот
В результате окислительного декарбоксилирования аминокислоты превращаются в кетокислоты. Что же происходит с ними дальше? Это можно продемонстрировать схемой, где видно, что -кетокислоты или прямо вступают в цикл Кребса (ЩУК-оксалоацетат, -кетоглугарат) или через ряд специфических превращений (у каждой свои) превращаются в метаболиты цикла Кребса.