
ВОЕННО-МЕДИЦИНСКАЯ АКАДЕМИЯ
Экз №__
Кафедра клинической биохимии и лабораторной диагностики
«УТВЕРЖДАЮ»
ИО начальника кафедры
клинической биохимии и
лабораторной диагностики
полковник медицинской службы
В.ПАСТУШЕНКОВ
«___» _____________ 2008 г.
доцент кафедры клинической биохимии и лабораторной диагностики
кандидат медицинских наук доцент Р.ГРАШИН
_____________________________________________________________________
должность, ученая степень, ученое звание, воинское звание, инициал имени, фамилия автора (авторов)
ЛЕКЦИЯ № 15
_________________________________________
(номер по тематическому плану изучения дисциплины)
по дисциплине: «Биохимия»
___________________________________________________________
(наименование учебной дисциплины)
на тему: «Обмен белков и аминокислот №2»
________________________________________________
(наименование темы занятий по тематическому плану изучения дисциплины)
с курсантами и студентами 2 курса факультетов подготовки врачей
(военно-медицинских специалистов иностранных армий)
Обсуждена и одобрена на заседании кафедры
«____» ____________ 200___ г.
Протокол №______
Уточнено (дополнено):
«____» ____________ 200___ г.
_____________________________________
(воинское звание, подпись, инициал имени, фамилия)
Цель лекции: продолжить рассмотрение вопросов обмена простых белков. Рассмотреть метаболические превращения аминокислот в тканях, в результате которых происходит синтез биогенных аминов, креатина, мочевины, аминогексоз, заменимых аминокислот, возможность образования из аминокислот глюкозы, липидов, энергии. Остановиться на конечных продуктах белкового обмена, на путях обезвреживания аммиака в организме и его выведении. Аммониогенез.
Вопросы лекции
1. Декарбоксилирование аминокислот.
2. Обезвреживание биогенных аминов.
3. Пути превращений и обезвреживания аммиака.
4.Биосинтез заменимых аминокислот. Синтез небелковых азотсодержащих соединений.
4. Орнитиновый цикл мочеобразования.
5. Синтез креатина и креатинина. Клинико-диагностическое значение.
6. Аммониогенез.
Заключение.
Время лекции – 2 часа
Литература
а) использованная при подготовке лекции:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. -М. Медицина 1990, сс. 318-368
2. Ленинджер А. Основы биохимии. М., Мир, 1985, т.2, сс. 571-597
3. Марри Р., Треннер Д. и др. Биохимия человека. М., Мир, сс. 167-168,306-319,
б) рекомендуемая курсантам и слушателям для подготовки к занятию:
1. Березов т.Т., Коровкин б.Ф. Биологическая химия. -м. Медицина 1990, сс. 345-354, 357-359, 364-368
ТЕХНИЧЕСКИЕ СРЕДСТВА ОБУЧЕНИЯ
-
Кодоскоп
-
Компьютер, программное и мультимедийное обеспечение
Декарбоксилирование аминокислот
(образование и инактивация биологически активных аминов).
Кроме процессов дезаминирования, трансаминирования, аминокислоты подвергаются и процессу декарбоксилирования. Декарбоксилирование аминокислот осуществляется специфическими ферментами - декарбоксилазами аминокислот. Это сложные ферменты, коферментом которых (так же как и аминотрансфераза) является пиридоксальфосфат, катализируют необратимые реакции декарбоксилирования аминокислот через образование промежуточных соединений - шиффовых оснований (подобно аминотрансферазам). Суммарное уравнение декарбоксилирования аминокислоты можно выразить следующим образом:
декарбоксилаза
R -CH-COOH
R-CH-NH2+CO2
-CH-COOH
R-CH-NH2+CO2
 ПФ
ПФ
NH2
Амины, образующиеся при этом в некоторых тканях из ряда (не всех) аминокислот, обладают сильным фармакологическим действием на множество физиологических функций человека и животных и называются биогенными аминами. К этой группе соединений относится большинство медаиторов. Например: при декарбоксилировании в головном мозгу глутаминовой кислоты образуется гамма-аминомаслянная кислота (ГАМК).
C
 OOH
CH2NH2
OOH
CH2NH2
C


 HNH2
CO2
(CH2)2
HNH2
CO2
(CH2)2
( CH2)2
декарбоксилаза
СООН
CH2)2
декарбоксилаза
СООН
ПФ
СООН
ГАМК
глу
ГАМК - медиатор тормозных импульсов ЦНС, используется при лечении психических заболеваний, сопровождающихся возбуждением коры головного мозга (эпилепсия). Биогенные амины оказывают большое биологическое действие весьма малыми концентрациями. Накопление биогенных аминов может отрицательно сказаться на физиологическом статусе и вызвать ряд серьёзных нарушений в организме. Способом инактивации биогенных аминов является окислительное дезаминирование с участием ферментов - аминооксидаз, катализирующих реакцию по уравнению:
R -CH2-NH2+O2+H2O
R-CHO+NH3+H2O2
-CH2-NH2+O2+H2O
R-CHO+NH3+H2O2
аминооксидаза
Различают: моноаминоксидазы (МАО) и диаминооксидазы (ДАО). МАО, локализованные преимущественно в митохондриях, являются флавопротеидами - требуют ФАД, инактивируют первичные, вторичные и третичные амины. Такие ингибиторы МАО, как ипраниазид, гармин, паргилин нашли применение при лечении гипертонической болезни, депрессивных состояний, шизофрении и др. ДАО - локализованы в цитоплазме, имеют коферментом пиридоксальфосфат, требуют ионов меди, инактивируют гистамин, путресцин, кадаверин.
Образовавшиеся из биогенных аминов при окислительном дезаминировании альдегиды, далее окисляются до органических кислот, которые выводятся из организма.
О Н2О НАДН2 НАД
R

 - С R-СООН
- С R-СООН
 Н
альдегид
ДГ
органическая
Н
альдегид
ДГ
органическая
 кислота
кислота
например, инактивация ГАМК:


 О
СООН
О
СООН
C
 H2NH2
О2
C
H2NH2
О2
C
 ФАД
ФАДН2
Н2О2
Н
НАДН2 НАД
СН2
ФАД
ФАДН2
Н2О2
Н
НАДН2 НАД
СН2
цикл


 (СН2)2
(СН2)2
(СН2)2
(СН2)2
Кребса


 МАО
ДГ
СН2
МАО
ДГ
СН2
СООН Н2О NH3 СООН Н2О
СООН
ГАМК янтарный янтарная
полуальдегид кислота
При декарбоксилировании гистидина образуется гистамин:
СО2
N
 CH2-CH-COOH CH2-CH2NH2
CH2-CH-COOH CH2-CH2NH2

 декарбоксилаза
декарбоксилаза

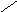
NH NH2
Гистамин широко распространён в тканях, особенно много его в тканях лёгких и в коже, имеется он в спинном мозге и подкорковых образованиях головного мозга. Большое количество гистамина образуется и депонируется в тучных клетках соединительной ткани, в которых он связан в виде белково-гепаринового комплекса. Большое количество гистамина образуется в слизистой желудка, где он действует на секрецию пепсина и соляной кислоты (в медицинской практике нашла распространение “гистаминовая проба”). Наибольшие количества гистамина всегда имеются в плазме крови и других биологических жидкостях. В больших количествах гистамин освобождается при патологических процессах, являясь медиатором аллергических реакций, которые, как известно, сопровождаются расширением капилляров, зудом и образованием пузырьков на коже, спазмом бронхов, усилением перистальтики кишечника и т.д. В клинике находят широкое применение антигистаминные препараты: димедрол, санорин, супрастин, тавегил и т.д. Инактивация гистамина происходит следующим образом:
 NH2
О
НАДН2
НАД
NH2
О
НАДН2
НАД
N







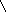 H2-CH2NH2
N CH2 - C
CH2-COOH
H2-CH2NH2
N CH2 - C
CH2-COOH



 N
ДАО
H ДГ
N
ДАО
H ДГ


NH NH NH
гистамин имидозолилуксусная
кислота
имидозолилуксусная кислота - конечный продукт, выводится с мочой (её определение в моче используется в клинической практике). Реакция декарбоксилирования лежит в основе образования такого биогенного амина как серотонин. Предшественником его является аминокислота триптофан, который в начале гидроксилируется под влиянием триптофанмонооксигеназы, превращаясь в 5-окситриптофан, а затем декарбоксилируется, образуя 5-окситриптомин или серотонин.

 Триптофан-
CO2
Триптофан-
CO2








 СН2-СН-СООН
НО- R
-СН2-СН-СООН НО-R
-СН2-СН2-NH2
СН2-СН-СООН
НО- R
-СН2-СН-СООН НО-R
-СН2-СН2-NH2
монооксигеназа


 NH2
NH2

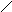 NH
NH
триптофан 5-окситриптофан 5-окситриптамин
(серотонин)
Серотонин оказывает сосудосуживающее действие, участвует в регуляции: артериального давления, температуры тела, дыхания, почечной фильтрации, является медиатором нервных процессов в ЦНС.
Из фенилаланина и тирозина образуются следующие биогенные амины: фенилатиламин, финилатаноламин, ДОФА, дофамин, норадреналин, адреналин.
Ф
 енилаланин
Тирозин
Диоксифенилаланин(ДОФА)
енилаланин
Тирозин
Диоксифенилаланин(ДОФА)
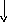
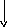
 Фенилаланин-
Тирозин 3’-моно-
Фенилаланин-
Тирозин 3’-моно-
онооксигеназа оксигеназа
Фенилэтиламин Тирамин Диоксифениламин(ДОФамин)
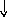

Фенилэтаноламин Норадреналин
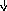
Адреналин
Главными, выполняющими медиаторные или гормональные функции являются адреналин и норадреналин. Обнаружены медиаторные свойства у дофамина и по-видимому, у тирамина. Инактивация патехоламинов осуществляется двумя путями: с помощью моноаминооксидазы и катехол-о-метил-трансферазы, т.е. путём дезаминирования и метилирования. В различных органах из аминокислоты-цистеин образуется биогенный амин-таурин.
N
 H2-CH-COOH
NH2-CH-COOH NH2-CH-COOH
H2-CH-COOH
NH2-CH-COOH NH2-CH-COOH



CH2SH CH2SO2H CH2SO3H
цистеин цистеинсульфоновая цистеиновая кислота
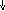 кислота
кислота
NH2-CH2-CH2-SO3H
таурин
В печени он используется в реакциях конъюгации с желчными кислотами, в нервной системе, очевидно, является медиатором в синапсах.
