
- •1. Взаимодействие фотонов оптического излучения с молекулами. Квантово-механические основы и последствия.
- •1.1. Основные характеристики оптического излучения
- •1.2. Основные квантово-механические механизмы взаимодействия оптического излучения с атомами и молекулами
- •1.3. Электронные переходы в атомах и молекулах при поглощении квантов оптического излучения.
- •2. Законы поглощения света веществом. Спектрофотометрический анализ. Особенности спектрофотометрии биологических объектов. Некоторые специальные методы спектрофотометрического анализа.
- •2.1. Количественное описание поглощения света растворами. Закон Бугера-Ламберта-Бера.
- •2.2. Условия выполнения закона Бугера-Ламберта-Бера.
- •2.3. Качественный и количественный спектрофотометрический анализ.
- •2.3.1. Качественный спектрофотометрический анализ.
- •2.3.2. Количественный спектрофотометрический анализ.
- •2.4. Некоторые специальные методы спектрофотометрии
- •2.5. Особенности спектрофотометрии биологических объектов
- •Оптические неоднородности
- •3. Вторичное излучение света молекулами объекта. Люминесцентный анализ и особенности его использования для исследования биологических объектов.
- •3.1. Явление фотолюминесценции
- •3.2. Электронные переходы в возбужденной молекуле. Законы люминесценции.
- •3.3. Зависимость интенсивности фотолюминесценции от концентрации люминесцирующих молекул. Люминесцентный анализ.
- •3.4. Методы регистрации фотолюминесценции. Спектрофлуориметры. Особенности флуориметрии биологических объектов.
- •3.5. Время жизни возбужденного состояния молекул. Связь между временем жизни возбужденных состояний и квантовым выходом фотолюминесценции.
- •3.6. Влияние окружения люминесцирующих молекул на параметры фотолюминесценции. Флуоресцентные зонды и метки.
- •3.7. Причины снижения интенсивности фотолюминесценции в биологических объектах. Тушение фотолюминесценции. Миграция энергии электронного возбуждения.
- •3.8. Поляризация фотолюминесценции.
- •3.9. Замедленная флуоресценция и фосфоресценция.
- •3.10. Хемилюминесценция биологических систем. Хемилюминесцентный анализ.
- •3.11. Проточная цитофлуориметрия.
- •3.12. Влияние размера люминесцирующей полупроводниковой частицы на ее свойства как люминофора. Квантовые точки.
- •В обычных полупроводниках радиус экситона Бора (ах) определяет размер областей электронного возбуждения.
- •Применение квантовых точек в качестве флуорофоров в медицине и биологии
- •Молекулярные сенсоры
- •Молекулярная диагностика
- •Гибридные молекулярные устройства
- •4.Биофизические основы некоторых фотобиологических процессов. Применение оптического излучения в медицине.
- •4.1. Общие закономерности фотохимических процессов в биомолекулах.
- •4.1.1. Кинетика однофотонных необратимых фотохимических реакций
- •4.1.2. Кинетика однофотонных обратимых фотохимических реакций
- •4.1.2. Кинетика многофотонных фотохимических реакций
- •4.2. Спектры действия фотопревращений молекул и фотобиологических процессов.
- •4.2.1 Спектры действия фотобиологических эффект при небольшой постоянной дозе облучения
- •4.2.2.Спектры действия при постоянной величине фотобиологического эффекта.
- •4.2.3.Спектры действия биологических ответов, зависящих от скорости фотопревращения активных молекул.
- •4.3. Фотомодификация олигомерных и однокомпонентных белков под действием ультрафиолетового излучения.
- •4.3.1. Естественное (солнечное) ультрафиолетовое излучение.
- •4.3.2. Кинетика фотоинактивации белковых молекул.
- •4.3.3. Природа первичных продуктов фотолиза аминокислот и их остатков в белках.
- •Значения для
- •4.4. Действие ультрафиолетового излучения на биологические мембраны.
- •4.5. Действие ультрафиолетового излучения на нуклеиновые кислоты.
3. Вторичное излучение света молекулами объекта. Люминесцентный анализ и особенности его использования для исследования биологических объектов.
3.1. Явление фотолюминесценции
Как указывалось в главе 1 этого раздела, поглощение кванта оптического излучения молекулой приводит к тому, что поглотивший данный квант электрон вынужден изменить свою орбиталь, и перейти с основного энергетического уровня на возбужденный, соответствующий новому значению энергии данного электрона (рис. 15). Молекулу, у которой имеется электрон на электронной орбитали с избыточной свободной энергией, принято называть возбужденной (а состояние, в котором она находится – возбужденным состоянием). Это возбужденное состояние термодинамически невыгодно для молекулы, поэтому вскоре она избавляется от полученной энергии тем или иным способом. Самым простым способом избавления от избыточной свободной энергии для молекул и атомов служит испускание кванта вторичного излучения. Явление испускания квантов оптического излучения веществом носит название люминесценция.
10-11
с
10-11
с
10-8
с
5
с
Рисунок 15. Электронные переходы в молекуле при поглощении света, флуоресценции и фосфоресценции на примере триптофана. Около возбужденных орбиталей (S1, S2, T) показано среднее время пребывания электрона на них в секундах.
Публикуется с модификациями по: Владимиров Ю.А., Проскурнина Е.В. Лекции по медицинской биофизике. М.: Из-во Московского университета, 2007, с. 62.
Если причиной вторичного излучения квантов (люминесценции) было предшествующее поглощение света, это – фотолюминесценция. Помимо света причиной люминесценции вещества может протекающая в нем химическая реакция (это хемилюминесценция), электрический ток (это – электролюминесценция), термическое воздействие (это – термолюминесценция), воздействие звука высокой частоты (это – сонолюминесценция) и даже механические воздействия (это – триболюминесценция).
С.И. Вавилов даёт следующее определение понятия «люминесценция»:
Люминесценцией тела в данной спектральной области называют избыток излучения над температурным при условии, что избыточное излучение обладает конечной длительностью, превышающей период световых колебаний.
3.2. Электронные переходы в возбужденной молекуле. Законы люминесценции.
В покоящемся (невозбужденном) свободная энергия молекул минимальна (рис. 15), и их электроны пребывают на нижнем колебательном подуровне основной электронной орбитали S0. Если в молекуле имеется система сопряженных двойных связей (как у большинства органических молекул), уровень S0 является синглетным, т.е. на нем находятся электроны с антипараллельными спинами. С ростом тепловой энергии молекул появляется вероятность самопроизвольного перехода электронов на возбужденные орбитали. Характер распределения электронов между электронными уровнями с энергиями Е1 и Е2 (Е1<Е2) описывается уравнением Больцмана:
(52)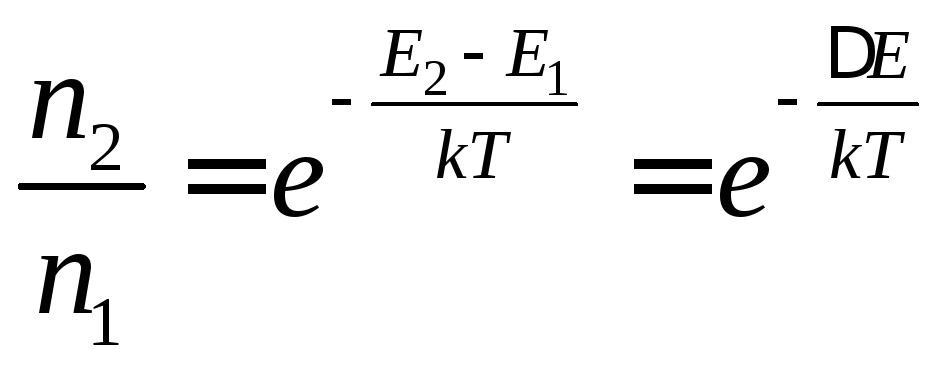
где n1 – количество электронов на уровне с энергией Е1, n2 – соответственно, количество электронов на уровне с энергией Е2, Т – абсолютная температура, а k – постоянная Больцмана.
Из выражения (52) вытекает, что при комнатной температуре (порядка 300о К) тепловая энергия электронов в молекулах относительно мала, и даже на высшие тепловые электронные колебательные подуровни основной орбитали (S0) в сложных органических молекулах попадает менее 2% -электронов.
Переход электронов между основным энергетическим уровнем S0 и возбужденными состояниями S1 или S2 при поглощении квантов с соответствующей энергией осуществляется очень быстро и занимает не более 10-15 секунды. В течение последующего времени (порядка 10-11 секунды) устанавливается тепловое равновесие между возбужденной молекулой и окружающей средой. При этом часть энергии электрона растрачивается в тепло, и он оказывается на нижнем колебательном тепловом подуровне возбужденного уровня S1. Если молекула способна к люминесценции (вероятность возвращения электрона на уровень S0 с испусканием кванта света велика, см. ниже), электрон может пребывать на орбитали S1 достаточно долго, порядка 10-9-10-8 секунды. Если энергия электрона в течение этого времени не растрачена иным образом, происходит переход S1 S0 с испусканием кванта фотолюминесценции (в описанной ситуации – флуоресценции, рис. 15). Такой электронный переход называется излучательным. Однако в большинстве случаев энергия электрона в молекуле, находящейся в возбужденном состоянии, растрачивается в тепло, и переход S1 S0 испусканием кванта не сопровождается. Такие электронные переходы называются безизлучательными. Вместе с тем, как уже упоминалось выше (параграф 1.3 главы 1, рис. 1), часть электронов на возбужденной орбитали S1 может изменить спин и перейти на триплетный уровень Т1 (рис. 15), энергия которого у большинства молекул меньше энергии орбитали S1. Для того, чтобы попасть с этого уровня на основную орбиталь S0, электрон должен изменить спин повторно. Поскольку это требует определенной затраты энергии, данное событие маловероятно. Поэтому на орбитали Т1 (рис. 15) электрон может пребывать очень долго (до нескольких секунд). При обычных температурах (порядка 300оК) и в жидких растворах за это время электрон на орбитали Т1 теряет энергию безизлучательно, и переход Т1 S0 испусканием квантов не сопровождается. Если же температура низка (77оК и меньше), значимая часть электронов совершает переход Т1 S0 с испусканием кванта излучения. Такой вариант фотолюминесценции носит название фосфоресценция (рис. 15).
В спектральном анализе в эксперименте чаще всего регистрируются зависимость интенсивности (потока) фотолюминесценции образца от длины волны регистрации. Эта зависимость показывает, из квантов с какой энергией (длиной волны, частотой или волновым числом) состоит вторичное излучение данного вещества. Называется такая зависимость спектром фотолюминесценции. Если вторичное свечение является по своей природе флуоресценцией, регистрируемая кривая ее распределения по длинам волн (Jфл=f() или Ффл=f()) называется спектром флуоресценции, а если регистрируемое вторичное свечение – фосфоресценция, то спектром фосфоресценции.
Существует ряд эмпирических закономерностей, касающихся вида спектров фотолюминесценции. Причины существования этих закономерностей очевидны, если помнить те электронные переходы в молекулах, которые обеспечивают высвечивание квантов вторичного излучения. Рассмотрим эти закономерности.
Закон Стокса
Этот закон формулируется следующим образом:
Спектр фотолюминесценции смещен в длинноволновую область по сравнению со спектром поглощения того же соединения.
Поскольку за время пребывания молекулы в возбужденном состоянии после поглощения кванта электроны на энергонасыщенных орбиталях растрачивают часть энергии в тепло, излучательные межорбитальные электронные переходы приводят к испусканию кванта с меньшей энергией, чем у того фотона, который был изначально поглощён (см. рис. 1 и рис. 15). Это объясняет смещение спектра фотолюминесценции в длинноволновую сторону (т.е. в область квантов с меньшей энергией) в сравнении со спектром поглощения. Экспериментальное проявление закона Стокса можно увидеть на рис. 16.
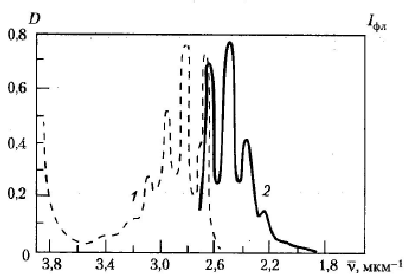
Рисунок 16. Спектры поглощения (1) и флуоресценции (2) раствора антрацена в этаноле (1 мкг/мл). По оси абсцисс – частота излучения.
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 37.
Правило Каши
Вид спектра фотолюминесценции не зависит от длины волны возбуждающего излучения.
Это правило связано с тем, излучательный переход всегда происходит с нижней возбужденной орбитали молекулы, вне зависимости от того, на какую орбиталь попал электрон после поглощения возбуждающего фотона. Более того, вид спектра люминесценции вообще не зависит от способа возбуждения электронов, поэтому, если исследуемое соединение способно, например, к электролюминесценции, то и эта люминесценция в данных условиях будет иметь тот же спектр, что и фотолюминесценция данного вещества.
Закон Стокса и правило Каши имеют большое практическое значение при проведении спектрофлуориметрических измерений. Например, вследствие закона Стокса для возбуждения фотолюминесценции можно применять излучение с коротковолновой границы области поглощения изучаемого вещества. Такие кванты будут иметь длину волны меньше, чем самые коротковолновые кванты фотолюминесценции. Поэтому их можно устранить из регистрируемого светового сигнала с помощью светофильтров или монохроматоров, и они не будут мешать правильной регистрации вторичного свечения. Правило же Каши делает возможным подбор такой длины волны возбуждающего света, который будет возбуждать молекулы только определенного типа. Соответственно, и люминесцировать будут только эти молекулы, причем вид спектра их люминесценции останется типичным. Это бывает особенно важно при исследовании биологических объектов, отличающихся сложным химическим составом и часто содержащих более одного типа способных к фотолюминесценции соединений.
Правило Левшина (правило зеркальной симметрии)
Спектр флуоресценции при построении в шкале частот или энергии квантов по форме зеркально симметричен длинноволновой полосе поглощения люминесцирующих молекул.
Хорошей иллюстрацией этого правила служат спектры поглощения и флуоресценции этанольного раствора антрацена, приведенные на рис. 16. Причиной же его выполнения служит тот факт, что структуры тепловых колебательных подуровней у основной и нижней возбужденной электронных орбиталей близки. Мало меняется при электронном возбуждении и геометрия молекулы. Поэтому мало отличаются и вероятности межподуровневых переходом в основном и возбужденном состояниях. Можно показать, что это приводит к зеркальной симметричности спектров поглощения и фотолюминесценции. Впрочем, на самом деле структура электронных колебательных подуровней у возбужденной орбитали все-таки несколько иная, чем у основной. Поэтому правило Левшина на практике достаточно часто нарушается.
Закон Вавилова
Квантовый выход фотолюминесценции не зависит от длины волны возбуждающего излучения.
Определение 16:
Квантовым выходом фотолюминесценции называется отношение числа квантов фотолюминесценции к числу поглощенных люминесцирующими молекулами квантов возбуждающего излучения.
Иными словами, квантовый выход фотолюминесценции отражает вероятность того, что молекула данного вещества в данных условиях реализует полученную от поглощенного кванта энергию путем фотолюминесценции. Как и всякая другая вероятность, квантовый выход фотолюминесценции (далее будем обозначать его q) может иметь величину от 0 до 1.
Справедливость закона Вавилова вытекает из следующего. Если квант возбуждающего излучения был поглощен, он обязательно приведет к появлению молекулы в возбужденном состоянии. Часть этих молекул потеряет приобретенную энергию безызлучательно, часть – путем испускания квантов вторичного свечения. Очевидно, что вероятность излучательного перехода в данных, конкретных, условиях, не зависит от того, каким образом электрон попал на возбужденную орбиталь.
