- •1. Взаимодействие фотонов оптического излучения с молекулами. Квантово-механические основы и последствия.
- •1.1. Основные характеристики оптического излучения
- •1.2. Основные квантово-механические механизмы взаимодействия оптического излучения с атомами и молекулами
- •1.3. Электронные переходы в атомах и молекулах при поглощении квантов оптического излучения.
- •2. Законы поглощения света веществом. Спектрофотометрический анализ. Особенности спектрофотометрии биологических объектов. Некоторые специальные методы спектрофотометрического анализа.
- •2.1. Количественное описание поглощения света растворами. Закон Бугера-Ламберта-Бера.
- •2.2. Условия выполнения закона Бугера-Ламберта-Бера.
- •2.3. Качественный и количественный спектрофотометрический анализ.
- •2.3.1. Качественный спектрофотометрический анализ.
- •2.3.2. Количественный спектрофотометрический анализ.
- •2.4. Некоторые специальные методы спектрофотометрии
- •2.5. Особенности спектрофотометрии биологических объектов
- •Оптические неоднородности
- •3. Вторичное излучение света молекулами объекта. Люминесцентный анализ и особенности его использования для исследования биологических объектов.
- •3.1. Явление фотолюминесценции
- •3.2. Электронные переходы в возбужденной молекуле. Законы люминесценции.
- •3.3. Зависимость интенсивности фотолюминесценции от концентрации люминесцирующих молекул. Люминесцентный анализ.
- •3.4. Методы регистрации фотолюминесценции. Спектрофлуориметры. Особенности флуориметрии биологических объектов.
- •3.5. Время жизни возбужденного состояния молекул. Связь между временем жизни возбужденных состояний и квантовым выходом фотолюминесценции.
- •3.6. Влияние окружения люминесцирующих молекул на параметры фотолюминесценции. Флуоресцентные зонды и метки.
- •3.7. Причины снижения интенсивности фотолюминесценции в биологических объектах. Тушение фотолюминесценции. Миграция энергии электронного возбуждения.
- •3.8. Поляризация фотолюминесценции.
- •3.9. Замедленная флуоресценция и фосфоресценция.
- •3.10. Хемилюминесценция биологических систем. Хемилюминесцентный анализ.
- •3.11. Проточная цитофлуориметрия.
- •3.12. Влияние размера люминесцирующей полупроводниковой частицы на ее свойства как люминофора. Квантовые точки.
- •В обычных полупроводниках радиус экситона Бора (ах) определяет размер областей электронного возбуждения.
- •Применение квантовых точек в качестве флуорофоров в медицине и биологии
- •Молекулярные сенсоры
- •Молекулярная диагностика
- •Гибридные молекулярные устройства
- •4.Биофизические основы некоторых фотобиологических процессов. Применение оптического излучения в медицине.
- •4.1. Общие закономерности фотохимических процессов в биомолекулах.
- •4.1.1. Кинетика однофотонных необратимых фотохимических реакций
- •4.1.2. Кинетика однофотонных обратимых фотохимических реакций
- •4.1.2. Кинетика многофотонных фотохимических реакций
- •4.2. Спектры действия фотопревращений молекул и фотобиологических процессов.
- •4.2.1 Спектры действия фотобиологических эффект при небольшой постоянной дозе облучения
- •4.2.2.Спектры действия при постоянной величине фотобиологического эффекта.
- •4.2.3.Спектры действия биологических ответов, зависящих от скорости фотопревращения активных молекул.
- •4.3. Фотомодификация олигомерных и однокомпонентных белков под действием ультрафиолетового излучения.
- •4.3.1. Естественное (солнечное) ультрафиолетовое излучение.
- •4.3.2. Кинетика фотоинактивации белковых молекул.
- •4.3.3. Природа первичных продуктов фотолиза аминокислот и их остатков в белках.
- •Значения для
- •4.4. Действие ультрафиолетового излучения на биологические мембраны.
- •4.5. Действие ультрафиолетового излучения на нуклеиновые кислоты.
4.3.2. Кинетика фотоинактивации белковых молекул.
Воздействие УФ излучения на белковые молекулы чаще всего приводит к их денатурации и утрате ими физиологических функций. Лишь в редких случаях воздействие излучения сопровождается стимуляцией активности белков. Примерами белков, подверженных такой активации, могут быть супероксиддисмутаза, карбоксипептидаза А, гемоглобин.
Но наиболее часто встречающийся и наиболее хорошо исследованный результат воздействия УФ излучения на молекулы протеинов – их фотоинактивация. Для однокомпонентных белков фотоинактивация протекает, как правило, по однофотонному (одноударному) механизму. Дозовая зависимость такого процесса носит экспоненциальный характер и может быть описана формулой:
(137)![]()
В этом выражении N – концентрация активных молекул белка в образце (выраженная в числе молекул в 1 мл) после облучения, N0 – их концентрация до воздействия излучения, - поперечное сечение фотоинактивации данного протеина (равное произведению поперечного сечения поглощения его молекул на квантовый выход фотоинактивации ), E – доза облучения образца, выраженная в числе квантов.
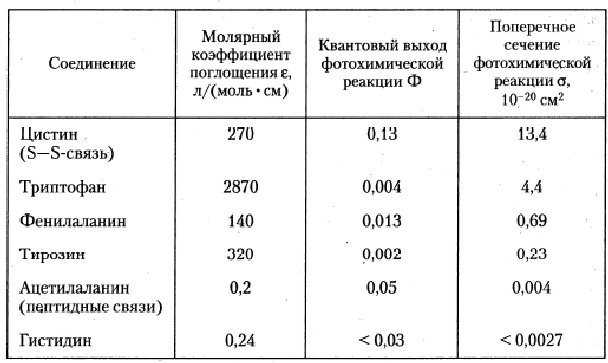
Величины квантовых выходов фотоинактивации у большинства белковых молекул относительно невелики ( =0,00050,05). Конкретное значение этого показателя определяется типом инактивируемого протеина.
Фотоинактивация белков является следствием фотохимического разрушения аминокислотных остатков в их полипептидных цепях. Наибольшее значение для фотоинактивации белков имеет фотолиз остатков цистина, триптофана и тирозина. Для разрушения каждого из указанных аминокислотных остатков достаточно поглощения им одного фотона излучения.
Рассматривая процесс фотоинактивации какого-либо протеина следует иметь в виду следующее:
у разных молекул протеина инактивация может быть вызвана фотолизом разных аминокислотных остатков;
фотолиз некоторых аминокислотных остатков в протеине не приводит к его инактивации.
Те аминокислотные остатки в молекуле белка, фотохимическое разрушение которых приводит к утрате белковой молекулой функциональной активности, принято называть существенными для фотоинактивации данного протеина.
Обозначим количество существенных для фотоинактивации аминокислотных остатков в исследуемом белке как n. Понятно, что величина n может быть от 0 до m (общего числа аминокислотных остатков в полипептидной цепи данного белка). Количественно кинетика фотолиза i-го существенного аминокислотного остатка в нативном белке (при небольшой оптической плотности облучаемого образца) описывается выражением:
(138)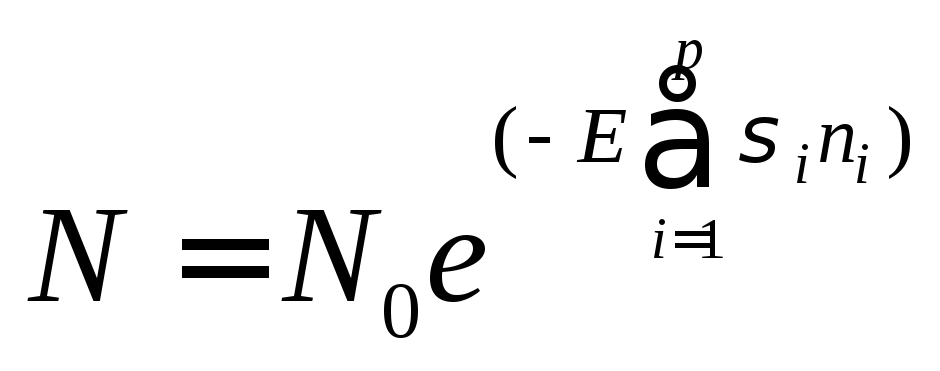
При этом суммарное поперечное сечение фотоинактивации белка будет связана с i для i-го существенного аминокислотного следующим образом:
(139)
При облучении белка излучением с длинами волн свыше 240 нм, где отсутствует поглощение у пептидных связей и алифатических аминокислотных остатков, фотоинактивация протеина будет связана с фоторазрушением остатков цистина (точнее, S-S групп), тирозина и триптофана. Поэтому уравнение (139) может быть переписано в следующем виде:
(140)![]()
Суммарное поперечное сечение фотоинактивации исследуемого белка можно определить из дозовой зависимости этого процесса. Из соответствующих дозовых зависимостей можно определить также величины ц, тир и трп. Поскольку фотоинактивация протеина происходит вследствие фотолиза только существенных аминокислотных остатков, далее интересно бывает определить величины nц, nтир и nтрп. Для этого исследуется фотоинактивация белка при облучении таким монохроматическим излучением, поглощение которого остатками цистина, тирозина и триптофана максимально различается. Например, можно последовательно исследовать фотоинактивацию протеина при действии на него УФ излучением с длинами волны 254, 280 и 289 нм. Для всех трех длин волн действующего излучения определяются , ц, тир и трп. Зная эти величины, можно написать следующую систему уравнений:
(141)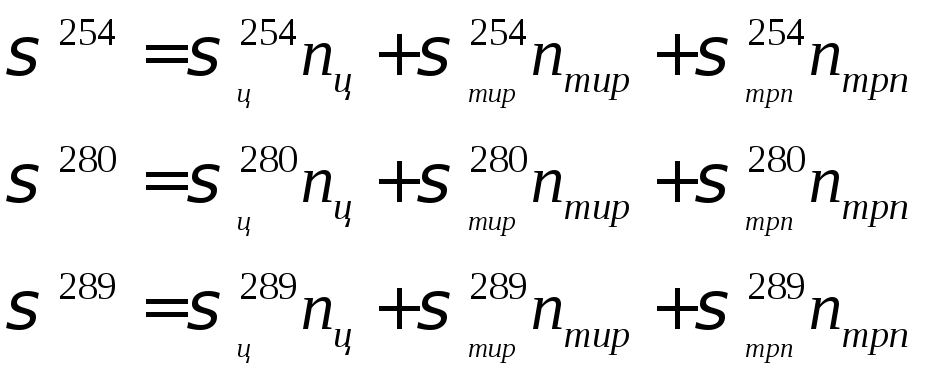
В системе уравнений (141) неизвестны только nц, nтир и nтрп. Соответственно, имеется однозначное решение, и искомые величины nц, nтир и nтрп могут быть определены. С помощью подобного приема были установлены следующие интересные факты:
для фотоинактивации пепсина достаточно разрушить в нем один остаток триптофана;
для фотоинактивации трипсина достаточно вызвать фотолиз одной S-S-связи из 6 имеющихся в молекуле этого белка, и одного триптофанового остатка из 4.
Из сказанного выше вытекает, что значимость в процессе фотоинактивации белков разных аминокислотных остатков меняется в зависимости от спектрального состава действующего на протеин УФ излучения. При действии излучения с >285 нм основной вклад в фотоинактивацию вносят остатки триптофана и тирозина, тогда как при действии на белок более коротковолнового излучения возрастает роль фотолиза цистиновых остатков (S-S-связей). Значения молярных коэффициентов поглощения, квантовых выходов и поперечного сечения их фотолиза для ряда аминокислот приведены в табл. 4.
Таблица 4. Фотохимическая чувствительность аминокислот при действии УФ излучения с длиной волны 254 нм.
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 126.