
- •1. Взаимодействие фотонов оптического излучения с молекулами. Квантово-механические основы и последствия.
- •1.1. Основные характеристики оптического излучения
- •1.2. Основные квантово-механические механизмы взаимодействия оптического излучения с атомами и молекулами
- •1.3. Электронные переходы в атомах и молекулах при поглощении квантов оптического излучения.
- •2. Законы поглощения света веществом. Спектрофотометрический анализ. Особенности спектрофотометрии биологических объектов. Некоторые специальные методы спектрофотометрического анализа.
- •2.1. Количественное описание поглощения света растворами. Закон Бугера-Ламберта-Бера.
- •2.2. Условия выполнения закона Бугера-Ламберта-Бера.
- •2.3. Качественный и количественный спектрофотометрический анализ.
- •2.3.1. Качественный спектрофотометрический анализ.
- •2.3.2. Количественный спектрофотометрический анализ.
- •2.4. Некоторые специальные методы спектрофотометрии
- •2.5. Особенности спектрофотометрии биологических объектов
- •Оптические неоднородности
- •3. Вторичное излучение света молекулами объекта. Люминесцентный анализ и особенности его использования для исследования биологических объектов.
- •3.1. Явление фотолюминесценции
- •3.2. Электронные переходы в возбужденной молекуле. Законы люминесценции.
- •3.3. Зависимость интенсивности фотолюминесценции от концентрации люминесцирующих молекул. Люминесцентный анализ.
- •3.4. Методы регистрации фотолюминесценции. Спектрофлуориметры. Особенности флуориметрии биологических объектов.
- •3.5. Время жизни возбужденного состояния молекул. Связь между временем жизни возбужденных состояний и квантовым выходом фотолюминесценции.
- •3.6. Влияние окружения люминесцирующих молекул на параметры фотолюминесценции. Флуоресцентные зонды и метки.
- •3.7. Причины снижения интенсивности фотолюминесценции в биологических объектах. Тушение фотолюминесценции. Миграция энергии электронного возбуждения.
- •3.8. Поляризация фотолюминесценции.
- •3.9. Замедленная флуоресценция и фосфоресценция.
- •3.10. Хемилюминесценция биологических систем. Хемилюминесцентный анализ.
- •3.11. Проточная цитофлуориметрия.
- •3.12. Влияние размера люминесцирующей полупроводниковой частицы на ее свойства как люминофора. Квантовые точки.
- •В обычных полупроводниках радиус экситона Бора (ах) определяет размер областей электронного возбуждения.
- •Применение квантовых точек в качестве флуорофоров в медицине и биологии
- •Молекулярные сенсоры
- •Молекулярная диагностика
- •Гибридные молекулярные устройства
- •4.Биофизические основы некоторых фотобиологических процессов. Применение оптического излучения в медицине.
- •4.1. Общие закономерности фотохимических процессов в биомолекулах.
- •4.1.1. Кинетика однофотонных необратимых фотохимических реакций
- •4.1.2. Кинетика однофотонных обратимых фотохимических реакций
- •4.1.2. Кинетика многофотонных фотохимических реакций
- •4.2. Спектры действия фотопревращений молекул и фотобиологических процессов.
- •4.2.1 Спектры действия фотобиологических эффект при небольшой постоянной дозе облучения
- •4.2.2.Спектры действия при постоянной величине фотобиологического эффекта.
- •4.2.3.Спектры действия биологических ответов, зависящих от скорости фотопревращения активных молекул.
- •4.3. Фотомодификация олигомерных и однокомпонентных белков под действием ультрафиолетового излучения.
- •4.3.1. Естественное (солнечное) ультрафиолетовое излучение.
- •4.3.2. Кинетика фотоинактивации белковых молекул.
- •4.3.3. Природа первичных продуктов фотолиза аминокислот и их остатков в белках.
- •Значения для
- •4.4. Действие ультрафиолетового излучения на биологические мембраны.
- •4.5. Действие ультрафиолетового излучения на нуклеиновые кислоты.
1.2. Основные квантово-механические механизмы взаимодействия оптического излучения с атомами и молекулами
Внутренняя энергия атомов и молекул складывается из энергии электронов, находящихся в электростатическом взаимодействии с ядрами, энергии колебания самих ядер относительно друг друга и энергии вращения молекулы (атома) как целого.
Поскольку электрон может рассматриваться не только как частица, но и как волна, для расчета его энергии в молекулах может применяться уравнение Шредингера, количественно описывающее свойства стоячих волн в модели так называемого потенциального ящика. Заметим, что данное уравнение постулировано, а не выведено. Однако в настоящее время многочисленные экспериментальные данные позволяют считать его верным.
В упрощенном виде для стационарного случая уравнение Шредингера выглядит следующим образом:
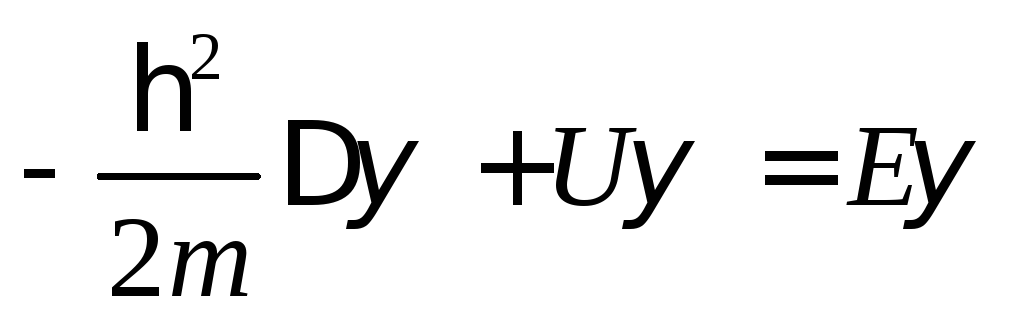 …(7)
…(7)
После замены
![]() на
h
(h
= 2
на
h
(h
= 2![]() )
получим:
)
получим:
 (8)
(8)
В уравнении (8) - так называемая волновая функция (пси-функция), описывающая электромагнитные возмущения в системе; - оператор Лапласа, представляющий собой сумму вторых частных производных от стоящей за ним величины по всем 3 пространственным направлениям. Иными словами:
 (9)
(9)
Е – полная, а U – потенциальная энергии частицы, m – её масса (электрон, в отличие от фотона, обладает массой покоя).
Уравнение Шредингера является дифференциальным уравнением второго порядка, решение которых не всегда возможно и является сложной математической задачей. Тем не менее, известны решения этого уравнения для одномерного случая (электронные волны в потенциальном ящике одномерны) и для атома водорода. Мы приведем здесь только одно решение – для модели одномерного потенциального ящика:
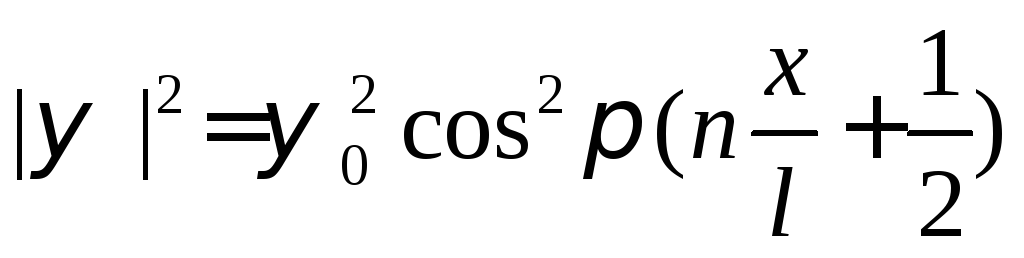 (10)
(10)
Квадрат модуля волновой функции ||2 соответствует вероятности пребывания электрона в данной точке (или вблизи нее), величина 0 – амплитуда изменения волновой функции, l – длина (размер) потенциального ящика, а n принято называть главным квантовым числом. Оно принимает только целочисленные значения – 1, 2, 3 и т.д. Из полученного решения (уравнение (10)) вытекает, что из-за своих волновых свойств электроны обязаны пребывать на определенных орбиталях (уровнях), соответствующих местам формирования стоячих волн в молекуле (рассматриваемой как «потенциальный ящик») вследствие интерференции. Каждой такой орбитали (уровню) соответствует определенное значение энергии электрона, пропорциональное n2:
 (11)
(11)
где Ее – энергия электрона, а m – его масса.
Что касается расчета распределения электронных плотностей в реальных атомах, то из-за своей сложности, как уже указывалось выше, он был произведен только для атома водорода. Для более крупных атомов или многоатомных молекул расчет затруднен в связи с тем, что в трехмерном пространстве стоячие электронные волны будут формироваться в трех измерениях, и для их характеристики требуются, как минимум, три квантовых числа. Тем читателям, которые хотят более подробно ознакомиться с квантово-механическими принципами расчетов электронных орбиталей, можно рекомендовать обратиться к специальным учебникам по квантовой химии и физике.
На основании приведенных выше квантово-механических уравнений можно сделать следующие заключения:
Электроны в покоящихся стабильных атомах и молекулах пребывают на определенных электронных орбиталях, каждая из которых соответствует конкретному набору квантовых чисел.
Изменение энергии электрона в составе атома или молекулы неизбежно должно привести к изменению его орбитали (энергетического уровня).
Переход электрона при изменении его энергии происходит только дискретно (квантовано), т.е. с одной орбитали на другую.
Межорбитальный переход электрона становится возможен только в тех случаях, когда энергия электрона меняется на величину, соответствующую различиям в энергии у ранее занимавшейся им орбитали и орбитали, на которую электрон переходит.
В каждом типе молекул имеется набор занятых и свободных электронных орбиталей (электронных уровней). Величина энергий, необходимых для электронных переходов между этими орбиталями, определяется структурой молекулы, вследствие чего для каждого типа молекул набор этих энергий уникален и может служить своеобразным «отпечатком пальца» этого соединения. Следует, впрочем, заметить, что обычно молекулы находятся в окружении других молекул (например, молекул растворителя) и взаимодействуют с ними тем или иным образом. Такое взаимодействие может повлиять на энергии занятых и свободных электронных орбиталей. Иногда это влияние бывает достаточно сильно.
Как следует из табл. 1, энергии квантов излучения, приходящегося на оптический спектральный диапазон, позволяют им взаимодействовать преимущественно с электронными оболочками атомов и молекул.
Электроны в молекулах принято разделять на три группы. Это:
n-электроны, не участвующие в образовании ковалентных межатомных связей в молекулах;
s-электроны, участвующие в образовании прочных одинарных -связей;
р-электроны, участвующие в образовании менее прочных, двойных или тройных -связей.
Указанные типы электронов в молекулах располагаются соответственно на n-; - и - молекулярных электронных орбиталях. Заметим, что электроны на - и - молекулярных орбиталях, формирующих ковалентные связи между составляющими молекулами атомами, обобщены и не являются «собственностью» какого-либо из атомных ядер данной молекулы.
Кванты излучения могут взаимодействовать с электронами любого типа, однако для возбуждения n- и s-электронов требуются значительные энергии, поэтому на них оказывают влияние только кванты с малой длиной волны (т.е. большой энергией), входящие в так называемый вакуумный ультрафиолетовый спектральный поддиапазон.
Следствием взаимодействия кванта с электроном является увеличение энергии последнего на величину, соответствующую энергии поглощенного кванта излучения. Из приводившихся выше квантово-механических моделей следует, что изменение энергии электрона с неизбежностью приводит к тому, что он оказывается вынужден изменить свою орбиталь в молекуле, заняв ту из них, которая соответствует новому значению его энергии (см уравнение (11)). Вместе с тем, для такого перехода электрону требуется совершенно определенная порция энергии, соответствующая разнице в этом показателе между «старой» и «новой» орбиталями (орбитали квантованы, каждая из них соответствует определенным значениям квантовых чисел, которые могут быть только целыми). Поэтому электроны молекул взаимодействуют не с любыми квантами, а только с теми из них, энергия которых удовлетворяет вышеуказанному требованию. Кванты же, не удовлетворяющие ему, взаимодействовать с электронами данной молекулы не будут.
На практике это означает, что взаимодействие квантов излучения оптического спектрального диапазона с молекулами будет различным у фотонов с разной длиной волны (частотой, волновым числом). Излучение с «подходящими» по энергии (или, что то же самое, по , v или ) квантами будет при прохождении через содержащий конкретные молекулы объект ослабляться сильно, а с «неподходящими» - слабо (может даже проходить через объект совсем без ослабления). Напомним, что у каждого типа молекул – свой набор электронных орбиталей, различающихся по энергиям, определяющийся структурой молекул данного типа. Поэтому каждый определенный тип молекул будет ослаблять излучения с определенными , v и . Это обстоятельство позволяет решать с помощью оценки ослабления образцом излучения с разными (v или ) качественные задачи, т.е. выявлять присутствие в объекте конкретных химических соединений.
Рассмотрим теперь, что происходит с электронами в молекулах после поглощения квантов электромагнитного излучения оптического спектрального диапазона.
