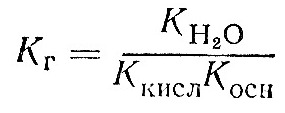- •Розділ 1. Основні поняття та закони хімії. Хімічний зв'язок. Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Будова атома
- •Сучасні уявлення про будову атома. *
- •Контрольні запитання:
- •Тема 1.3. Будова речовин
- •Основні положення атомно-молекулярного вчення.
- •Контрольні запитання:
- •Тема 1.4. Періодичний закон і періодична система д.І. Менделєєва
- •Періодичний закон.
- •Контрольні запитання:
- •Тема 1.5. Хімічний зв'язок.
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.6. Міжмолекулярна взаємодія. Типи кристалічних ґраток.
- •Контрольні запитання:
- •Розділ 2. Загальні закономірності хімічних процесів. Тема 2.1. Реакції іонного обміну
- •Контрольні запитання:
- •Тема 2.2. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.3. Енергетика хімічних реакцій
- •Контрольні запитання:
- •Тема 2.4. Хімічна кінетика
- •Контрольні запитання:
- •Тема 2.5. Хімічна рівновага
- •Контрольні запитання:
- •Розділ 3. Дисперсні системи. Розчини. Комплексні речовини. Тема 3.1. Дисперсні системи
- •Контрольні запитання:
- •Тема 3.2. Розчини і розчинність
- •Розчин, його склад.
- •Контрольні запитання:
- •Тема 3.3. Розчини електролітів. Електролітична дисоціація.
- •Контрольні запитання:
- •Тема 3.4. Гідроліз солей.
- •Контрольні запитання:
- •Тема 3.5. Комплексні речовини
- •Координаційна теорія Вернера. *
- •Контрольні запитання:
- •Розділ 4. Основи електрохімії. Тема 4.1. Електрохімічні процеси. Електродні потенціали і електрорушійна сила.
- •Електрохімія. Поняття про електроди.
- •Контрольні запитання:
- •Тема 4.2. Електроліз
- •Поняття про електроліз.
- •Контрольні запитання:
- •Тема 4.3. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Розділ 5. Метали та матеріали Тема 5.1. Метали та їх сплави
- •Загальні властивості металів.
- •Контрольні запитання:
- •Тема 5.2. Одержання металів
- •Добування металів з руд. *
- •Контрольні запитання:
- •Тема 5.3. Магній і берилій.
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.4. Алюміній і титан
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.5. Ванадій, хром і марганець
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.6. Залізо, кобальт, нікель і мідь
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.7. Цинк, галій, олово і свинець
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.8. Інструментальні й абразивні матеріали
- •Бор і його сполуки.*
- •Контрольні запитання:
Контрольні запитання:
Які речовини називаються електролітами?
Сформулюйте основні положення ТЕД.
Що називається ступенем дисоціації і константою дисоціації?
Складіть рівняння електролітичної дисоціації речовин: H3PO4, Ba(OH)2, AlCl3.
Визначте силу електроліту за значенням ступеня дисоціації, якщо з 400 молекул продисоціювало 160.
Література:
Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. VІІІ, §§ 82-87, с. 233-246.
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 5, §§ 39-43, с. 49-52.
Тема 3.4. Гідроліз солей.
План
Поняття про йонний добуток води.*
Гідроліз солей.**
3. Поняття про константу гідролізу.***
1. Хоча вода і є слабким електролітом, але вона здатна на невелику дисоціацію:
Н2О ↔ Н+ + ОН-
За величиною електропровідності чистої води можна обчислити концентрацію йонів Гідрогену та гідроксид-йонів у воді. При 25С вона дорівнює 10-7 моль/л.
Константа дисоціації води:
![]()
Перепишемо рівняння так:
[Н+][ОН-]=[Н2О]К
[Н+][ОН-]=КН2О
Це рівняння показує, що для води і розбавлених водних розчинів при незмінній температурі добуток концентрацій йонів Гідрогену і гідроксид-йонів є величина стала. Ця стала величина називається йонним добутком води.
КН2О = 10-7 ∙10-7 = 10-14
Водневий показник – від`ємний десятковий логарифм йонів Гідрогену:
рН = -lg[H+]
Для вимірювання рН існують різні методи. Найчастіше використовують індикатори.
2. Гідроліз солей – це процес взаємодії солі з водою внаслідок чого утворюється слабкий електроліт і змінюється рН середовища.
4 типи:
1) сіль утворена сильною основою та слабкою кислотою (Na2CO3), рН>7
І. Na2CO3 + H2O ↔ NaHCO3 + NaOH
2Na+ + CO32- + H2O ↔ 2Na+ + HCO3- + OH-
CO32- + H2O ↔ HCO3- + OH-
II. NaHCO3 + H2O ↔ Na2CO3 + NaOH
Na+ + HCO3- + H2O ↔ Na+ + H2CO3 + OH-
HCO3- + H2O ↔ H2CO3 + OH-
2) сіль утворена слабкою основою та сильною кислотою (CuCl2), рН<7
І. CuCl2 + H2O ↔ CuOHCl + HCl
Cu2+ + 2Cl- + H2O ↔ CuOH+ + H+ + 2Cl-
Cu2+ + H2O ↔ CuOH+ + H+
II. CuOHCl + H2O ↔ Cu(OH)2 + HCl
CuOH+ + Cl- + H2O ↔ Cu(OH)2 + H+ + Cl-
CuOH+ + H2O ↔ Cu(OH)2 + H+
3) сіль утворена слабкою основою та слабкою кислотою (NH4NO2), рН≈7
NH4NO2 + H2O ↔ NH4NO2 + HNO2
NH4+ + NO2- + H2O ↔ NH4NO2 + HNO2
4) сіль утворена сильною основою та сильною кислотою (NaCl) – гідроліз не відбувається
3. У розглянутих випадках гідролізується не вся кількість солі, яка є в розчині, а тільки її частина. Інакше кажучи, у розчині встановлюється рівновага між сіллю і кислотою та основою, що її утворюють. Частка речовини, що гідролізується, - ступінь гідролізу – залежить від константи цієї рівноваги, а також від температури і від концентрації солі.
Запишемо рівняння гідролізу у загальному вигляді. Нехай НА – кислота, МОН – основа, МА – утворена ними сіль. Тоді рівняння гідролізу матиме вигляд:
МА + Н2О ↔ НА + МОН
Константа рівноваги:
![]()
Концентрація води у розбавлених розчинах є практично сталою величиною. Позначаючи [Н2О]К = Кг дістанемо:
![]()
Величина Кг називається константою гідролізу у солі. ЇЇ значення характеризує здатність солі гідролізуватися; чим більше Кг, тим більшою мірою відбувається гідроліз.
сіль утворена сильною основою та слабкою кислотою
![]()
сіль утворена слабкою основою та сильною кислотою

сіль утворена слабкою основою та слабкою кислотою