
- •Рецензенты:
- •Содержание
- •Введение
- •1. Основные этапы выполнения курсовой работы и порядок предоставления материалов к защите
- •2. Структура курсовой работы
- •3. Содержание введения
- •4. Содержание экспериментальной части
- •4.1. Спектральные методы исследования
- •Люминесцентный анализ
- •4.2. Хроматографическое исследование
- •5. Оформление пояснительной записки курсовой работы
- •5.1. Порядок представления текстового, табличного и иллюстративного материала
- •5.2. Оформление библиографического аппарата
- •5.3. Оформление приложений
- •Рекомендуемая литература Основная:
- •Дополнительная:
- •Нормативные документы
- •Приложение 1
- •Приложение 2
- •Санкт-Петербург
- •Приложение 3 Характеристические полосы поглощения различных функциональных группировок Алканы
- •Ароматические углеводороды
- •Форма полос в области 1600-2000 см-1 и полосы неплоских деформационных колебаний (900-700 см-1)
- •Хлорсодержащие соединения
- •Карбонильные и простые эфирные группы
- •Лист регистрации изменений
Люминесцентный анализ
Люминесцентной способностью обладают многие органические соединения: бензол, нафталин и их многочисленные производные, биологически активные вещества (витамины, антибиотики, гормоны), многие пигменты и т. д. Благодаря низкому пределу обнаружения и простоте применяемой аппаратуры люминесцентный анализ успешно развивается и является одним из перспективных методов.
Важнейшей особенностью люминесцентного метода анализа является его применяемость к определению микропримесей. Погрешность метода составляет 5—7%. Применимость люминесцентного анализа очень широка. Он может быть использован для определения почти любого элемента, многих органических, биологически активных и других веществ.
Согласно определению, люминесценцией называют свечение, избыточное над температурным и обладающее длительностью не менее чем 10-10 с, что превышает период световых колебаний. От излучения нагретых тел она отличается своей неравновесностью: люминесценция практически не использует тепловую энергию излучающей системы, поэтому ее часто называют холодным светом. Это определение отличает люминесценцию также от всех других видов неравновесного свечения — рассеяния и отражения света, комбинационного рассеяния, излучения Вавилова—Черенкова и т. д.
Люминесценция возникает в результате электронного перехода при возвращении частиц из возбужденного состояния в нормальное. Таким образом, молекула преобразует поглощенную энергию в собственное излучение. Этим люминесценция также отличается от процессов несобственного излучения — рассеяния и отражения света. Люминесцирующие вещества могут находиться в любом агрегатном состоянии.
В возбужденное состояние частицы люминесцирующего вещества могут переходить под действием света и тогда люминесценцию называют фотолюминесценцией (флуоресценцией или фосфоресценцией), под действием рентгеновского излучения — рентгенолюминесценцией, в результате химической реакции — хемилюминесценцией и т. д.
Происхождение люминесцентного излучения поясняется схемой на рисунке 7. Здесь схематически изображены основной и возбужденные (синглетный и триплетный) электронные уровни молекулы. На каждый электронный уровень накладываются колебательные подуровни с квантовыми числами 0, 1, 2, 3 и т. д. При поглощении кванта света электрон переходит с основного уровня на более высокий, соответствующий возбужденным синглетному (анти-параллельные спины) и триплетному (параллельные спины) состояниям.
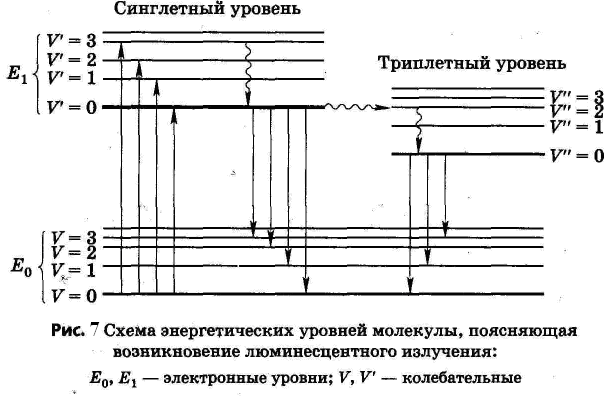
Прямой переход основного синглетного в возбужденное триплетное состояние, энергия которого несколько меньше, чем синглетного, запрещен по спину. Триплетные уровни могут заполняться за счет интеркомбинационной конверсии (волнистая стрелка V´=0 V´´= 2). При комнатной температуре молекулы обычно находятся в основном состоянии и почти все электронные переходы при поглощении света происходят с нижнего (основного) колебательного подуровня на различные колебательные подуровни возбужденного синглетного состояния. На рис. 1 эти переходы изображены стрелками: V=0V´= 0; V = 0 V´=1; V=0 V´=2 и т. д.
Возбужденная молекула за счет так называемой колебательной релаксации при столкновении с окружающими молекулами очень быстро по сравнению с временем электронного перехода теряет избыточную колебательную энергию и переходит на основной колебательный уровень возбужденного электронного (синглетного) состояния. На рис.1 этот процесс изображен волнистой стрелкой: V´=ЗV´=0; V´=2V´=0; V´=1V´=0 и т. д.
При переходе с основного колебательного подуровня возбужденного синглетного состояния на какой-либо колебательный подуровень основного электронного (тоже синглетного) состояния происходит излучение кванта света. Этот процесс называют флуоресценцией. На рис. 1 ему соответствуют переходы V´ = 0 V = 0; V´ = 0 V = 1; V´ = 0 V = 2 и т. д. Время затухания флуоресценции составляет 10-9—10-7 с. Дезактивация возбужденной молекулы может происходить также за счет безызлучательных переходов внутренней конверсии. В триплетном так же, как и в возбужденном синглетном состоянии, происходит колебательная релаксация, и электрон переходит на нижний колебательный уровень триплетного состояния (волнистая стрелка V´´= 2 V´´ = 0; V´´ = 1 V´´ = 0). Запрещенный по спину излучательный триплет-синглетный переход (V´´ = 0 V = 0; V" = 0 • V = 1 и т. д.) называют фосфоресценцией. Время жизни триплетного состояния велико (10-3 -102 с). Переход от триплетного состояния в основное синглетное происходит также при столкновении возбужденной частицы с окружающими молекулами за счет безызлучательных процессов внутренней конверсии, вероятность которых при комнатной температуре очень велика. По этой причине, чтобы наблюдать фосфоресценцию и использовать ее в аналитических целях, пробу обычно замораживают, часто при температуре жидкого азота (77 К), что сводит до минимума вероятность безызлучательного перехода. Спектр фосфоресценции сдвинут в длинноволновую сторону на величину, пропорциональную энергии колебательной релаксации триплетного состояния.
Так как в зависимости от частоты облучающего излучения частица переходит в энергетически разные возбужденные состояния, можно было ожидать связь спектра флуоресценции со спектром возбуждения источника. Однако в действительности эта зависимость обычно не наблюдается. Независимость спектра флуоресценции от длины волны падающего света, в основном, связана с тем, что возбужденные молекулы в результате колебательной релаксации успевают растратить колебательную энергию за время, значительно меньшее, чем время жизни возбужденного состояния, и перейти на основной колебательный уровень возбужденного электронного состояния. Переход такой системы в невозбужденное состояние характеризуется испусканием одних и тех же квантов света, т. е. наблюдается один и тот же спектр флуоресценции. В то же время в некоторых случаях это расширяет возможности люминесцентного анализа, давая возможность селективного возбуждения определенных соединений.
Из рис. 1 видно, что между спектром поглощения вещества и его спектром флуоресценции можно ожидать определенного сходства, так как и тот и другой определяются, в сущности, одними и теми же электронными переходами. Сходство, действительно, есть, причем, как установлено законом Стокса-Ломмеля, спектр излучения в целом и его максимум всегда сдвинуты в сторону более длинных волн по сравнению со спектром поглощения и его максимумом.
Эта закономерность легко объясняется схемой, изображенной на рис. 1, в соответствии с которой энергия квантов флуоресценции должна быть меньше энергии поглощенных квантов на величину энергетических потерь при колебательной релаксации в возбужденном электронном состоянии и перехода на неосновной колебательный подуровень основного электронного состояния. Спектры люминесценции большинства веществ характеризуются широкими полосами излучения (100—200 нм). Если, однако, вещество исследуют в условиях сильного охлаждения (до температур жидкого азота 77 К или водорода 20 К), спектры становятся квазилинейчатыми с разрешенной колебательной структурой (эффект Шпольского). Этот эффект проявляется не у всех веществ, так как у многих соединений остаются вклады за счет внутримолекулярного и других видов взаимодействия.
Энергетический и квантовый выходы люминесценции
Эффективность преобразования энергии поглощенного света в энергию люминесценции характеризуется энергетическим. и квантовым выходами люминесценции. Отношение излучаемой энергии люминесценции к энергии поглощенного света называют энергетическим выходом люминесценции, а отношение числа излучаемых квантов к числу поглощенных называют квантовым выходом люминесценции.
Если Вэн — энергетический, а Вкв — квантовый выход люминесценции, Ел и Ес — соответственно энергия люминесценции и энергия поглощенного света, а Nл и Nс — число испускаемых и поглощенных квантов, то очевидно, что:
![]() ;
;
![]()
Связь между Вэн и Вкв легко установить, если учесть, что энергия N квантов равна Е = Nh:
![]()
Зависимость энергетического выхода люминесценции от длины волны возбуждающего света подчиняется закону Вавилова. В соответствии с этим законом энергетический выход люминесценции с увеличением длины волны возбуждающего света сначала возрастает пропорционально длине волны, затем остается постоянным и после достижения некоторой граничной длины волны резко падает.
Учитывая пропорциональность энергетического выхода длине волны возбуждающего света
![]()
и соотношение = с/, получаем
![]()
т. е. пропорциональность энергетического выхода длине волны поглощенного света означает постоянство квантового выхода люминесценции в этом спектральном интервале. Очевидно, чем больше квантовый выход люминесценции, тем меньшее количество люминесцирующего вещества может быть обнаружено по его свечению.
Интенсивность люминесценции
Интенсивность люминесценции Iл пропорциональна числу излучаемых квантов NЛ:
![]()
где — коэффициент пропорциональности.
Число поглощенных квантов Nc пропорционально интенсивности поглощенного света:
![]()
где I0 — интенсивность падающего света; I — интенсивность света, прошедшего через раствор; ' — коэффициент пропорциональности.
Величины I и I0 связаны уравнением закона Бугера—Ламберта —Бера:
![]()
Учитывая это после ряда математических преобразований при соблюдении условия lс < 10-2 получаем
![]() ,
где k
– коэффициент пропорциональности.
,
где k
– коэффициент пропорциональности.
Линейная зависимость интенсивности люминесценции от концентрации будет соблюдаться при постоянстве таких факторов, как квантовый выход, интенсивность возбуждающего света и т. д. Также существенным является условие низкой концентрации люминесцирующего вещества.
С увеличением концентрации условие lс < 10-2 будет нарушаться и зависимость интенсивности люминесценции от концентрации будет отклоняться от линейной. При достаточно большой концентрации интенсивность люминесценции вообще может уменьшаться, т. е. может начаться так называемое концентрационное тушение люминесценции. В этой связи верхний предел концентрации раствора в люминесцентном анализе обычно не превышает 10-3—10-4 моль/л.
Концентрационное тушение люминесценции по С. И. Вавилову в широком интервале концентраций во многих случаях описывается
![]()
где В и В0 — выход люминесценции при концентрации с и со; с0 — пороговая концентрация, по достижении которой развивается концентрационное тушение; k — постоянная.
Однако это уравнение оказывается применимым не всегда.
Существенное значение имеет температурное тушение люминесценции, т. е. уменьшение выхода свечения с повышением температуры. В той или иной степени это явление свойственно всем люминесцирующим веществам. Оно объясняется тем, что с повышением температуры увеличивается колебательная энергия молекул и возрастает вероятность безызлучательных переходов, а также вероятность диссоциации возбужденных частиц, происходящая без излучения квантов света.
Отрицательное влияние на выход люминесценции оказывают многие примеси и поэтому тушение люминесценции лежит в основе методик их определения.
Как говорилось выше, склонностью к флуоресценции в УФ и видимой области спектра обладает ограниченный круг соединений, например, ароматические и гетероциклические соединения, содержащие сложные системы сопряженных связей. При этом на характеристики флуоресценции оказывает влияние не только природа самих соединений, но и природа матрицы в которой они находятся.
Среди соединений, которые могут содержаться в задании на выполнение курсовой работы по дисциплине «Физико-химические методы экспертного исследования» способностью к флуоресценции в УФ и видимой области спектра обладают алкилбензолы (толуол, о-ксилол и п-ксилол). Спектры флуоресценции для данных соединений представлены на рисунке 1.
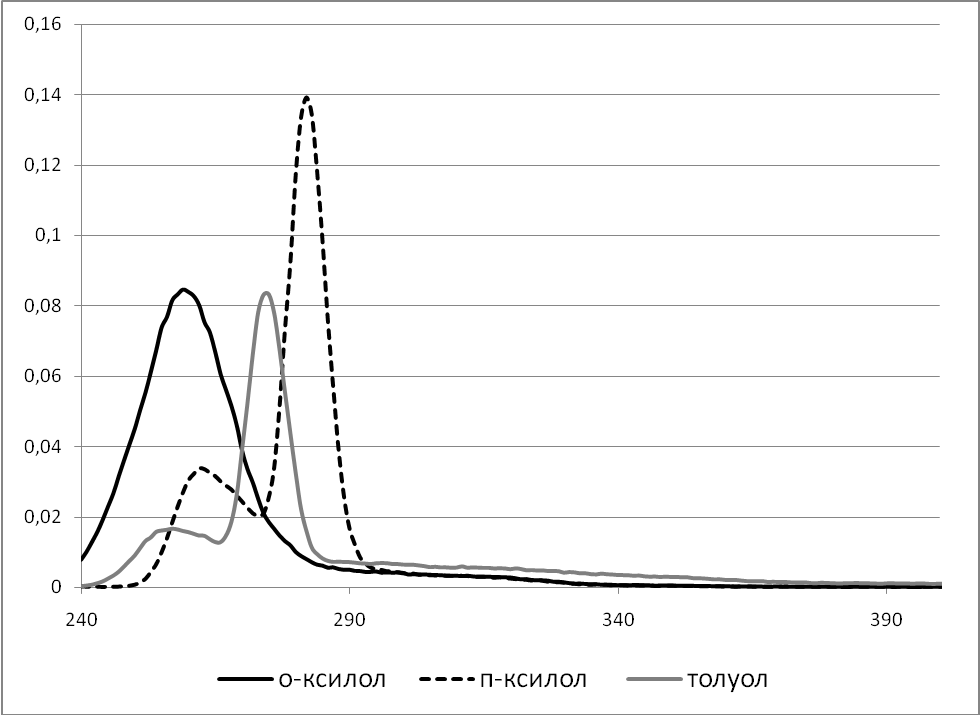
Рисунок 1. Спектры флуоресценции толуола, о- и п-ксилола.
При флуоресцентном анализе следует учитывать не только положение максимумов флуоресценции, но границу прозрачности для основных компонентов, составляющих пробу. Примерные диапазоны УФ границ прозрачности для разных классов растворителей представлены в таблице.
Таблица. Примерные диапазоны УФ границ прозрачности для разных классов растворителей
№ п/п |
Класс растворителей |
Граница прозрачности, нм |
1 |
Алканы (гептан, изооктан, октан и др.) |
190-205 |
2 |
Алкилхлориды (дихлорметан, хлороформ и др.) |
220-270 |
3 |
Бензол и алкилбензолы (толуол, ксилолы и др.) |
270-290 |
4 |
Алкилкетоны (ацетон, метилпропилкетон и др.) |
320-340 |
Попадание максимумов флуоресценции в область до границы прозрачности содержащихся в смеси компонентов может приводить к существенному снижению ее интенсивности. Таким образом, присутствие в смеси ацетона, как и присутствие хлоралканов, может препятствовать обнаружению ароматических соединений.
Кроме того, при анализе спектров флуоресценции следует помнить о высокой чувствительности данного метода, приводящей к тому, что даже следовое содержание способных к флуоресценции соединений может существенным образом сказаться на виде спектра. Не смотря на то, что для приготовления заданий к курсовой работе применяются реактивы марки «ХЧ» (химически чистые), они могут содержать очень незначительное количество примесей способных искажать картину флуоресценции ароматических соединений, что необходимо помнить при формулировке выводов по результатам лабораторной работы.
При выполнении курсовой работы применяется анализатор жидкости «Флюорат-02-Панорама», который предназначен для измерения массовой концентрации неорганических и органических примесей в различных средах. Принцип действия анализатора основан на измерении интенсивностей световых потоков от исследуемого объекта, возникающих под воздействием возбуждающего оптического излучения, выделенного спектрального диапазона.
Перед учащимися ставится цель определения наличия в образцах ароматических соединений и попытаться их распознать по спектрам флуоресценции, что является целью второй части курсовой работы.
С помощью шприца анализируемый образец помещается в кварцевую кювету.
Заполненная кювета помещается в спектрометр. Работа на приборе осуществляется согласно руководству по эксплуатации. В присутствии преподавателя, снимаются спектры флуоресценции при следующем режиме измерения:
Синхронное сканирование
Диапазон длин волн возбуждения 180-470 нм
Смещение 30 нм
Число вспышек 10
Шаг 1нм
Коррекция – по опорному каналу
Чувствительность ФЭУ – минимальная.
Полученные спектры распечатываются и прилагаются к курсовой работе в виде приложения, по виду спектра устанавливаются имеющиеся в смеси ароматические соединения.
