
- •Тема 1. Структура биомембран
- •1.1. Функции биомембран
- •1.2. Принцип строения
- •1.3. Основные количественые характеристики мембран
- •1.4. Основные свойства мембран
- •1.5. Мембранные липиды
- •Биомембран, %
- •1.6. Белки мембран.
- •4. Белки, участвующие в передаче сигналов от одних клеток к другим.
- •Тема 2: перенос веществ через мембраны
- •2.1. Способы переноса через мембрану низкомолекулярных соединений
- •2.1.4. Катионные каналы и н-холинорецепторы
- •2.1.5. Антибиотики как переносчики ионов
- •2.2. Активный транспорт
- •2.3. Перенос через мембраны частиц и высокомолекулярных соединений.
- •2.3.1. Способы переноса
- •2.3.2.Экзоцитоз ацетилхолина
- •Тема 3. Межклеточные взаимодействия
- •3.1. Семейство адгезивных мембранных белков
- •3.2. Контакты простого типа:
- •3.3. Контакты сцепляющего типа:
- •3.4. Контакты запирающего типа:
- •3.5. Контакты коммуникационного типа:
- •Коннексон; 2- плазматическая мембрана
- •1.1. Функции биомембран 3
Тема 3. Межклеточные взаимодействия
У многоклеточных организмов за счет межклеточных взаимодействий образуются сложные клеточные ансамбли, поддержание которых может осуществляться разными путями. В зародышевых, эмбриональных тканях, особенно на ранних стадиях развития, клетки остаются в связи друг с другом за счет способности их поверхностей слипаться. Это свойство адгезии (соединения, сцепления) клеток может определяться свойствами их поверхности, которые специфически взаимодействуют друг с другом. Механизм этих связей достаточно хорошо изучен, он обеспечивается взаимодействием между гликопротеидами плазматических мембран. При таком межклеточном взаимодействии клеток между плазматическими мембранами всегда остается щель шириной около 20 нм, заполненная гликокаликсом. Обработка ткани ферментами, нарушающими целостность гликокаликса (муказами, действующими гидролитически на муцины, мукополисахариды) или повреждающими плазматическую мембрану (протеазами), приводит к обособлению клеток друг от друга, к их диссоциации. Однако если удалить фактор диссоциации, то клетки могут снова собираться, реагрегировать. Так можно диссоциировать клетки разных по окраске губок, оранжевых и желтых. Оказалось, что в смеси этих клеток образуются два типа агрегатов: одни состоят только из желтых, другие — только из оранжевых клеток. При этом смешанные клеточные суспензии самоорганизуются, восстанавливая исходную многоклеточную структуру. Сходные результаты были получены с суспензиями разделенных клеток эмбрионов амфибий; в этом случае происходит избирательное пространственное обособление клеток эктодермы от энтодермы и от мезенхимы. Более того, если для реагрегации используются ткани поздних стадий развития зародышей, то в пробирке самостоятельно собираются различные клеточные ансамбли, обладающие тканевой и органной специфичностью, образуются эпителиальные агрегаты, сходные с почечными канальцами, и т. д.
3.1. Семейство адгезивных мембранных белков
За агрегацию однородных клеток отвечают трансмембранные гли-копротеиды. Непосредственно за соединение — адгезию, клеток отвечают молекулы так называемых САМ-белков (cell adhesion molecules). Некоторые из них связывают клетки друг с другом за счет межмолекулярных взаимодействий, другие образуют специальные межклеточные соединения, или контакты.
Взаимодействия между адгезивными белками могут быть гомофильными, когда соседние клетки связываются друг с другом с помощью однородных молекул, и гетерофильными, когда в адгезии участвуют разного рода САМ на соседних клетках. Встречается межклеточное связывание через дополнительные линкерные молекулы.
Среди известных в настоящее адгезивных белков различают следующие семейства:
Интегрины
С
 електины
електиныИммуноглобулиноподобные белки
Кадгерины
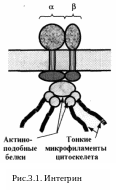
3.1.1. Интегрины — это интегральные белки гетеродимерной структуры aibj: (рис. 3.1). Хотя интегральными являются и многие другие адгезивные белки (например, селектины и иммуноглобулины), термин «интегрины» используется только для данного семейства.
Известно более 10 разных видов субъединицы a и около 15 видов субъединицы b. При этом b-субъединицы по размеру значительно меньше, чем a-субъединицы. Тем не менее и в тех, и в других — по три домена: внутриклеточный (небольшой по размеру), мембранный и внеклеточный.
Внутриклеточные домены интегринов участвуют в фиксации цитоскелета (актиновых микрофиламентов).
Связь между этими доменами и микрофиламентами осуществляется с помощью специальных белков — винкулина, талина или непосредственно актина. Таким образом, за счет внутриклеточных доменов интегрины, подобно гликофорину эритроцитов, выполняют и структурную функцию.
Внеклеточные же домены ответственны за узнавание специфических лигандов и адгезию с ними. Очень часто (хотя не всегда) узнаваемым локусом в этих лигандах является одна и та же трипептидная последовательность —
-Арг—Гли—Асп-
Хотя выявлено около 15 разных b-субъединиц, наиболее изучены белки с b-субъединицами первых трех типов (b 1, b2, b3).
b1-интегрины обнаружены в плазмолемме лимфоцитов и тромбоцитов. При этом некоторые b1-интегрины участвуют во взаимодействии лимфоцитов с эндотелием (на начальной стадии проникновения в ткани), контактируя с адгезивными иммуноглобулинами на поверхности эндотелиоцитов.
Как известно, лимфоциты подразделяются на несколько популяций, в т. ч. В- и Т-клетки. Оказывается, у этих клеток различен спектр мембранных b1-интегринов. Это, наряду с другими факторами, видимо, влияет на то, в сосудах каких органов лимфоциты могут взаимодействовать с эндотелием.
Когда лимфоцит оказывается вне сосудистого русла, другие b1-интегрины реагируют с белками межклеточного вещества — коллагеном, фибронектином, ламинином. Причем взаимодействие является весьма специфичным: для каждого из перечисленных внеклеточных белков на поверхности лимфоцита имеется свой b1 -интегрин.
К b2-интегринам относятся всего три белка. Они выявлены не только в лимфоцитах, но и в других лейкоцитах — гранулоцитах и моноцитах. В этих «других» лейкоцитах b2-интегрины обеспечивают взаимодействие, во-первых, с клетками эндотелия, а во-вторых, с фагоцитируемыми объектами. В случае моноцитов те же белки еще участвуют во взаимодействии с лимфоцитами — в процессе представления последним антигенов.
Наконец, b3-интпегрины обнаруживаются на поверхности ряда лейкоцитов и активированных тромбоцитов. В последних они необходимы для связывания с фибриногеном.
3.1.2. Селектины
В отличие от интегринов, эти белки представляют собой не димеры, а мономеры. Название происходит от того факта, что N-концевой домен (крайний во внеклеточной части белка; рис. 3.2) обладает свойствами лектинов.
Лектины — группа белков (в основном, растительного происхождения; наиболее известный представитель — конканавалин), которые имеют специфическое сродство к тому или иному концевому моносахариду олигосахаридных цепей.
Таким образом, благодаря лектиновому домену, селектины узнают определенные углеводные компоненты на поверхности клеток. В частности, для двух селектинов (Р- и Е-) лигандом является концевая последовательность Сиалил-Фукоза.
З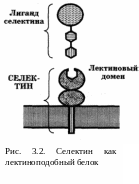 а
лектиновым доменом следует (в направлении
от N-
к С-концу цепи) серия из трех-десяти
других доменов. Из них одни, видимо,
влияют на конформацию первого домена,
а другие сами принимают участие в
связывании (на стадиях, происходящих
за первичным узнаванием).
а
лектиновым доменом следует (в направлении
от N-
к С-концу цепи) серия из трех-десяти
других доменов. Из них одни, видимо,
влияют на конформацию первого домена,
а другие сами принимают участие в
связывании (на стадиях, происходящих
за первичным узнаванием).
Среди конкретных представителей селектинов наиболее известны 3 белка — L-, Р- и Е-селектины.
L-селектин, как и интегрины, обнаруживается на поверхности различных лейкоцитов и участвует в их взаимодействии с гликопротеинами эндотелия. Причем специфические для L-селектина гликопротеины в особенно большом количестве сосредоточены в посткапиллярных венулах лимфоузлов (эти венулы отличаются высоким эндотелием). Поэтому именно здесь в обычных условиях лимфоциты выходят из сосудистого русла, что обозначается как хоминг (от англ. Ноте — дом) — возвращение лимфоцитов в лимфоидную ткань. Гликопротеины же высокого эндотелия, служащие как бы маяками для лимфоцитов, называются сосудистыми адрессинами.
Подводя итог, можно сказать, что хоминг лимфоцитов обеспечивается взаимодействием L-селектина и сосудистых адрессинов.
В отличие от L-селектина, Р- и Е-селектины обнаруживаются на поверхности не лейкоцитов, а эндотелия. Причем, в большинстве сосудов — не постоянно, а только после стимуляции эндотелия факторами (гистамином, тромбином, цитокинами), стимулирующими воспаление и ряд других реакций. Появившись на поверхности эндотелиоцитов, эти селектины участвуют во взаимодействии с лейкоцитами, а затем вновь исчезают с поверхности. В невозбужденных же эндотелиоцитах селектины хранятся в специальных цитоплазматических образованиях — тельцах Вейбеля-Паладе.
Таким образом, здесь обращают на себя внимание два обстоятельства.
Во-первых, некоторые адгезивные молекулы оказываются на поверхности клетки лишь при определенных условиях и временно.
Во-вторых, селектины участвуют во взаимодействии лейкоцит-эндотелиоцит как бы «с двух сторон»: одни (L-селектин) – со стороны лейкоцитов, а другие (Р и Е-селектины) – со стороны эндотелия.
Р-селектин выявляется также и на активированных тромбоцитах.
3.1.3. Адгезивные иммуноглобулины
«Классические» иммуноглобулины (Ig), циркулирующие в крови, как известно, продуцируются плазматическими клетками (образующимися из В-лимфоцитов при антигенной стимуляции).
Эти Ig имеют характерную олигомерную структуру (рис. 3.3 А) — (L2Н2)п, где L означает легкие цепи, Н — тяжелые, а п варьирует от 1 до 5.
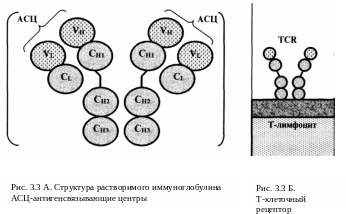
Причем L-цепи образуют два домена: один вариабельный (VL) и один константный (СL), а Н-цепи — четыре домена: один вариабельный (VH) и три или четыре константных (CH). Вариабельные домены (VL и VH) попарно формируют антигенсвязывающии центр, специфичный в отношении того или иного антигена. Таким образом, Ig являются антителами к антигенам.
Что касается адгезивных Ig и Ig-подобных белков, то они находятся на поверхности лимфоидных и ряда других клеток (в частности, эндотелиоцитов), выступая в качестве рецепторов.
а) При этом на В-лимфоцитах структура данных белков наиболее близка к той, что изображена на рис. 3.3 А. Причем В-клетки одного клона имеют на поверхности Ig лишь одной иммуноспецифичности. Поэтому В-лимфоциты наиболее специфично реагируют с антигенами.
В дальнейшем происходят два противоположных процесса:
- исчезновение с поверхности клетки молекул Ig (вследствие эндоцитоза их комплексов с антигеном),
- появление на поверхности новых молекул того же Ig (вследствие усиления их синтеза).
Когда второй процесс начинает преобладать, молекулы Ig собираются в мембране в пятнышки, которые затем перемещаются в одну область, образуя «шапочку». Такова же реакция лимфоцитов на специфические антитела против их поверхностных Ig.
б) Что касается Т-лимфоцитов, то на их поверхности Ig присутствуют, вероятно, в «неполном» виде — представлены, как считают, только тяжелой цепью (которая, однако, вновь имеет вариабельный и константные домены). Такие белки называются Т-клеточными рецепторами (ТСR; рис. 3.3 Б).
Специфичность их взаимодействия с антигенами несколько иная, чем у полных Ig В-клеток. Например, у одного из видов Т-клеток (т. н. Т-хелперов) ТСR узнает не саму по себе антигенную детерминанту, а ее комплекс с определенным мембранным белком на поверхности клетки — в частности, В-лимфоцита. Таким образом, Т-клетки, участвуя в иммунной реакции, связываются с помощью ТСR с другой клеткой. И вновь все Т-клетки одного клона имеют на своей поверхности ТСR лишь одного вида.
Активацию Т-клеток можно вызвать также лектинами. Последние же, как отмечалось выше, специфически взаимодействуют с концевыми остатками олигосахаридов. Следовательно, в состав ТСR входят также олигосахаридные цепи. Возможно, то же относится и к Ig В-клеток.
в) Наконец, существуют и такие Ig -подобные поверхностные белки, которые совсем лишены иммуноспецифичности. Они играют роль обычных адгезивных белков и участвуют, в частности, в тех же процессах взаимодействия клеток крови с эндотелием, что и интегрины и селектины.
Некоторые белки этой группы являются облигатно или факультативно гомофильными.
В первом случае (при облигатной гомофильности) лигандом молекулы белка может служить лишь такая же молекула (на поверхности другой клетки). Примером является белок N-САМ, выявленный в нервной ткани, а также на некоторых лимфоцитах.
Во втором случае (при факультативной гомофильности) белок может участвовать как в гомо-, так и в гетерофильных взаимодействиях. Пример — белок СD31; он находится на эндотелиоцитах, тромбоцитах и моноцитах. При этом на эндотелиоцитах одни его молекулы, проявляя гомофильность, обеспечивают межклеточные контакты эндотелиоцитов друг с другом; остальные же молекулы, благодаря гетерофильности, могут реагировать с другими адгезивными белками тромбоцитов и моноцитов.
3.1.4. Кадгерины- интегральные фибриллярные мембранные белки, соединяющие актиновые цитоскелеты клеток. Благодаря кадгеринам контактирующие мембраны соседних клеток удерживаются вместе, поддерживая целостность ткани. Отдельные домены этих белков связаны с ионами Ca2+ , что придает им определенную жесткость. Насчитывается более 40 видов кадгеринов. Клетки разных тканей имеют на своей поверхности разные кадгерины: в случае эпителиоцитов это кадгерины подсемейства Е и Р, в случае нервной и мышечной тканей – кадгерины подсемейства N. Благодаря этому, в процессе гисто- и органогенеза клетки одного типа (например, эпителиоциты) узнают друг друга и объединяются в надклеточную структуру (например, эпителиальный пласт).
Как и многие предыдущие белки, кадгерины тоже обеспечивают взаимодействие клеток крови и эндотелиоцитов между собой и (или) с компонентами межклеточного матрикса. Но у некоторых из данных белков имеется интересная особенность - они обладают ферментативной активностью (например протеазной или нуклеазной). Пока остается неясным способствует ли данная активность адгезивному взаимодействию или выполняет некую параллельную функцию.
Межклеточные контакты
Кроме рассмотренных выше временных адгезивных взаимодействий, клетки могут образовывать друг с другом или с внеклеточными структурами относительно постоянные контакты.
Наиболее характерный пример — клетки эпителия: они лежат в виде пласта, который практически не содержит межклеточных промежутков и примыкает к базальной мембране. Целостность пласта обеспечивается тем, что, во-первых, между соседними клетками имеется целый ряд различных контактов, а во-вторых, клетки базального слоя образуют контакты и с базальной мембраной.
Можно привести множество других примеров. Это связь между:
- кардиомиоцитами в миокарде,
- клетками паренхиматозных органов (печени, желез и т. д.),
- нервными клетками (синапсы).
Во всех этих случаях ключевую роль в формообразовании ткани или органа играют межклеточные контакты.
В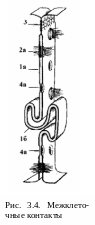 то же время постоянство этих контактов
в определенной степени относительно.
Например, в многослойном эпителии клетки
постепенно оттесняются новыми генерациями
эпителиоцитов в вышележащие слои. При
этом вначале пропадает их связь с
базальной мембраной, а в самом конце —
и друг с другом. Во многом похожая картина
наблюдается при созревании мужских
половых клеток в семенных канальцах:
здесь постепенно меняются контакты
сперматогеннных клеток с поддерживающими
их клетками Сертоли.
то же время постоянство этих контактов
в определенной степени относительно.
Например, в многослойном эпителии клетки
постепенно оттесняются новыми генерациями
эпителиоцитов в вышележащие слои. При
этом вначале пропадает их связь с
базальной мембраной, а в самом конце —
и друг с другом. Во многом похожая картина
наблюдается при созревании мужских
половых клеток в семенных канальцах:
здесь постепенно меняются контакты
сперматогеннных клеток с поддерживающими
их клетками Сертоли.
Тем не менее, межклеточные контакты имеют качественно иной уровень прочности по сравнению с временными адгезивными взаимодействиями, хотя и в этом случае решающую роль играют мембранные белки, многие из которых можно тоже считать адгезивными.
По функциональным свойствам межклеточные контакты подразделяются следующим образом ( рис. 3.4).
Контакты простого типа. К ним относятся:
А) простые межклеточные соединения
Б) интердигитации
2. Контакты сцепляющего типа, которые подразделяются на:
А) десмосомы
Б) адгезивный поясок
3. Контакты запирающего типа, представленные плотными соединениями (также наз. запирающей зоной, или zona occludens).
4. Контакты коммуникационного типа:
А) щелевые соединения (нексусы, или gap-junction)
Б) синапсы.
Контакты первых двух типов необходимы для сцепления клеток друг с другом, и, как следует из названия, в большей степени эту функцию выполняют контакты второго типа – сцепляющие. Роль контактов запирающего типа – полное разграничение сред, лежащих по разные стороны клеточного пласта. И, наконец, контакты коммуникационного типа позволяют клеткам обмениваться веществами (нексусы) или сигналами (синапсы).
