
- •Тема 1. Структура биомембран
- •1.1. Функции биомембран
- •1.2. Принцип строения
- •1.3. Основные количественые характеристики мембран
- •1.4. Основные свойства мембран
- •1.5. Мембранные липиды
- •Биомембран, %
- •1.6. Белки мембран.
- •4. Белки, участвующие в передаче сигналов от одних клеток к другим.
- •Тема 2: перенос веществ через мембраны
- •2.1. Способы переноса через мембрану низкомолекулярных соединений
- •2.1.4. Катионные каналы и н-холинорецепторы
- •2.1.5. Антибиотики как переносчики ионов
- •2.2. Активный транспорт
- •2.3. Перенос через мембраны частиц и высокомолекулярных соединений.
- •2.3.1. Способы переноса
- •2.3.2.Экзоцитоз ацетилхолина
- •Тема 3. Межклеточные взаимодействия
- •3.1. Семейство адгезивных мембранных белков
- •3.2. Контакты простого типа:
- •3.3. Контакты сцепляющего типа:
- •3.4. Контакты запирающего типа:
- •3.5. Контакты коммуникационного типа:
- •Коннексон; 2- плазматическая мембрана
- •1.1. Функции биомембран 3
2.1.5. Антибиотики как переносчики ионов
Имеются вещества, которые не являются природными компонентами мембран, но могут облегчать проникновение через них определенных ионов.
В основном, это антибиотики. По своей транспортной способности они подразделяются на две группы:
- подвижные переносчики, проходящие с ионом через мембрану;
- каналообразователи — образуют в мембране канал, через который могут проходить ионы.
а )
Подвижные переносчики (валиномицин
и
др.). Представляют собой замкнутые цепи,
состоящие из мономеров различной природы
(рис.2.7). Углеводородные радикалы этих
мономеров образуют гидрофобную
оболочку молекулы.
Внутри же имеется полость, выстланная
такими полярными группами, которые
способны образовывать единый хелатный
комплекс с одним одновалентным катионом.
В частности, валиномицин активней всего
связывает ион К+;
сродство к Nа+
в
1000 раз меньше.
)
Подвижные переносчики (валиномицин
и
др.). Представляют собой замкнутые цепи,
состоящие из мономеров различной природы
(рис.2.7). Углеводородные радикалы этих
мономеров образуют гидрофобную
оболочку молекулы.
Внутри же имеется полость, выстланная
такими полярными группами, которые
способны образовывать единый хелатный
комплекс с одним одновалентным катионом.
В частности, валиномицин активней всего
связывает ион К+;
сродство к Nа+
в
1000 раз меньше.
Комплекс антибиотика с ионом проходит через мембрану путем простой диффузии. Если с другой стороны мембраны (например, внутри искусственного мембранного пузырька) концентрация ионов К+ достаточно низкая, то происходит диссоциация комплекса и высвобождение иона.
Свободный антибиотик способен диффундировать обратно, связать очередной ион и тоже перенести его через мембрану. И так много раз. За 1с молекула антибиотика может пересечь мембрану в обоих направлениях до 1000 раз и, соответственно, перенести около 500 ионов.
б) Каналообразователи (грамицидин А и др.). Основа грамицидина А — линейный полипептид, все 15 аминокислотных остатков которого содержат исключительно гидрофобные радикалы. С одним концом полипептида связан этаноламин, а с другим — формильная группа.
М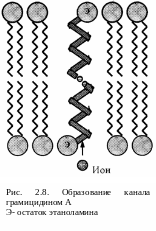 олекулы
этого соединения обратимо объединяются
в спирализованные
димеры, которые
способны встраиваться в мембраны (рис.
2.8). В димере остатки этаноламина играют
роль гидрофильных «головок», а пептидные
-спирали
— гидрофобных «хвостов», пронизывающих
всю неполярную фазу мембраны.
олекулы
этого соединения обратимо объединяются
в спирализованные
димеры, которые
способны встраиваться в мембраны (рис.
2.8). В димере остатки этаноламина играют
роль гидрофильных «головок», а пептидные
-спирали
— гидрофобных «хвостов», пронизывающих
всю неполярную фазу мембраны.
Однако, в отличие от жирнокислотных «хвостов», эти спирали формируют в своем внутреннем пространстве гидрофильный канал: его стенки выстланы полярными группами, образующими пептидные связи (-NН—СО-). Размеры канала таковы, что по нему могут перемещаться через мембрану небольшие (одновалентные) ионы. При этом участок канала, где в данный момент находится ион, временно становится шире и короче (как при перемещении комка пищи по пищеводу).
Канал остается открытым в течение примерно 1с (после чего, видимо, димер распадается и молекулы антибиотика вступают в новые взаимодействия друг с другом). За это время через канал может пройти ~107 ионов, т.е. скорость переноса здесь гораздо выше, чем в случае подвижных переносчиков.
Не исключено, что нативные ионные каналы (Nа+-каналы, К+-каналы и т.д.) в некоторых деталях своего строения и функционирования напоминают грамицидиновые димеры.
2.2. Активный транспорт
При активном транспорте вещество проходит через мембрану с помощью специального транспортного белка, но против градиента своей концентрации, т.е. из отдела с меньшей концентрацией в отдел с большей концентрацией. Такое перемещение требует затрат энергии. Следовательно, транспортная система должна осуществлять и энергетическое обеспечение переноса. Данная проблема решается разными способами.
Происходит сопряжение переноса вещества с энергодающей реакцией. Как правило, такой реакцией служит гидролиз АТФ.
а) В простейшем варианте сама транслоказа обладает АТФазной активностью. Например Са2+ насос, закачивающий ионы Са2+ в цистерны саркоплазматического ретикулума.
б) В других случаях к гидролизу АТФ приводит более сложная совокупность реакций, сопряженных с переносом вещества. Пример – транспорт аминокислот в эпителиальные клетки кишечника в процессе всасывания (рис.2.9).
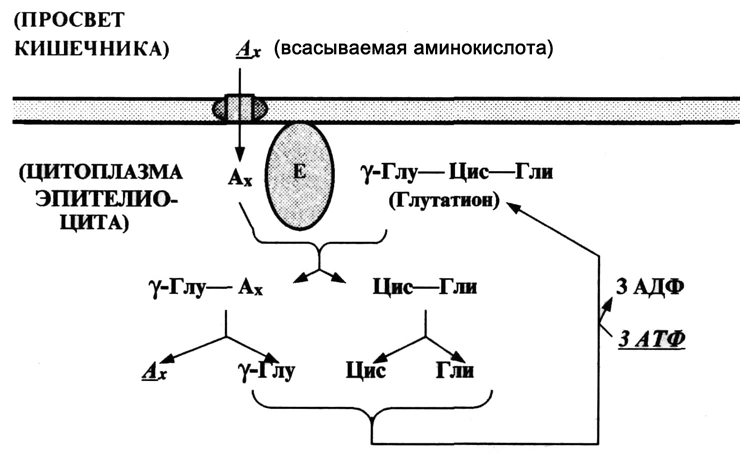
Рис. 2.9. Механизм всасывания аминокислот в кишечнике (с некоторыми упрощениями)
Е – связанная с мембраной -глутамилтрансфераза
В данном случае аминокислота, прошедшая с помощью транслоказы через мембрану, сразу же реагирует с трипептидом глутатионом – так, что образуются два дипептида. Тем самым снижается концентрация данной аминокислоты в примембранном пространстве клетки, что облегчает диффузию через мембрану новых порций аминокислоты. Затем происходит серия экзергоничеких реакций (т.е. реакций, идущих с выделением энергии):
- распад обоих дипептидов и
- ресинтез глутатиона с затратой трех молекул АТФ.
В результате получается, что для всасывания 1 молекулы аминокислоты расходуется энергия 3 молекул АТФ (≈ 150 кДж/моль аминокислоты). Этой энергии более чем достаточно для преодоления концентрационного барьера.
в) Кроме гидролиза АТФ, непосредственным источником энергии для активного транспорта может быть окислительно-востанновительный процесс. Такой процесс происходит в митохондриях (рис.2.10).
В ходе перемещения электронов по дыхательной цепи выделяется энергия, которая служит для откачки протонов из матрикса митохондрий в межмембранное пространство через внутреннюю митохондриальную мембрану.
Тем самым создается протонный градиент, энергия которого затем используется для синтеза АТФ в ходе обратного перемещения протонов в матрикс по градиенту концентрации через другую транспортную систему – т.н. АТФазу.

Рис. 2.10. Преобразование энергии окислительно-восстановительных реакций
в энергию протонного градиента
ММП – межмембранное пространство митохондрии
ФМН, Q, b, c1, c, a и a3 – компоненты цепи переноса электронов
2. Второй принципиальный механизм энергообеспечения активного транспорта – сопряжение переноса вещества Х против градиента концентрации с пассивным переносом другого вещества Y по градиенту концентрации. В этом случае высвобождение энергии в ходе перемещения Y должно превышать затраты энергии в ходе перемещения Х. Осуществить это можно двумя путями: путем симпорта и антипорта (рис.2.11).

Рис. 2.11. Сопряжение транспорта двух веществ
В случае симпорта оба вещества переносятся транслоказой в одну сторону. Т.е. молекулы Y, диффундируя по градиенту своей концентрации, как бы тянут вместе с собой соединение Х.
Таков, в частности, механизм реабсорбции глюкозы в канальцах почек: она проникает в эпителиальную клетку путем симпорта с ионами Na+.
Если оба вещества, участвующие в симпорте, являются ионами, то они имеют разноименные заряды.
В случае антипорта вещества переносятся транслоказой во взаимно противоположных направлениях. Т.е. молекулы Y как бы обмениваются на молекулы Х. Если в этом случае вещество Y диффундирует по градиенту концентрации, то система наз. АТФ-независимым антипортом. У эукариот такой антипорт используется очень редко. Гораздо более распространена система, где путем антипорта сразу оба вещества перемещаются против градиента своей концентрации. Такая система наз. АТФ-зависимым антипортом. При этом транспортируемые ионы имеют одноименные заряды.
Примером такого антипорта является Na+, K+-насос или Na+, K+-зависимая АТФаза присутствующая в плазмолемме почти всех клеток.
2.2.1. Структура и принцип действия Na+, K+-насоса.
 Na+,
K+-насос
является белком состоящим из двух -
(по 95 000 Да) и двух -(по
40 000 Да) субъединиц. Используя энергию
АТФ он переносит ионы Na+
и K+
против градиента их концентрации: ионы
Na+
- из клетки, а ионы K+-
в клетку. Именно благодаря деятельности
этого насоса создается резко асимметричное
распределение данных ионов между
клеточной и внутриклеточной средой.
Концентрация ионов Na+
значительно выше вне клеток, а ионов
K+-
внутри клеток (таблица 2.2). Важной
особенностью деятельности насоса
является то, что за счет распада 1 молекулы
АТФ происходит выкачивание 3 ионов Na+
и одновременно закачивание в клетку 2
ионов K+.
Na+,
K+-насос
является белком состоящим из двух -
(по 95 000 Да) и двух -(по
40 000 Да) субъединиц. Используя энергию
АТФ он переносит ионы Na+
и K+
против градиента их концентрации: ионы
Na+
- из клетки, а ионы K+-
в клетку. Именно благодаря деятельности
этого насоса создается резко асимметричное
распределение данных ионов между
клеточной и внутриклеточной средой.
Концентрация ионов Na+
значительно выше вне клеток, а ионов
K+-
внутри клеток (таблица 2.2). Важной
особенностью деятельности насоса
является то, что за счет распада 1 молекулы
АТФ происходит выкачивание 3 ионов Na+
и одновременно закачивание в клетку 2
ионов K+.
Важная особенность деятельности насоса – характерная стехиометрия: за счет распада 1 молекулы АТФ происходит выкачивание 3 ионов Na+ и одновременно закачивание в клетку 2 ионов К+. Расчеты показывают, что при этом рассеивается только 10% энергии АТФ; остальные же 90% преобразуются в энергию концентрационных градиентов. Такая эффективность преобразования энергии, очевидно, является очень высокой.
Рассмотрим принцип действия насоса. Установлено, что 4 субъединицы насоса объединены в единый комплекс с образованием полости. В начале очередного цикла работы насоса полость открыта с внутренней стороны мембраны, где ее заполняют 3 иона Na+. Для преодоления электрического отталкивания между ионами требуется энергия.
Таблица 2.2. Распределение ионов между внешней и внутренней средой в мышечной ткани
|
сex (мэкв/л) |
сin (мэкв/л) |
K+ Na+ Mg2+ Ca2+ |
4 145 2 4 |
155 10 30 0 |
ИТОГО |
155 |
195 |
Cl- HCO3- Белкиz- SO42- HPO42- Орг. к-ты |
113 30 1 1 2 8 |
2 8 65 18 42(?) 60 (?) |
ИТОГО |
155 |
155 |

Видимо, непосредственно на это и расходуется АТФ. Действительно, связывание ионов Na+ инициирует гидролиз молекулы АТФ. Однако этот гидролиз не только энергетически обеспечивает первую стадию цикла, но и, в свою очередь, инициирует следующую стадию. Так, фосфатная группа переносится от АТФ на белок, что изменяет его конформацию. В результате полость с ионами Na+ открывается с другой стороны мембраны – наружной. Сила электрического отталкивания между ионами заставляет их высвобождаться во внеклеточную среду, несмотря на высокую их концентрацию здесь. Вместо ионов Na+ полость заполняют 2 иона K+. Вероятно, меньшее количество этих ионов обусловлено просто тем, что они крупнее. Другое объяснение может состоять в том, что для двух ионов гораздо меньше сила электрического отталкивания. И, наконец, по третьей точке зрения, дело не в размерах полости и ионов, а в числе связывающих центров у насоса: для Na+ их -3, а для K+- 2.
Связывание ионов K+ инициирует дефосфорилирование транслоказы. Это, с одной стороны, видимо, высвобождает остатки энергии АТФ, сохранявшиеся в связи фосфатной группы. А, с другой стороны, дефосфорилирование возвращает конформацию транслоказы в исходное состояние: ее полость вновь открывается с внутренней стороны мембраны, отчего здесь высвобождаются ионы K+ . Так завершается цикл работы насоса.
Имеется важная группа лекарственных средств, которые тормозят действие Na+,К+-насоса. Это сердечные гликозиды (алкалоиды наперстянки). Они конкурируют с ионами К+ за связывание с транслоказой с ее наружной стороны.
Более всего действие данных средств проявляется в отношении сердечной мышцы. Поэтому в саркоплазме кардиомиоцитов возрастает концентрация Na+. Это снижает возбудимость миокарда. Одновременно увеличивается и концентрация ионов Са2+ (видимо, из-за того, что их транспорт из клетки происходит в обмен на внеклеточные ионы Ка+, так что при большей внутриклеточной концентрации Na+ обмен происходит слабее). Ионы же Са2+ повышают сократимость миокарда. В итоге сокращения сердца становятся более редкими и более сильными.
2.2.2. Система транспорта ионов Са2+ в поперечнополосатой мышечной ткани.
Данная система служит еще одним примером активного транспорта низкомолекулярных веществ. Согласно табл. 2.2, в цитоплазме клеток — крайне низкая концентрация свободных (т.е. не связанных с белками) ионов Са2+. В поперечнополосатой мышечной ткани (скелетной и сердечной) это достигается за счет деятельности двух насосов (рис. 2.13).

Рис. 2.13. Системы транспорта ионов в поперечнополосатой мышечной ткани
Один — Nа+-зависимый Са2+-насос — вероятно, находится в плазмолемме и откачивает ионы Са2+ во внеклеточную среду.
По всей видимости, при этом происходит обмен каждого иона Са2+ на 2 иона Nа+, которые поступают в клетку по градиенту своей концентрации. Таким образом, это тот относительно редкий у эукариот случай, когда для энергообеспечения активного транспорта используется антипорт ионов.
Но гораздо большее значение имеет второй насос, который обычно называют просто Са2+-насосом. Он локализован в мембранах саркоплазматического ретикулума, располагаясь с плотностью от 10 000 до 20000 1/мкм2 и составляя около 90% от общей массы белков этих мембран.
Данный насос закачивает ионы Са2+ из саркоплазмы в цистерны саркоплазматического ретикулума, где они связываются белком кальсеквестрином. В процессе транспорта преодолевается примерно 10 000-кратная разность концентраций ионов Са2+. Источником энергии служит АТФ, отчего второе название данного насоса — Са2+-зависимая АТФаза.
Распад 1 молекулы АТФ обеспечивает перенос в цистерну 2-х ионов Са2+. Такая стехиометрия означает, что в энергию концентрационного градиента переходит 90% энергии концевой макроэргической связи АТФ.
Са2+-насос по структуре похож на Nа+, К+-насос: он тоже содержит 2 большие субъединицы по 95 000 Да и 2 гликопротеиновые субъединицы по 50000 Да.
В саркоплазматических мембранах имеется еще одна транспортная система — Са2+-каналы. Когда мышца не возбуждена, эти каналы закрыты.
При возбуждении мышечного волокна или кардиомиоцита Са2+-каналы открываются. Индуцирующий это сигнал передается от сарколеммы и далее по Т-трубочкам (инвагинациям сарколеммы) на контактирующие с последними мембраны ретикулума. Однако конкретный механизм передачи неясен.
Через открытые каналы ионы Са2+ активно выходят в саркоплазму: за импульс — примерно по 120 ионов в расчете на 1мкм2 саркоплазматической мембраны. Так как общая площадь саркоплазматических мембран весьма высока, а исходная концентрация ионов Са2+ в саркоплазме была очень низкой, то в итоге их концентрация здесь возрастает в 100 раз.
Благодаря этому активируется взаимодействие тонких и толстых миофиламентов в миофибриллах — последние начинают сокращаться.
По окончании процесса Са2+-каналы закрываются, и избыток ионов Са2+ вновь откачивается Са2+-насосом из саркоплазмы в саркоплазматические цистерны.
Из вышеизложенного следует, что внеклеточный и внутриклеточный Са2+ оказывает на сократимость мышц противоположное влияние.
Так, внеклеточный Са2+, затрудняя открытие Nа+-каналов, понижает возбудимость мембран и тем самым, очевидно, уменьшает число сокращений. При снижении же внеклеточной концентрации Са2+ наблюдаются судороги.
Напротив, внутриклеточный Са2+ необходим для сокращения, и при снижении его концентрации сокращения ослабевают или прекращаются.
