
Лекции по оптике и ядерной физике
.pdf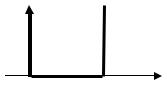
§ 4. Квантование энергии. Частица в одномерной прямоугольной потенциальной яме
В теории дифференциальных уравнений доказывается, что уравнения такого вида, как уравнение Шрёдингера, имеют решения не при любых значениях параметра W , а лишь при так называемых собственных значениях параметра. Функции ψ, удовлетворяющие уравнению Шрёдингера, называются собствен-
ными функциями. Решение уравнения Шрёдингера в общем случае представляет собой весьма трудную задачу. Рассмотрим пример, позволяющий достаточно просто решить это уравнение.
U |
|
|
Допустим, что электрон |
движется в потенциальном |
|
|
|
поле, изображенном на рис. 34. При этом потенциаль- |
|
|
|
x |
ная энергия электрона имеет следующие значения: |
|
х=0 |
x =l |
U =0 при 0 ≤x ≤l ; |
U = ∞ при x <0 и x >l . |
|
Рис. 34 |
|
Подобное поле называется “потенциальной ямой”. |
||
|
|
|
Примером движения |
электрона в “потенциальной |
яме” может служить движение свободного электрона внутри металла. Вне металла потенциальная энергия электрона считается равной нулю, а внутри металла она отрицательна и численно равна работе выхода электрона из металла. Применим к электрону, движущемуся в “потенциальной яме” уравнение Шрёдингера,
учитывая, что для одномерной задачи ∆ψ = |
∂2 |
ψ |
: |
||||
∂x2 |
|||||||
∂2ψ |
|
2m |
|
|
|||
+ |
(W −U)ψ = 0 . |
||||||
∂x2 |
h2 |
||||||
|
|
|
|
|
|||
За пределы потенциальной ямы частица попасть не может, поэтому вероятность обнаружить частицу, а, следовательно, и функция ψ за пределами ямы рав-
на нулю. Из условия непрерывности следует, что функция ψ должна быть равна нулю и на границах ямы, т.е.:
ψ(0) =0 ; |
ψ(l) =0 . |
(3.9) |
Выражения (3.9) и определяют те условия, которым должны удовлетворять решения данного уравнения. Внутри ямы U =0 и уравнение для этой области принимает вид:
|
|
∂2ψ |
+ |
2m |
Wψ=0 . |
(3.10) |
|
|
|
∂x2 |
h2 |
||||
|
|
|
|
|
|
||
Введя обозначение |
2mW |
=k2 , |
|
(3.11) |
|||
|
|
||||||
|
|
h2 |
|
|
|
|
|
получим уравнение, хорошо известное из теории колебаний:
ψ&& +k2ψ = 0 .
41
Решения такого уравнения имеют вид:
ψ(x) = A..sin..(kx +α) .
Здесь k имеет смысл волнового числа волны де Бройля для электрона. Условия (3.9) можно удовлетворить соответствующим выбором постоянных k и α. Преж-
де всего из условия ψ(0) =0 , получаем: |
|
ψ(0) = A..sin..α = 0 α=0. |
|
Выполнение условия ψ(l) = A..sin kl = 0 возможно лишь в случае, если |
|
kl =±nπ (n =1, 2, 3K) |
(3.12) |
( A = 0, n = 0 отпадают, так как при этом получается, |
что ψ≡0 , т.е. частица ни- |
где не находится). |
|
Из уравнений (3.11) и (3.12) получим: |
|
|
k2 = |
2mW |
= |
n2 |
π2 |
||
|
|
|
n |
|
, |
||
|
|
|
h |
2 |
|
l2 |
|
|
|
|
|
|
|||
отсюда |
W = |
n2π2h2 |
, |
(3.13) |
|||
|
|
|
|||||
|
n |
|
2ml |
2 |
|
|
|
|
|
|
|
|
|||
где n =1, 2, 3K – квантовое число, |
Wn |
– значения энергии, соответствующие |
|||||
различным числам n . |
|
|
|
|
|
|
|
Вывод: решения уравнения (3.10) будут иметь физический смысл не при |
|||||||
всех значениях энергии |
W , а лишь при дискретных значениях Wn , удовлетво- |
||||||
ряющих равенству (3.13). Физические величины, которые могут принимать лишь определенные дискретные значения, называются квантованными.
Таким образом, энергия электрона, находящегося в потенциальной яме, является квантованной. Каждому значению квантового числа n соответствует определенный уровень энергии Wn или энергетический уровень.
42
Тема 2. Элементы современной физики атомов и молекул
§1. Атом водорода
Ватоме водорода или водородоподобном ионе потенциальная энергия элек-
трона:
U = − Ze2 , 4πε0r
где Ze – заряд ядра;
r – расстояние между ядром и электроном. Уравнение Шредингера в этом случае имеет вид:
∆ψ + 2m (W + Ze2 )ψ = 0 .
h2 4πε0r
Уравнение (3.15) имеет решения только при собственных значениях энергии
(3.14)
(3.15)
W = − |
1 |
R h Z2 , |
(3.16) |
|
|||
n |
n2 |
|
|
|
|
|
где R – постоянная Ридберга,
n =1, 2, 3,K – квантовое число.
Функция U(r), рассчитанная по формуле (3.14) показана на рис. 35. На рис. 35 показаны также возможные дискретные значения энергии Wn , рассчитанные по формуле (3.16):
W, U |
|
Уровень W1 , отвечающий минимально воз- |
|
W >0 |
можной энергии – основной, все остальные – |
||
0 |
|
r возбужденные. При W < 0 электрон находит- |
|
|
|||
Wn |
|
ся внутри гиперболической потенциальной |
|
|
ямы, он является “связанным”. Из рис. 35 сле- |
||
W3 |
|
||
|
дует, что по мере роста числа n энергетиче- |
||
W2 |
|
ские уровни располагаются теснее и |
при |
|
n = ∞ W∞ = 0 . При W > 0 движение |
элек- |
|
|
|
||
W1 |
|
трона является “свободным” – он может уйти |
|
|
|
в бесконечность. Это соответствует ионизиро- |
|
ванному атому.
Рис. 35
§2. Квантовые числа
Вквантовой механике доказывается, что уравнению Шредингера удовлетворяют собственные функции ψnlm , определяемые тремя квантовыми числами:
главным n, орбитальным l и магнитным m.
43
Главное квантовое число n, согласно формуле (3.13),определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы: n =1, 2, 3,K.
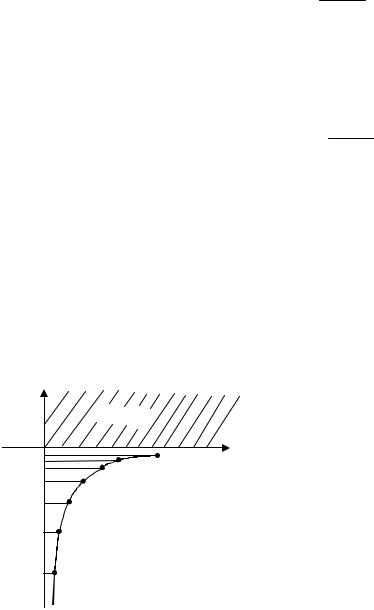
Из решения уравнения Шредингера вытекает, что механический орбитальный момент импульса электрона (далее просто момент импульса) квантуется, т.е. принимает дискретные значения, определяемые формулой
L = h l (l +1) . |
(3.17) |
Здесь
чения
z
2h
h
0
h
2h
l – орбитальное квантовое число, которое при заданном n принимает зна-
l = 0, 1,K(n −1).
m =2
r m =1
L
m =0
m =−1 m =−2
Рис. 36
При этом вектор L момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Lz на направление z внеш-
него магнитного поля принимает квантованные значения, кратные h:
Lz =hm , |
(3.18) |
где m – магнитное квантовое число, имеющее значения m = 0, ±1, ± 2,K± l (всего 2l +r1значений).
Возможные направления вектора L относительно оси z для случая l = 2 показаны на рис. 36. Это так называемое пространственное квантование.
§ 3. Опыт Штерна и Герлаха. Спин электрона. Спиновое квантовое число
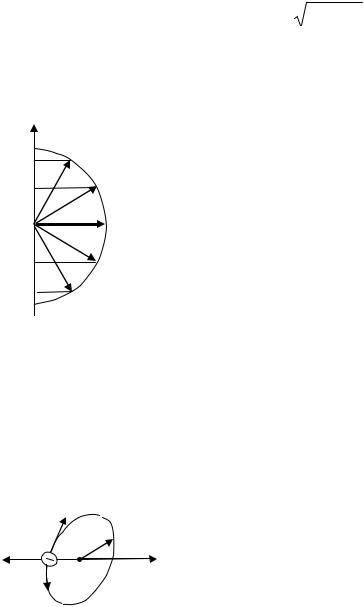
Допустим, что электрон в атоме движется по орбите радиуса r . Магнитный момент создаваемого электроном тока
r |
r |
|
|
|
|
pm = is = eνπr2 , |
|
V |
r |
где ν – частота вращения электрона. |
|
||||
L |
υ= 2πrν. В то же |
||||||
|
|
r |
Скорость движения электрона |
||||
|
i |
pm |
время движущийся по орбите электрон обладает момен- |
||||
|
|
том импульса, направление которого противоположно |
|||||
|
Рис. |
37 |
направлению магнитного момента |
(см. рис. 37). |
|||
|
|
|
В соответствии с формулой L = meυr |
||||
|
|
|
L = me |
2πr2 ν = 2pmme . |
|
||
|
|
|
|
|
|
e |
|
Отсюда |
|
pm = |
|
eL |
. |
(3.19) |
|
|
|
|
|||||
|
|
|
|
|
2me |
|
|
44
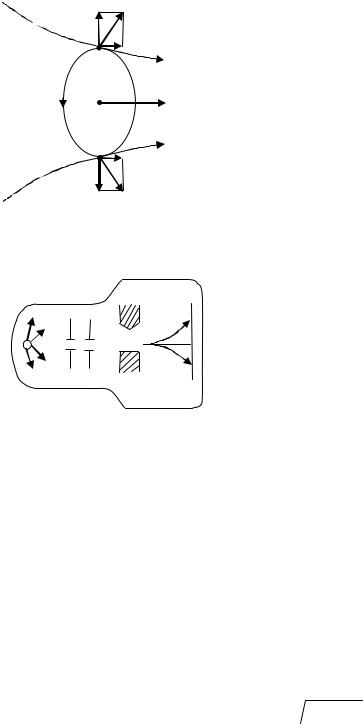
Так как момент импульса квантуется (см. формулу (3.17)) должен квантоваться и магнитный момент. Для проверки этого в 1922 г. О. Штерном и В. Герлахом был поставлен опыт, идея которого состоит в следующем.
|
|
dF |
|
В неоднородном магнитном поле на каждый эле- |
|
|
|
|
мент контура с током, создаваемым электроном, |
||
|
|
dFr |
r |
будет действовать сила dF B (рис. 38). Состав- |
|
|
|
c |
B |
ляющая силы dF , сдвигает атом в сторону увели- |
|
|
|
|
|
r |
c |
|
i |
|
|
чения или ослабления поля (это зависит от ориен- |
|
|
|
|
pm |
тации вектора магнитного момента pm ). Схема |
|
|
|
|
|
r |
|
|
|
|
|
опыта показана на рис. 39. В трубке, где был создан |
|
|
|
r |
B |
||
|
|
dF |
|
вакуум, помещался источник атомов K – нагревае- |
|
|
|
rc |
|
мый до высокой температуры серебряный шарик. |
|
|
|
dF |
|
Из потока атомов с помощью щелевых диафрагм D |
|
|
Рис. 38 |
|
вырезался узкий пучок, проходящий через сильное |
||
|
|
неоднородное магнитное поле, направленное пер- |
|||
|
|
|
|
|
|
|
|
|
|
|
пендикулярно пучку и создаваемое специальным |
|
|
N |
F |
электромагнитом SN . Приемником атомов серебра |
|
|
D D |
|
служила фотопластинка F . Опыт Штерна и Герлаха |
||
K |
|
|
|
подтвердил пространственное квантование магнит- |
|
|
|
|
|
||
|
|
|
|
ного момента атома, но имел ещё и неожиданные |
|
|
S |
|
|||
|
|
|
|||
|
|
|
результаты: атомный пучок расщеплялся на две |
||
|
|
|
|
|
компоненты и в том случае, когда атомы нахо- |
|
Рис. 39 |
|
дились в основном состоянии, в котором l =0; в |
||
|
|
этом случае в соответствии с формулами (3.17), |
|||
|
|
|
|
|
(3.19) L =0, pm =0 и атомный пучок не должен |
был раздваиваться.
Для объяснения этих результатов Дж. Уленбек и С. Гаудсмит в 1925 г. вы-
двинулиrгипотезу о том, что у электрона кроме орбитального магнитного момента pm имеется собственный магнитный момент pms и соответствующий
ему собственный механический момент импульса Ls , называемый спином элек-
трона. Спин является таким же неотъемлемым свойством электрона как его заряд и масса.
Из общих выводов квантовой механики следует, что спин Ls и его проекция на ось z Lsz должны быть квантованы (сравните с формулами (3.17), (3.18)):
Ls = h s(s +1) ;
s(s +1) ;
Lsz = msh
r
и вектор Ls может иметь 2s +1 различных ориентаций в магнитном поле. Опыт Штерна и Герлаха показывает, что для спина электрона таких ориентаций суще-
ствует всего две, так что 2s +1 = 2 и s = 1 |
. Число s называется спиновым кван- |
2 |
|
45
товым числом, a ms – магнитным спиновым квантовым числом, которое в от-
личие от s может принимать два значения: ms = ± 12 . Однако часто числа s и
ms не различают и говорят о спиновом квантовом числе ms = ± 12 . Предположе-
ние о спине было подтверждено большим количеством опытных данных. Оно позволило объяснить магнитные свойства ферромагнетиков и создать современную теорию ферромагнетизма.
§ 4. Принцип Паули
Хотя энергия электрона зависит только от главного квантового числа n (формула (3.13)), каждому значению Wn (кроме W1 ) соответствует несколько
волновых функций ψnlm , отличающихся значениями квантовых чисел l и m .
Следовательно, электрон в атоме может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Количество таких состояний опреде-
ляется принципом Паули: в одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью четырех квантовых чисел: n , l , m , ms .
Совокупность электронов в атоме, имеющих одно и то же квантовое число n, называется электронной оболочкой. В каждой из оболочек электроны подразделяются по подоболочкам, соответствующим данному значению l . Состояние электрона в атоме часто обозначают двумя индексами: значением n и буквой, отвечающей значению l , например:
1s (n =1; l = 0); |
2s (n = 2; l = 0) |
2p (n = 2; l =1); |
3d (n = 3; l = 2) и т.д. |
В соответствии с принципом Паули, учитывая, что квантовые числа могут принимать значения (см. формулы (3.17),(3.18)): l = 0, 1,K(n −1) и
m = 0, ±1, ± 2,K± l , а число ms может иметь два значения, расположение электронов по оболочкам и подоболочкам представим в виде табл. 1:
46
|
|
|
|
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
|
|
|
|
|
Уровень |
Символ |
|
Квантовые числа |
|
Символ |
Максимальное кол-во |
||||
энергии |
оболоч- |
|
|
|
|
|
подоболочки |
электронов |
|
|
|
ки |
|
|
|
|
|
|
|
|
|
|
n |
|
l |
m |
ms |
|
в подоб-ке |
в обол-ке |
|
|
W1 |
К |
1 |
|
0 |
0 |
↑↓ |
1s |
2 |
2 |
|
|
|
|
|
0 |
0 |
↑↓ |
2s |
2 |
|
|
W2 |
L |
2 |
|
1 |
– 1 |
↑↓ |
|
6 |
8 |
|
|
0 |
↑↓ |
2p |
|
||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
+ 1 |
↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0 |
↑↓ |
3s |
2 |
|
|
|
|
|
|
|
– 2 |
↑↓ |
3p |
|
|
|
|
|
|
|
1 |
– 1 |
↑↓ |
6 |
|
|
|
W3 |
М |
3 |
|
|
0 |
↑↓ |
|
|
18 |
|
|
|
– 2 |
↑↓ |
|
|
|
||||
|
|
|
|
|
– 1 |
↑↓ |
3d |
10 |
|
|
|
|
|
|
2 |
0 |
↑↓ |
|
|
||
|
|
|
|
|
+1 |
↑↓ |
|
|
|
|
|
|
|
|
|
+2 |
↑↓ |
|
|
|
|
и т.д.
Принцип Паули сыграл большую роль в развитии современной атомной и ядерной физики, без него невозможно создание теории твердого тела, с его помощью была теоретически обоснована периодическая система элементов Менделеева. Проследим построение этой системы. Будем считать, что каждый последующий элемент образован из предыдущего путем прибавления к ядру одного протона и соответственно прибавления одного электрона в электронной оболочке атома с учетом принципа Паули (см. табл. 2):
|
|
|
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Период |
Заряд |
Элемент |
|
Оболочки и подоболочки |
|
|
||||
К |
L |
|
|
М |
|
|
||||
|
ядра |
|
|
|
|
|
|
|
|
|
|
|
1s |
2s |
|
2p |
3s |
3p |
3d |
|
|
|
|
|
|
|
||||||
I |
1 |
H |
1 |
|
|
|
|
|
|
|
|
2 |
He |
2 |
|
|
|
|
|
|
|
|
3 |
Li |
2 |
1 |
|
|
|
|
|
|
|
4 |
Be |
2 |
2 |
|
|
|
|
|
|
II |
5 |
B |
2 |
2 |
|
1 |
|
|
|
|
|
… |
… |
… |
… |
|
… |
|
|
|
|
|
10 |
Ne |
2 |
2 |
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
11 |
Na |
2 |
2 |
|
6 |
1 |
|
|
|
|
|
… |
… |
… |
|
… |
… |
… |
… |
|
47
Тема 3. Вынужденное излучение
§ 1. Поглощение, спонтанное и вынужденное излучения
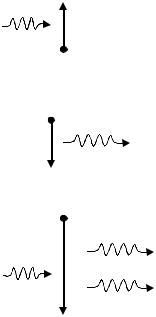
Если атом находится в основном состоянии с энергией W1 , то под действием
внешнего излучения может осуществиться переход его в возбужденное состояние с энергией W2 , приводящий к поглощению внешнего излучения (рис. 40а). Время
а) поглощение |
|
|
|
нахождения атома в возбужденном состоянии |
|||||||
|
|
|
порядка 10−8 с, после чего он самопроизвольно |
||||||||
|
|
|
W2 |
переходит в нормальное, невозбужденное со- |
|||||||
hν |
|||||||||||
|
|
|
стояние, |
излучая |
квант света |
с |
энергией |
||||
|
|
|
W1 |
hν = W2 − W1 . Такое излучение |
|
называется |
|||||
|
|
|
спонтанным (рис. 40б). Оно не когерентно, так |
||||||||
б) спонтанное излучение |
|||||||||||
как спонтанные переходы взаимно не связаны. В |
|||||||||||
|
|
|
|
W2 |
1916 г. А. Эйнштейн показал, что если на атом, |
||||||
|
|
|
|
hν |
находящийся в возбужденном состоянии, дейст- |
||||||
|
|
|
|
вует внешнее излучение с частотой, удовлетво- |
|||||||
|
|
|
|
W1 |
|||||||
|
|
|
|
ряющей |
условию |
hν = W2 − W1 , |
то |
возникает |
|||
|
|
|
|
||||||||
в) вынужденное излучение |
вынужденный переход в основное состояние. |
||||||||||
|
|
|
|
|
W |
||||||
|
|
|
|
2 |
При этом происходит излучение атомом фотона |
||||||
|
|
|
|
hν |
дополнительно к тому фотону, под действием |
||||||
hν |
|
hν |
которого произошел переход. Это так называе- |
||||||||
|
мое вынужденное излучение |
(рис 40в). А. |
|||||||||
|
|
|
|
||||||||
|
|
|
|
|
W1 |
Эйнштейн и П. Дирак показали, что вынужден- |
|||||
|
|
Рис. 40 |
|
|
ное излучение строго когерентно с вынуждаю- |
||||||
|
|
|
|
|
щим, т.е. оно имеет такую же частоту, фазу, по- |
||||||
|
|
|
|
|
|
ляризацию и направление излучения. |
|
||||
Эффект вынужденного излучения лежит в основе квантового генератора электромагнитных волн, за разработку которого советским физикам Н.Г. Басову, А.М. Прохорову и американцу Ч. Таунсу присуждена Нобелевская премия в
1964г.
§ 2. Принцип работы оптического квантового генератора (ОКГ) – лазера
LAZER – первые буквы английского названия “усиление света с помощью вынужденного излучения”. Первый лазер был создан в 1960 г. Рабочим телом лазера был цилиндр из рубина. На торцы рубина наносятся зеркала – с одной стороны непрозрачное, с другой – полупрозрачное. Рубин представляет собой окись алюминия Al2O3 , окрашенную примесью хрома. Активным веществом, в кото-
ром осуществляются вынужденные переходы, являются в рубине ионы хрома. В лазере рубин освещается импульсной ксеноновой лампой. До начала импульса освещения, ионы хрома находятся в основном состоянии. Свет лампы переводит большинство ионов хрома в возбужденное состояние. Процесс начинает развиваться, когда возбужденные ионы, переходя в нормальное состояние, спонтанно
48
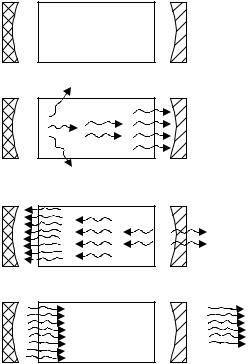
а)
1 Рубин
б) |
В |
|
|
1 |
А |
|
|
|
С |
в) |
|
1 |
|
г)
1
Рис. 41
излучают фотоны в направлении, параллельном оси активной среды (фотон А на рис.
241). Фотоны, испущенные по другим направлениям, выходят из кристалла (фотоны
Ви С). Фотон А, движущийся параллель-
но оси активной среды, рождает лавину фо-
2тонов, летящих в том же направлении. Часть этой лавины пройдет через полупрозрачное зеркало 2 наружу, а часть отразится и будет
|
|
нарастать в активной среде. После отраже- |
||
|
|
ния от зеркала 1 усиленный поток фотонов |
||
|
2 |
будет двигаться так же, как и первоначаль- |
||
|
ный фотон А. Многократно усиленный по- |
|||
|
|
|||
|
|
ток |
фотонов, вышедший |
из ОКГ сквозь |
|
|
полупрозрачное зеркало 2 создает луч света |
||
2 |
|
большой интенсивности. |
|
|
|
|
Кроме рассмотренного |
твердотельного |
|
 ОКГ в настоящее время разработано много других типов лазеров (из наиболее известных 17 типов): газовые, ионные, на парах металлов, молекулярные (СО2 ,СО), полу-
ОКГ в настоящее время разработано много других типов лазеров (из наиболее известных 17 типов): газовые, ионные, на парах металлов, молекулярные (СО2 ,СО), полу-
проводниковые и т.д. Последние имеют очень малые размеры. Лазеры могут работать как в импульсном, так и в непрерывном режимах в широком диапазоне длин волн: от рентгеновского до инфракрасного.
Свойства лазерного излучения:
1.Когерентность.
2.Монохроматичность.
3.Возможность получения большой мощности излучения (1013 Вт и более).
4.Малое угловое расхождение луча.
Необычные свойства лазерного излучения находят в настоящее время очень широкое применение, в частности:
–в волоконно-оптических линиях связи,
–в военном деле,
–в хирургии,
–для обработки твердых материалов,
–для создания сверхвысоких температур, и др. применения.
49

Тема 4. Элементы квантовой физики твердого тела
§ 1. Понятие о зонной теории твердого тела
1. Энергетические зоны.
Зонная теория квантовой механики твердых тел позволяет с единой точки зрения объяснить электрические, тепловые и др. свойства этих тел. Пока атомы вещества изолированы друг от друга, они обладают дискретными энергетическими уровнями. Объединение N атомов в кристалл приводит к тому, что энергетические уровни атомов расщепляются и расширяются в зоны.
Определим ширину энергетического уровня в изолированном атоме. Время нахождения электрона в возбужденном состоянии, т.е. на новом энергетическом
уровне, ∆t ≈10−8 c . Воспользуемся соотношением неопределенностей Гейзенберга для энергии (формула (3.4)) ∆W∆t ≥h и найдем неопределенность в энергетическом состоянии электрона
∆W = |
h |
= |
|
6,62 10−34 |
≈ 4 10−7 эВ. |
|
∆t |
1,6 10−19 10−8 |
|||||
|
|
|
||||
Аналогичный расчет произведем и для твердого тела. В кристалле валентные электроны атомов, связанные слабее с ядрами, чем внутренние электроны, могут переходить от атома к атому. Это приводит к тому, что среднее время жизни τ валентного электрона в данном атоме существенно уменьшается и составляет
примерно 10−15 c . Тогда неопределенность в значении энергии таких электронов:
∆W = |
h |
= |
|
6,62 10−34 |
≈ 4 эВ. |
|||
τ |
1,6 10−19 |
|
10−15 |
|||||
|
|
|
||||||
Следовательно, ширина энергетической зоны атома в кристалле примерно в 107 раз больше естественной ширины энергетического уровня в изолированном атоме. Однако такое большое расширение энергетического уровня касается только
W |
|
|
валентных |
электронов. |
Расширение |
|
|
энергетических уровней |
внутренних |
||
|
|
||||
|
|
||||
зоны |
|
|
электронов несравненно меньше, так |
||
|
|
||||
|
|
||||
|
|
||||
|
зоны |
как для них величина потенциального |
|||
|
|||||
|
барьера увеличивается и резко умень- |
||||
|
|||||
|
|||||
разрешенные |
|
запрещенные |
|||
|
шается вероятность перехода такого |
||||
|
|
|
|||
|
|
|
|||
|
|
|
электрона от одного атома к другому |
||
|
|
|
(рис. 42). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Зоны, образовавшиеся из дозво- |
||
|
|
|
ленных энергетических уровней, назы- |
||
|
|
|
ваются разрешенными зонами. Между |
||
|
|
|
|||
|
|
|
|||
|
Рис. 42 |
|
ними находятся энергетические про- |
||
|
|
межутки, |
не имеющие |
разрешенных |
|
|
|
|
|||
значений энергии. Эти промежутки называются запрещенными зонами. 2. Деление твердых тел на металлы, диэлектрики и полупроводники.
50
