
- •1. Введение в химическую термодинамику.
- •1.2. Термохимия. Тепловые эффекты химических реакций. Закон Гесса.
- •1 Следствие
- •2 Следствие
- •1.3. Термодинамическая вероятность. Энтропия. 2-е и 3-е начала (законы) термодинамики.
- •1) Самопроизвольность процесса – его свойство быть энергетически выгодным и, следовательно, способным протекать в прямом направлении.
- •3) Существует две движущие силы самопроизвольного протекания процесса:
- •1) В любой изолированной системе с течением времени происходит постоянное возрастание степени беспорядка, то есть энтропии
- •1.4. Энергия Гиббса и направленность химических реакций
- •2. Введение в химическую кинетику.
- •2.1. Основные понятия и определения.
- •2: А) Гомогенная химическая реакция – реакция, протекающая в одной фазе, т.Е. Все вещества находятся в одной фазе.
- •2.2. Факторы, влияющие на скорость гомогенных реакций.
- •2.2.1. Влияние концентрации реагентов.
- •2.2.2. Влияние температуры.
- •1)Зависимость скорости реакции от температуры предложил Аррениус:
- •3)При обычных температурах его значение для большинства реакций находится в пределах от 2... 4.
- •1)Скорости большинства химических реакций повышаются с ростом температуры. Для некоторых реакций в области умеренных температур выполняется эмпирическое правило Вант-Гоффа, согласно которому:
- •Концентрация и теория столкновений
- •2.2.3. Влияние катализатора.
2.2.3. Влияние катализатора.
1. Дайте определение и иллюстрацию понятиям:
катализатор,
ингибитор,
гомогенный и гетерогенный катализ.
2. Какие вещества используют в качестве катализаторов? Какими свойствами должны обладать катализаторы? Каким требованиям удовлетворять?
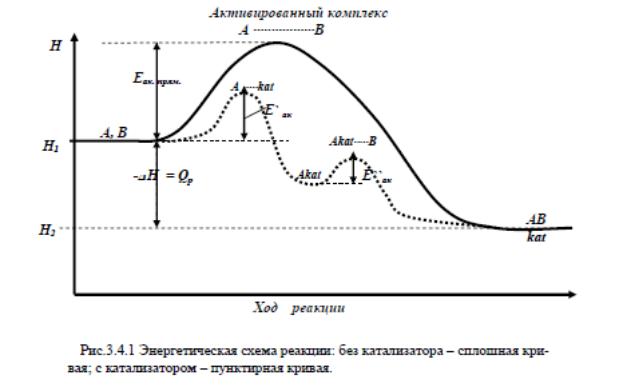
3. В чем заключается сущность действия катализатора? Нарисуйте энергетическую диаграмму химической реакции, протекающей
в отсутствие катализатора,
в присутствии катализатора.
В чем их различие? При каком условии катализатор будет ускорять данную реакцию?
Ответ на весь раздел 2.2.3.
1)Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождаются в конце реакции. Влияние, оказываемое катализаторами на химические реакции, называется катализом.
Например, смесь порошка алюминия и кристаллического йода при комнатной температуре не обнаруживает заметных признаков взаимодействия, но достаточно капли воды, чтобы вызвать бурную реакцию:
2Al + 3J2 2AlJ3.
Различают гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь) и гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах и каталитический процесс идет на поверхности раздела фаз).
Для объяснения механизма гомогенного катализа наибольшее распространение получила теория промежуточных соединений (предложена французским исследователем Сабатье и развита в работах Н.Д. Зелинского). Согласно этой теории медленно протекающий процесс, например, реакция:
A + B = AB
в присутствии катализатора протекает быстро, но в две стадии. В первой стадии процесса образуется промежуточное соединение одного из реагентов с катализатором A… kat.
Первая стадия:
A + kat = A... kat.
Полученное соединение на второй стадии образует с другим реагентом активированный комплекс [A... kat... B], который превращается в конечный продукт AB с регенерацией катализатора kat.
Вторая стадия:
A...kat + B = [A... kat... B] = AB + kat.
В случае гетерогенного катализа реагенты и катализатор образуют несколько фаз. Реакции протекают на границе раздела фаз: обычно на поверхности раздела между твердой и жидкой или твердой и газовой фазами.
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты контактным методом.
Резко замедлить протекание нежелательных химических процессов можно при добавлении в реакционную среду специальных веществ ингибиторов. Например, для торможения нежелательных процессов коррозионного разрушения металлов широко используются различные ингибиторы коррозии металлов.
2)Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются , металлы их оксиды и сульфиды. Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO.
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Катализатор обладает следующими свойствами :
1) Катализатор не влияет на общую стехиометрию реакции.
2) Катализатор одинаково ускоряет как прямую так и обратную реакции. Поэтому он увеличивает скорость достижения равновесия . Это означает, что он не меняет равновесные концентрации. Следовательно катализатор не изменяет выход реакции.
3) Катализатор влияет на механизм реакции, открывая новый путь протекания реакции. Энергия активации на этом новом пути оказывается ниже прежней, в результате оказывается, что большее число реагирующих молекул обладает энергией, необходимой для успешного столкновения. Соответственно этому увеличивается полное число столкновений, приводящих к реакции в единицу времени , а значит, увеличивается и скорость реакции.
4) Катализатор может увеличивать скорость одной реакции , но не увеличивать скорость другой, сходной реакции.
5) Катализатор принимает химическое участие в реакции. Он расходуется на одной стадии и регенерируется на следующей стадии реакции. Таким образом, катализатор может использоваться повторно, не подвергаясь окончательному превращению. Однако катализатор может изменять свое физическое состояние.
3) В химической промышленности катализаторы применяются весьма широко. Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. В некоторых случаях под действием катализаторов могут возбуждаться такие реакции, которые без них в данных условиях практически не протекают.
В отсутствии катализатора реакция протекает медленно.
Кностанта прямой иобратной реакции различны
При увелечении t константа v(x) обычно увеличивается
2.2.4. Химическое равновесие и его смещение.
1. Дайте определение следующим понятиям:
состояние химического равновесия,
исходные концентрации веществ,
конечные концентрации веществ,
равновесные концентрации веществ.
состояние химического равновесия - состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
равновестные концентрации веществ - Концентрации веществ тогда, когда скорость прямой реакции становится равной скорости обратной реакции
исходные концентрации веществ – концентрации в-в до начала реакции
конечные концентрации веществ - концентрации в-в после протекания реакции
2. Покажите схематически, как изменяются скорости прямой и обратной реакций в процессе установления химического равновесия. Каковы его особенности? Почему оно является динамическим? Как его можно смещать?
3. Что называют константой химического равновесия? Каков ее физический смысл и размерность? Зависит ли эта величина от природы реагирующих веществ, их концентрации, температуры, давления, катализатора?
4. Сформулируйте закон действующих масс для обратимых процессов и напишите его выражение (т.е. константы химического равновесия) в общем виде. Почему концентрации твердых веществ в гетерогенных системах не входят в выражение Кравн.?
5. Каковы термодинамические и кинетические условия наступления равновесия в любой системе? Почему равновесное состояние для системы является энергетически выгодным и устойчивым во времени? Каково соотношение между изменением стандартной энергией Гиббса обратимого процесса и константой его равновесия?
6. Сформулируйте принцип Ле Шателье. К каким состояниям и системам он применим? Объясните на конкретных примерах влияние на положение равновесия следующих факторов:
концентрации исходных веществ и продуктов реакции,
давления,
температуры,
катализатора.
