
Диагностика возбудителей туберкулеза и паратуберкулеза
.docПатогенні мікобактерії. Діагностика збудників туберкульозу і паратуберкульозу.
Іх від інших видів мікобактерій використовують багато ознак. Основними з них є вірулентність, швидкість росту, форма колоній, утворення пігменту, каталази, уреази, нікотинамідази, нітратредуктази (табл. ).
Таблиця
Властивості мікобактерій, що використовуються для їх ідентифікації
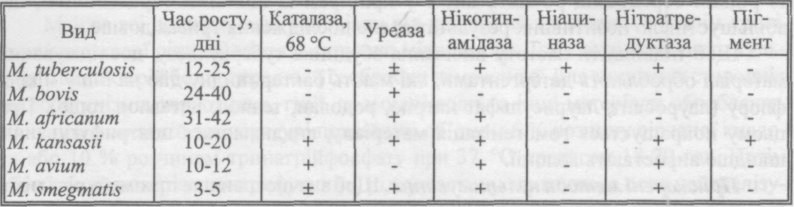
Найважливіша ознака М. tuberculosis - ніациновий тест - здатність синтезувати значну кількість нікотинової кислоти (ніацину). Каталазна активи сть відносно слабка і втрачається при 68 °С. Для швидкої диференціації збудників туберкульозу рекомендують посів на середовище Левенштейна-Иенсена з 500 мкг/мл і 1000 мкг/мл саліцилового натрію. Мікобактерії туберкульозу за таких умов на цьому середовищі не ростуть.
Питання про вірулентність мікобактерій вирішується на основі біологічних проб і виявленні корд-фактора. Останній визначають методом мікрокультур Прайса, а також на основі міцного зв'язування таких барвників, як нейтральний червоний або нільський голубий. При нанесені на мазок розчину NaOH туберкульозні палички зберігають колір барвника, в той час як невірулентні мікобактерії змінюють відповідне забарвлення.
Для надійної ідентифікації видів мікобактерій у сучасних умовах розроблені прогресивні, швидкі й дуже точні методи визначення у таких досліджуваних матеріалах, як харкотиння, плевральна рідина, ліквор, гній, сироватка крові, вміст шлунка, тканини тощо. Ці об'єкти, знезаражені нагріванням, зберігаються необмежений час і в будь-який момент можуть бути досліджені. Серед них найбільшої уваги заслуговує молекулярно-генетичний метод полімеразної ланцюгової реакції. Він грунтується на виявленні в біологічному матеріалі ДНК мікобактерій. Навіть якщо в матеріалі знаходиться всього 5-10 мікробних клітин, за допомогою олігонуклеотидів-праймерів запускають синтез специфічних фрагментів ДНК у циклотермостаті, які потім можна ідентифікувати методом гельелектрофорезу. Результати досліджень отримують через 3-4 години.
Специфічні антигени в тих же матеріалах можна також швидко виявити і за допомогою імуноферментного аналізу, якщо мати відповідні антитіла, адсорбовані на твердій фазі у полістиролових планшетах.
Визначення стійкості мікобактерій до хіміопрепаратів. Лікарську стійкість збудників туберкульозу визначають способом серійних розьедень перед початком лікування, через З місяці і надалі при продовженні виділення туберкульозних паличок через кожні 6 місяців. Це роблять шляхом вирощування культур на середовищах із різною концентрацією туберкулостатиків.
Є два способи визначення резистентності мікобактерій: прямий і непрямий. При прямому способі безпосередньо сіють відповідно оброблений матеріал на середовища з різними концентраціями антибіотиків чи інших хіміопрепаратів. Він ефективніший, але ним можна користуватися лише тоді, коли в матеріалі виявляють не менше 5 мікобактерій в кожному полі зору. При непрямому способі на середовище з протитуберкульозними препаратами сіють попередньо виділені культури мікобактерій. В обох випадках обов'язковий контроль - посів на таке саме середовище без туберкулостатиків.
У сучасних умовах найбільш поширені такі методи визначення лікарської стійкості мікобактерій:
-
культивування на щільному середовищі Левенштейна-Йенсена;
-
мікрокультивування на скельцях за Прайсом;
-
глибинні посіви в напівсинтетичні середовища.
У пробірки, які містять різну концентрацію препаратів, і в одну контрольну (без туберкулостатика) засівають завись виділеної культури (500 млн мікробних тіл в 1 мл). Культуру вважають чутливою, якщо в пробірці з препаратом виросло менше 20 колоній при рясному рості в контролі. Якщо виросло більше 20 колоній, культуру вважають стійкою. Резистентність даного штаму виражають тією максимальною концентрацією антибактерійного препарату, при якій ще відбувається ріст, наближений до росту в контролі
Біологічний метод діагностики туберкульозу - зараження гвінейських свинок - є найчутливішим. Інфікуюча доза збудника для цих тварин складає всього декілька бактерійних клітин. Досліджуваний матеріал обробляють 2 % розчином сірчаної кислоти протягом 20 хв, включаючи центрифугування. Потім осад тричі відмивають 0,85 % розчином хлориду натрію і емульгують його в 1-2 мл ізотонічного розчину. Емульгований осад вводять підшкірне в пахвинній ділянці двом гвінейським свинкам масою 250-300 г . При малій кількості матеріалу його вводять у черевну порожнину або паранхіму яєчка. Такий спосіб зараження підвищує чутливість біопроби, особливо в тих випадках, коли в матеріалі містяться маловірулентні палички туберкульозу, стійкі до ізоніазиду та інших хіміопрепаратів.
Через 2-3 тижні заражених тварин зважують, визначають розміри збільшених лімфатичних вузлів. Місцеві патологічні зміни, зменшення маси тіла дають підставу для розтину гвінейських свинок і дослідження їх внутрішніх органів. При негативних результатах тварин умертвляють через 3-4 міс, гістологічне досліджують паренхіматозні органи і роблять посіви на елективні середовища.
Гвінейських свинок використовують і для виявлення L-форм мікобактерій туберкульозу. В таких випадках потрібно зробити декілька послідовних заражень, оскільки L-форми мають меншу вірулентність і викликають у тварин доброякісний перебіг туберкульозу, який при реверсії L-форм може перейти в генералізований процес.
Останнім часом все ширше використовують біопробу на курях і кроликах.
Серологічна діагностика. Для виявлення протитуберкульозних антитіл спочатку були запропоновані реакції аглютинації, преципітації та зв'язування комплементу. Тепер їх використовують рідко. Натомість стали широко практикувати реакцію непрямої гемаглютинації. Як антиген у ній використовують сенсибілізовані еритроцити барана або людини О-групи. їх навантажують екстрактом із туберкульозних бактерій або очищеним туберкуліном. До 1 мл осаду еритроцитів додають 20 мл екстракту мікобактерій, витримують при 37 °С протягом 2-ох год. і відмивають центрифугуванням для видалення надлишку антигену. Перед постановкою РНГА сироватку хворого виснажують еритроцитарною масою для усунення неспецифічного реагування. Потім сироватку розводять від 1:2 до 1:272. Діагностичним титром вважають розведення 1:8. При туберкульозі РНГА буває позитивною у 70-90 % випадків.
Хороші результати дає також імуноферментний аналіз, імуноблотинг і реакція агрегат-гемаглютинаціїдля визначення циркулюючих імунних комплексів. Ще точнішим є радіоімунний метод, але через високу вартість діагностикумів і відсутність радіометричної апаратури він рідко використовується в лікувальних закладах.
Для вдосконалення серологічної діагностики туберкульозу важливо налагодити випуск моноклональних антитіл до різних антигенів мікобактерій. З їх допомогою можна було б виявляти специфічні епітопи бактерій, а також в дповідні їм антитіла. Виявлення таких антитіл буде мати важливе діагностичне значення.
Алергічний метод. Для постановки проби використовують туберкулін (ППД). У 1890 р. Роберт Кох запропонував перший препарат, так званий старий туберкулін Коха (Alttuberkulin Koch або АТК). Його виготовляють із суміші культур мікобактерій людського й бичачого типів, вирощених у гліцериновому бульйоні протягом 5-6 тижнів. Культуру стерилізують текучою парою 3О хв, випарюють при 70 °С до 1/10 первинного об'єму, фільтрують через бактерійний фільтр і розливають в ампули. Туберкулін Коха містить ряд баластних речовин і важко піддається стандартизації. Починаючи з 1934 p., для постановки алергічних проб Зейберт запропонував високоочищений препарат туберкуліну, який назвали PPD-S {Purified protein derivative - Seibert).
Результати алергічної проби оцінюють через 72 год. за такою схемою: негативна проба - повна відсутність папули; сумнівна - папула розміром 2-4 мм або лише гіперемія будь-якого розміру; позитивна - папула діаметром 5 мм і більше.
Паратуберкульоз – це інфекційне зоонозне захворювання в основному великої рогатої худоби, що проявляється ентеритами, проносами і зневодненням організму.
Для діагностики захворювання в лабораторію відсилають тонкий відділ кишечнику, кров, фекалії. Для діагностики використовують морфологічні, культуральні і алергічні методи дослідження. Алергічну діагностику проводять по методиці, що використовується при туберкульозі.
Специфічних методів лікування не розроблено.
Вакцина БЦЖ (проти туберкульозу)
Характеристика. Вакцина являє собою аморфну масу білого кольору, що складається з живих висушених мікобактерій вакцинного штаму БЦЖ.
Форма випуску і збереження. Вакцину випускають в ампулах, запаяних під вакуумом і покладених у коробки в комплекті з ампулами з фізіологічним розчином, призначеним для розведення вакцини. В одній ампулі утримується 1 або 10 мг сухого препарату. Термін придатності вакцини — два роки з дня виготовлення за умови збереження її при температурі не вище +4 °С в сухому темному приміщенні.
Спосіб застосування і дози. Вакцину БЦЖ застосовують для імунізації молодняку великої рогатої худоби в комплексі ветеринарно-санітарних і організаційно-господарських заходів, передбачених діючою інструкцією. Підготовляють вакцину для імунізації молодняку великої рогатої худоби і застосовують неї згідно «Настанові по застосуванню вакцини БЦЖ при туберкульозі великої рогатої худоби».
