
Preparaty_-_proizvodnye_tsiklopentanpergidrofenantrena__1
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ПРЕПАРАТЫ – ПРОИЗВОДНЫЕ ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕНА
Методические рекомендации
Составители: П.М. Карлов, Л.Ю. Яковлев
Издательско-полиграфический центр Воронежского государственного университета
2012
1
Утверждено научно-методическим советом фармацевтического факультета
10.09.2012 г., протокол № 1500-08-07.
Рецензент: доцент кафедры фармацевтической химии и фармацевтической технологии, канд. фарм. наук Т.А. Брежнева.
Методические рекомендации содержат информацию о качественном и количественном определении препаратов – производных циклопентанпергидрофенантрена химическими и физико-химическими методами.
Методические рекомендации разработаны на кафедре фармацевтической химии и фармацевтической технологии фармацевтического факультета Воронежского государственного университета для студентов 3 курса очной формы обучения, 4 курса вечерней формы обучения фармацевтического факультета и интернов.
Для специальности: 060108 – Фармация
2
|
СОДЕРЖАНИЕ |
|
1. |
Классификация и номенклатура стероидных соединений................... |
4 |
2. |
Особенности строения и стереохимии стероидных соединений, |
|
взаимосвязь с их физиологической активностью................................................ |
6 |
|
3. |
Взаимосвязь между химическим строением |
|
и биологической активностью стероидных гормонов.............................. |
8 |
|
|
3.1. Андрогены и анаболические стероиды..................................... |
9 |
|
3.2. Гестагены. .................................................................................. |
10 |
|
3.3. Кортикостероиды...................................................................... |
11 |
|
3.4. Эстрогены................................................................................... |
12 |
4. |
Способы получения стероидных гормонов......................................... |
13 |
|
4.1. Химический синтез стероидных гормонов............................. |
13 |
|
4.2. Микробиологическая трансформация стероидов.................. |
16 |
5. |
Контроль качества стероидных гормонов............................................ |
20 |
|
5.1. Методы установления подлинности и доброкачественности |
|
|
стероидных гормонов. ..................................................................... |
21 |
|
5.1.1. Физико-химические методы. ........................................... |
21 |
|
5.1.2. Химические методы.......................................................... |
35 |
|
5.2. Методы количественного анализа стероидных гормонов в |
|
|
субстанциях и лекарственных формах........................................... |
42 |
|
5.2.1. Титриметрические методы............................................... |
42 |
|
5.2.2. Спектральные методы ...................................................... |
44 |
|
5.2.3. Поляриметрия.................................................................... |
50 |
|
5.2.4. Хроматографические методы. ......................................... |
51 |
|
5.2.5. Полярография. ................................................................... |
51 |
|
5.2.6. Гравиметрия....................................................................... |
53 |
6. Особенности контроля качества стероидных гормонов в лекарст- |
|
|
венных формах. ..................................................................................................... |
53 |
|
7. |
Тестовые задания.................................................................................... |
54 |
8. |
Литература............................................................................................... |
63 |
Приложение.................................................................................................. |
65 |
|
3
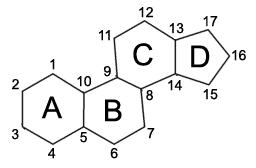
1. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА СТЕРОИДНЫХ СОЕДИНЕНИЙ
Структурной основой стероидных гормонов является стерановое или циклопентанпергидрофенантреновое ядро (С17), которое определяет общность физико-химических свойств и эволюционно сложившуюся фармакодинамику в организме, несмотря на различия в специфической гормональной активности.
По химической структуре и направленности физиологического действия стероидные гормоны разделяют, по крайней мере, на 4 основные группы, причем внутри каждой из них можно дополнительно выделить семейства и узкие подгруппы соединений (см. рис. 1).
Кольца, составляющие скелет циклопентанпергидрофенантрена, принято обозначать латинскими буквами А, В, С и D. Порядок нумерации сложился исторически в ходе исследования их строения. Углеродные атомы колец ABD нумеруют против часовой стрелки, а атомы кольца С – по часовой стрелке. После нумерации атомов ядра нумеруют углеродные атомы ангулярных групп – С18 и С19, а затем – боковой цепи в 17 положении. Для обозначения пространственного положения заместителей служат буквы α и β. В названии стероидных соединений эти буквы ставят после номера асимметрического центра, в котором находится этот заместитель. Например, буква α обозначает транс-положение заместителя по отношению к ближайшей ангулярной метальной группе, а буква β – цис-положение по отношению к этой же группе. На графическом изображении молекулы стероида сплошной линией соединяют ангулярные метальные С18 и С19, β- заместители, а α-заместители – при помощи пунктирной линии.
4
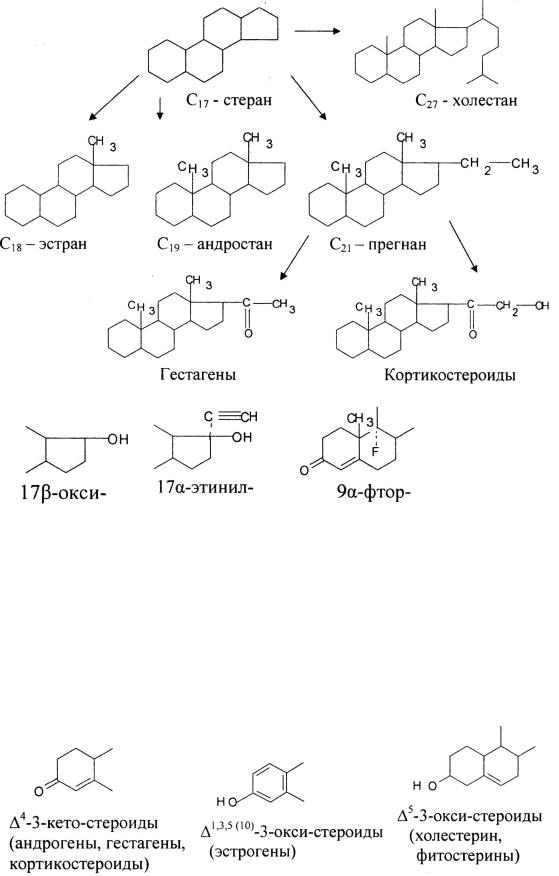
Рис. 1. Классификация стероидных гормонов
Обозначение двойных связей производится по общему правилу: при введении одной связи в название соединения прибавляется окончание «ен», а место образования обозначают буквой . По расположению и количеству двойных связей и типу заместителя в С3-положении все стероидные гормоны можно разделить:
1) природные стероиды
5
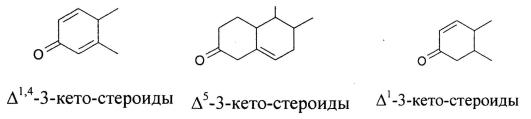
2) синтетические стероиды
Часто в названии стероидов используют разные приставки.
Нор- или гомо- обозначают уменьшение или увеличение углеродного скелета соединения на один углеродный атом.
Дегидро- применяется для соединений отличающихся от исходного стероида наличием одной дополнительной двойной связи или карбонильной группы.
Дезокси- или дезоксо- применяется для соединений, отличающихся от исходного стероида отсутствием одной гидроксильной или карбонильной группы.
Дигидро- применяется для соединений, отличающихся от исходного стероида наличием двух дополнительных атомов водорода.
Эпи- обозначает иную пространственную ориентацию функциональной группы по сравнению с исходным стероидом.
2. ОСОБЕННОСТИ СТРОЕНИЯ И СТЕРЕОХИМИИ СТЕРОИДНЫХ СОЕДИНЕНИЙ,
ВЗАИМОСВЯЗЬ С ИХ ФИЗИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ
Единство полиморфного по строению и функциям класса стероидных соединений определяется наличием в молекулах всех его представителей общего строительного блока – полициклического стеранового скелета. Стерановое ядро имеет компактную, довольно жесткую трехмерную структуру с несколькими асимметричными атомами углерода. Для циклогексанового скелета колец АВС характерна конформация кресла, а для циклопентанового кольца D – полукресла или конверта. Для всех биологически активных природных стероидных гормонов характерно транс-сочленение всех углеродных колец в стерановом скелете. При этом конформация колец В и С стабильна при введении любых заместителей, структура кольца D может варьировать от 3β-конверта до 13β,14α-полукресла в зависимости от заместителей в нем.
Угол сочленения колец А и В зависит от ориентации атома водорода у С5-углеродного атома, в этой связи принято выделять 5α- и 5β-стероиды. Обозначение «5α» говорит о том, что атом водорода в положении С5 нахо-
6
дится ниже общей плоскости колец. Как правило, высокая биологическая активность стероидных гормонов связана с отсутствием α-заместителей в положениях 1, 9, 11, 13, 17 и отсутствием β-заместителей в положениях 4–8, 14, 15.
Известно, что первой стадией в биологическом действии стероидных гормонов является их влияние на специфический транспорт белков. Предполагают, что с белками стероиды взаимодействуют плоской нижней стороной (α-поверхность) молекулы.
Для 5β-стероидов известны другие типы биологической активности, например, лекарственный препарат «Предион», по структуре близкий к кортикостероидам, оказывает снотворное и наркотическое действие.
Введение двойной связи в положение С4, как в природных 4-3-кето- стероидах (андрогены, гестагены, кортикостероиды), превращает кольцо А в 1α,2β-полукресло. При этом кольцо становится относительно гибким и данная конформация может инвертироваться под влиянием заместителей в конформацию 1β,2α-полукресла.
Из всех стероидных гормонов наименее жесткие требования к структуре предъявляют к соединениям, обладающим эстрогенной активностью. При условии ароматизации кольца А и наличии кислотной гидроксильной группы в положении С3 строение остальной молекулы имеет второстепенное значение. В 1938 году появились простые высокоэффективные бензольные аналоги стероидных эстрогенов: синестрол и диэтилстильбэстрол – эффективные при лечении злокачественных новообразований, например, для лечения рака предстательной железы. Форма молекул этих соединений не похожа на молекулы эстрогенов, но у них наблюдается примерно одинаковое расстояние между атомами кислорода: 1,2 нм у мезо-формы синестрола, 1,21 нм у транс-изомера диэтилстильбэстрола и от 1,07 до 1,11 нм в стероидных эстрогенах. Известно, что для проявления эстрогенной активности необходимо образование двух водородных связей рецептора с атомами кислорода лиганда. Кроме того, эстрогенное действие диэтилстильбэстрола связано с толщиной его молекулы, которая составляет 0,45 нм и равна толщине молекул стероидных эстрогенов.
7
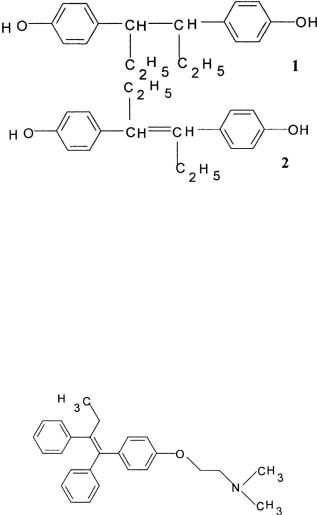
Структурные формулы синестрола и диэтилстильбэстрола
Высокой противоопухолевой активностью обладает один из основных современных антиэстрогенов – тамоксифен, эффективный при эстрогензависимых формах рака молочной железы. Препарат конкурентно связывается с белковыми рецепторами эстрадиола, понижая их концентрацию в цитоплазме, тормозя деление опухолевых клеток. Основой химического строения тамоксифена (как и у синтетических эстрогенов) является стильбен.
Структурная формула тамоксифена
Все природные стероиды являются D-изомерами стерана, как правило, синтетические L-изомеры гормональной активностью не обладают. Исключение составляет высокоэффективный синтетический гестаген – левоноргестрел, который входит в состав пероральных контрацептивных препаратов («Овидон», «Тризистон», «Триквилар», «Постинор» и др.).
3.ВЗАИМОСВЯЗЬ МЕЖДУ ХИМИЧЕСКИМ СТРОЕНИЕМ
ИБИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ СТЕРОИДНЫХ
ГОРМОНОВ
В молекуле стероидных гормонов принято выделять функциональные группы и заместители с доминантным и субдоминантным значением в реализации их специфической гормональной активности. У эстрогенов доминантной группой является ароматическое кольцо А. Характер гормональной активности других стероидных гормонов зависит от типа функциональных
8

групп в С17 атоме кольца D в β-положении. Доминантными являются три типа функциональных групп:
1)17β-гидроксил – формирует андрогенный ряд стероидов;
2)17β-ацетогруппа – формирует гестагенный ряд стероидов;
3)17β-α-кетольная группа – формирует ряд кортикостероидов. Субдоминантным значением для проявления гормональной активно-
сти обладают заместители в С11- и С17α-положении кортикостероидов. Строение кольца А андрогенов, анаболиков и кортикостероидов, а именно положение ненасыщенной связи и заместитель при С3, также обладает субдоминантным значением.
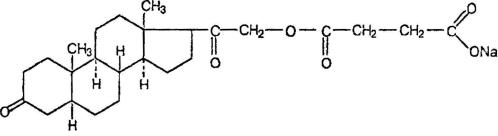
3.1. Андрогены и анаболические стероиды
тестостерон
Для производных тестостерона характерно:
–ацилирование 17β-гидроксигруппы тестостерона с образованием соответствующих сложных эфиров (пропионат, энантат) снижает прямую андрогенную активность, но в организме в результате гидролиза сложноэфирной группы образуются активные метаболиты; наблюдается эффект пролонгированного действия;
–введение алкильных заместителей С1-С2 в 17α-положение приводит к снижению специфичности по отношению к рецепторам андрогенного типа и разобщению андрогенного и анаболического эффектов (метилтестостерон);
–17α-алкильные производные андрогенов устойчивы при пероральном применении, наблюдается эффект пролонгированного действия;
–17α-алкильные заместители С3-С6 вызывают существенное подавление системной гормональной активности и проявление выраженного ан-
тиандрогенного эффекта, полярные группы -СООН, -СОСН3, -CONR2, -NH-CO-R, -NH-CO-NH2 и т.д. ингибируют ферменты биосинтеза и метаболизма андрогенов, что приводит к появлению выраженной антиандрогенной активности (ципротерона ацетат, финастерид);
–присоединение в 17α-положение к тестостерону этинильного радикала приводит к образованию синтетического аналога – этистерона (прегнина), у которого значительно снижена его специфическая андрогенная ак-
9

тивность, но при этом появляется гестагенное действие, сравнимое с действием прогестерона;
–восстановление двойной связи в положении 4,5 и восстановление 3-кетогруппы метилтестостерона приводит к снижению андрогенного и усилению анаболического эффектов (метандриол);
–19-норпроизводные тестостерона практически не обладают андрогенной активностью на фоне ярко выраженного анаболического эффекта (нандролона фенилпропионат («Феноболин») и деканоат («Ретаболил»);
–введение дополнительной двойной связи в положение 1,2 метилтестостерона не влияет на анаболическую активность, но значительно снижает андрогенный эффект (метандиенон).
3.2.Гестагены
прогестерон
Для производных прогестерона характерно:
–любая модификация в 17β-боковой цепи прогестерона: 20β- и 20αвосстановление, 21-деметилирование, 21-гидроксилирование – резко снижает специфическую гестагенную активность;
–17α-производные прогестерона, кроме 17α-оксипроизводных (оксипрогестерона капронат, медроксипрогестерона ацетат), гестагенной активностью не обладают;
–19-норпроизводные прогестерона отличаются более высокой активностью, чем прогестерон;
–синтетические гестагены, входящие в состав пероральных контрацептивных препаратов, являются 17α-этинил-17β-окси-19-норпроизвод- ными андростана:
Общая структурная формула синтетических гестагенов.
R - СН3, |
4 = норэтистерон |
R - СН3, |
5(10) = норэтинодрел |
|
10 |
