
- •Спектральные методы анализа объектов окружающей среды
- •1. Фотометрические методы анализа
- •1.1. Визуальная колориметрия
- •Ход работы
- •1.2. Фотоколориметрия
- •Ход работы
- •Ход работы
- •1.3. Экстракционно-фотометрический метод
- •Ход работы
- •1.4. Фототурбидиметрия
- •1.5. Спектрофотометрия
- •Ход работы
- •Ход работы
- •Ход работы
- •Ход работы
- •2. Люминесцентный метод анализа
- •Ход работы
- •3. Метод ик-спектроскопии
- •Ход работы
- •3. Метод атомно-абсорбционной спектроскопии
1.2. Фотоколориметрия
Работа 2. Методы определения валового содержания
органического углерода (гумуса) в почве
Цель работы: Определить содержание гумуса в одной и той же почве двумя различными методами и сопоставить эти методы с точки зрения метрологических, аналитических и экономических характеристик.
Органическое вещество, входящее в состав почвы (за исключением живых организмов), по своему происхождению и функциям делится на 2. группы: органические остатки, не утратившие анатомического строения, и гумус, или перегной. Гумус -это совокупность индивидуальных (специфических и неспецифических) органических соединений, продуктов их. взаимодействия между собой и с минеральными компонентами, образующаяся в результате трансформации животных и растительных остатков, существенно более устойчивая к дальнейшему разложению, чем исходная биомасса. Наиболее характерными специфическими гумусовыми веществами являются гумусовые кислоты. Это азотсодержащие высокомолекулярные оксикарбоновые кислоты с интенсивной бурой окраской.
По растворимости их разделяют на гуминовые кислоты, гиматомелановые (ранее включавшиеся в группу гуминовых кислот) и фульвокислоты.
Гуминовые кислоты содержат (.мас.%) 46 - 62% С, 3 - 6% N, 3-5% Н, 32- 38% 0. Для фульвокислот характерно более низкое содержание углерода - 36-44%, в их составе 3 - 4,5% N, 3-5% Н и 45-50% С.
Содержание гумуса
почвы колеблется в широких пределах
-от десятых долей до 20% и более. Гумус
определяет структуру почвы, регулирует
ее водно-воздушный режим, повышает
противоэрозионную устойчивость. С
гумусом связаны важнейшие физико-химические
показатели почв: ЕКО, буферность почв.
Оптимальное содержание гумуса определяет
максимальную продуктивность почв.
Поэтому определение его в верхних
горизонтах почв проводят при всех
почвенных исследованиях. Количество
гумуса рассчитывают по экспериментально
определенному процентному содержанию
органического углерода в почве, умножая
его на коэффициент (Кг),
зависящий от процентного содержания
углерода в гумусе (для гуминовых кислот
содержание углерода 58% и Кг
=
![]() = 1,724, а для фульвокислот содержание
углерода = 40% и Кг
=
= 1,724, а для фульвокислот содержание
углерода = 40% и Кг
=
![]() = 2,25).
= 2,25).
Все методы определения органического углерода основаны на его окислении до углекислоты. Наиболее точные результаты получают при сухом озолении гумуса и гравиметрическом определении выделившегося СО2 (метод Густавсона). При мокром озолении органического вещества почв раствором бихромата калия углерод можно определить не только по количеству выделившегося СО2, но и косвенно титриметрическим (метод Тюрина) или фотометрическим (метод Никитина) методами. Полнота- окисления органического углерода при мокром озолении составляет 85 - 95%. Однако вследствие большей простоты и доступности косвенные методы получили наибольшее распространение.
Принцип косвенных методов определения гумуса: Мокрое озоление органического вещества почв основано на окислении углерода гумуса 0,4 н. раствором двухромовокислого калия, приготовленным на разбавленном 1:1 растворе серной кислоты. Для окисления гумуса к навеске почвы приливают заведомый избыток раствора хромовой смеси, что необходимо для полноты окисления органического углерода. Если при определении гумуса учитывать только взаимодействие бихро-мата калия с углеродом органического вещества почв, то процесс можно представить уравнением:
3C+2K2Cr2О7+8H2SO4 = 3CO2 + 2Cr2(SO4)3+8H2O+2K2SO4 (1.1)
3 С + 2(O) CO2 (1.2)
2 K2Сг2O7+ 4H2SO4 Cr2(SO4)3 + 3(O) + 4H2O + K2SO4 (1.3)
Окисление происходит в сильнокислой среде и сопровождается восстановлением шестивалентного хрома в трехвалентный.
По методу Тюрина избыток бихромата в растворе после окисления гумуса титруют раствором сульфата железа (П):
K2Cr2О7+6 FeSO4+7Í2SO4 = Сг2(SO4)3 + ЗFе2(SO4)3+7 H2O +К2SO4 (1.4)
1 Cr2О7 + 6 е + 14Н+ 2Сг3+ + 7 H2O (1.5)
6 Fe2+ – 1 е Fe3+ (1.6)
По разнице между
введенным количеством бихромата калия
и оставшимся после реакции определяют
количество окислителя, затрачиваемое
на окисление органического углерода
почв. Фактически в методе Тюрина прямым
образом учитывается не углерод, а
кислород (количество окислителя в
пересчете на кислород), затрачиваемый
на его окисление. Поэтому в соответствии
с ур. 1.2 эквивалентная масса углерода в
процессе окисления гумуса может быть
принята равной
![]()
По методу Никитина количество органического углерода в почве определяют по количеству образовавшегося в процессе его окисления (ур. 1.1) трехвалентного хрома Cr3+, который фиксируется фотометрическим методом при = 590 нм. В этом случае количество органического углерода определяют по калибровочному графику, построенному по окисленным бихроматом калия стандартным растворам глюкозы
Азот, входящий в состав гумуса, хромовой смесью не окисляется, а остается в восстановленной форме, переходя в (NH4)2SO4. Присутствие в почве карбонатов не оказывает влияния на результаты определения гумуса рассматриваемыми методами. Наличие же хлоридов и закисных соединений железа и марганца мешает определению, т.к. на их окисление затрачивается дополнительное количество хромовой смеси и результаты определения гумуса получаются завышенными.
Из Практикум по агрохимии/ под ред. В.Г. Минеева М.: МГУ,1989, с. 60-61.
Ход анализа по методу Никитина. На аналитических весах взять навеску почвы 0,1—0,5 г с точностью до четвертого знака в колбы на 100 мл. Прилить из бюретки 20 мл 0,4н. раствора К2Сг2О7, колбы закрыть воронкой, осторожно перемешать. Поставить на 20 мин в сушильный шкаф, предварительно нагретый до 150° (время нагревания отсчитывается с момента достижения температуры 150°). Колбы ставить в удалении от стенок на 3—4 см для обеспечения более равномерного нагрева. По истечении времени вынуть колбы из шкафа, охладить. Раствор над осадком осторожно слить в пробирки и оставить на сутки, после чего колориметрировать в кюветах на 5 мл при длине волны 590 нм. Для сравнения в качестве оптического нуля используется раствор «холостой пробы», для чего в шкаф одновременно о опытными колбами поставить две колбы с 20 мл хромовой смеси.
Содержимое углерода найти по калибровочному графику.
Построение калибровочного графика. Отвесить на аналитических весах 2,5022 г глюкозы или 2,3771 г сахарозы и растворить в мерной колбе на 1 л дистиллированной воды. В 1 мл такого раствора содержится 1 мг углерода. В 5 колб прилить последовательно 2,5; 5,0; 10,0; 15,0; 20,0 мл раствора глюкозы или сахарозы. Выпарить досуха (до 1 капли) на водяной бане, прилить 20 мл хромовой смеси. Одновременно готовить «холостую пробу». Все колбы поместить в сушильный шкаф. После сжигания разбавить водой до 50 мл и через сутки колориметрировать. По найденным значениям оптических плотностей и известному содержанию углерода строится калибровочный график. Содержание углерода (в % ) рассчитывают по формуле
С=
![]()
где а — содержание углерода, найденное по графику, мг; н — навеска почвы, г.
Для перевода в гумус процент углерода необходимо умножить. на коэффициент 1,724.
Реактивы
0,4н. раствор бихромата калия: 40 г хорошо измельченного двухромовокислого калия (К2Сг2О7) растворить в 600 мл дистиллированной воды, перенести в мерную колбу на 1 л и довести дистиллированной водой до метки. Раствор из мерной колбы перелить в колбу на 2 л или фарфоровый стакан на 2 л, прилить 1 л концентрированной серной кислоты (d 1,84). Серную кислоту необходимо приливать очень осторожно, небольшими порциями, по 50— 100 мл, с перерывами 10—15 мин. Когда вся кислота добавлена, раствор охладить до комнатной температуры и перенести в склянку с притертой стеклянной пробкой.
Работа 3. Определение концентрации хрома в природных
и сточных водах
(составлено по ПНД Ф 14.1:2.52-96. Методика выполнения измерений массовой концентрации хрома в природных и сточных водах фотометрическим методом с дифенилкарбазидом.)
Цель работы. Произвести оптимизацию фотометрического определения (выбрать длину волны, толщину кюветы, количество фотометрического реагента) хрома(VI) с дифенилкарбазидом. Сравнить чувствительность и точность определения хрома(VI) на приборах с разной монохроматичностью потока излучения. Сравнить спектральные характеристики бихромат-иона и комплекса хрома(VI) с дифенилкарбазидом.
Введение. В поверхностных водах содержание хрома, как правило, не превышает 10 мкг/л, однако в сильно загрязненных водных объектах его концентрация может достигать сотен микрограммов в литре. В водную среду хром попадает при выщелачивании из горных пород и минералов, из почв в районах рудных месторождений. Основным источником антропогенного поступления хрома в водные объекты являются сточные воды гальванических цехов, текстильных и кожевенных предприятий, а также химических производств.
Соединения хрома присутствуют в водах в растворённом и взвешенном состояниях, соотношения между которыми обусловлены химическим составом вод, температурой, рН, Еh и другими факторами. Во взвеси доминирующее положение занимает сорбированная форма. В растворе хром может присутствовать в двух степенях окисления: Cr(III) и Cr(VI).
Cr(III) устойчив в растворе и в реальных условиях существования водных объектов далее не окисляется. Cr(VI), существующий в виде хромат- или бихромат-ионов, относительно устойчив только в аэробных условиях, при дефиците кислорода и в присутствии восстановителей он быстро восстанавливается до Cr(III).
Соединения хрома, особенно Сr(VI) токсичны и обладают канцерогенным действием. ПДК хрома(VI) для рыбохозяйственных водоемов составляет 0,02 мг/л, для водных объектов хозяйственно-питьевого и культурно-бытового водопользования - 0,05 мг/л. ПДК Cr(III) равны соответственно 0,07 и 0,5 мг/л.
Сущность метода. Методика основана на взаимодействии хрома (VI) с дифенилкар- базидом:
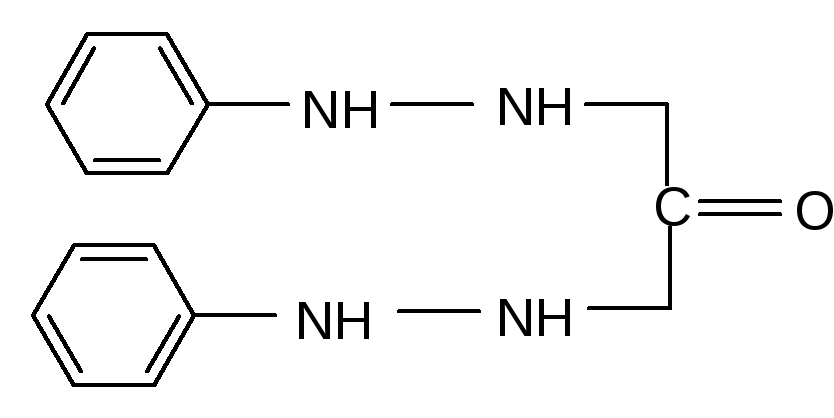
Реакция протекает в кислой среде. В результате образуется красно-фиолетовое положительно заряженное внутрикомплексное соединение, в котором хром содержится в восстановленной форме, в виде Cr(III), а дифенилкарбазид окислен до дифенилкарбазона. Для обеспечения полноты реакции необходим полутора-двухкратный избыток дифенилкарбазида. Максимум поглощения продукта реакции лежит в области 540 нм.
При необходимости определения Cr(III) в одной порции пробы проводят окисление Сr(III) до Cr(VI) персульфатом и определяют суммарное содержание обеих форм хрома, а в другой порции пробы окисление Cr(III) не проводят и определяют только содержание Cr(VI). По разности между полученными результатами находят содержание Cr(III).
Методика позволяет определять содержание общего, трех- и шестивалентного хрома в диапазоне концентраций от 0,01 до 1,0 мг/л.
Реакция бихромат-иона с дифенилкарбазидом очень чувствительна и достаточно селективна, т.к. многие другие окислители не дают такого окрашивания с дифенилкарбазидом. Подобно бихромат-иону с дифенилкарбазидом реагируют лишь молибден (VI) и ванадий (V), но реакция менее чувствительна. Поэтому оба эти элемента допустимы в концентрациях до 200 мг/л.
Мешает определению также железо, образующее с дифенилкарбазидом желтобурое соединение. Мешающее влияние железа устраняется добавлением в анализируемый раствор фосфорной кислоты, что предусмотрено в ходе определения.
При определении Cr(VI) результат анализа может оказаться завышенным, т.к. бихромат-ион может окислять некоторые содержащиеся в пробе вещества (например, некоторые органические соединения) в промежуток времени между отбором пробы и ее анализом. Для исключения таких ошибок пробы на Cr(VI) анализируются не позже, чем через 2 часа после отбора. При определении общего содержания хрома допускается консервирование (5 мл концентрированной HNO3 на 1 л пробы).
Реактивы. 1. Дифенилкарбазид, 1%-ный спиртовый раствор. Растворяют 0,5 г дифенилкарбазида в 50 мл этилового спирта. Хранят раствор в темной склянке.
2. Фосфорная кислота концентрированная 85%-ная.
3. Серная кислота, разбавленный раствор 1:1.
4. Серная кислота, водный раствор. 27,3 мл серной кислоты плотностью 1,84 г/см3 вносят при перемешивании в 150-200 мл дистиллированной воды, переносят в мерную колбу на 1 л и доводят до метки дистиллированной водой.
5. Персульфат аммония, 0,1%-ный раствор. 0,1 г персульфата аммония растворяют в 100 мл дистиллированной воды. Применяют свежеприготовленным.
6. Основной стандартный раствор хрома (VI) c концентрацией хрома 1 г/л. 0,283 г калия двухромовокислого растворяют в 100 мл дистиллированной воды.
Рабочий раствор 1 с концентрацией хрома 10 мг/л. Готовят в день проведения анализа разбавлением основного стандартного раствора в 100 раз дистиллированной водой.
Рабочий раствор II с концентрацией хрома 1 мг/л. Готовят в день проведения анализа разбавлением рабочего раствора I в 10 раз бидистиллированной водой.
Задание 1
Выбрать условия фотометрирования и произвести определение хрома (VI) в контрольных пробах на фотоэлектроколориметре КФК-2 или КФК-3.
Обычно для охвата широкого диапазона концентраций хрома в природных и сточных водах (0,01 - 1,00 мг/л) строят два градуировочных графика:
первый - в диапазоне концентраций 0,01 - 0,10 мг/л путем разбавления рабочего раствора II; второй - в диапазоне 0,10 - 1,00 мг/л с использованием рабочего раствора 1. Для выполнения работы Вам будет необходимо построить один из этих графиков (по заданию преподавателя).
