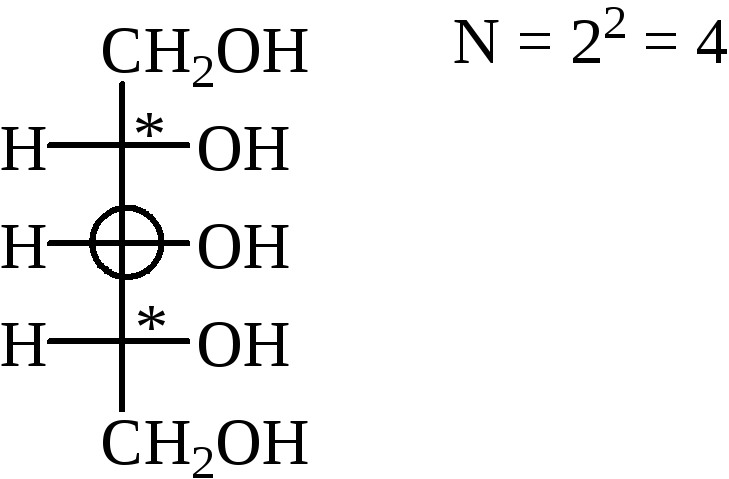- •Программа блоков «основы строения и реакционной способности органических соединений». «углеводороды»
- •Конспект лекций
- •1. Предмет органической химии
- •2. Электронная теория химической связи
- •3. Изомерия органических соединений
- •Проекционные формулы Фишера l-молочной кислоты.
- •Способы преобразования проекционных формул.
- •Трео- и эритро- изомеры
- •Необходимые условия проявления оптической активности
Проекционные формулы Фишера l-молочной кислоты.
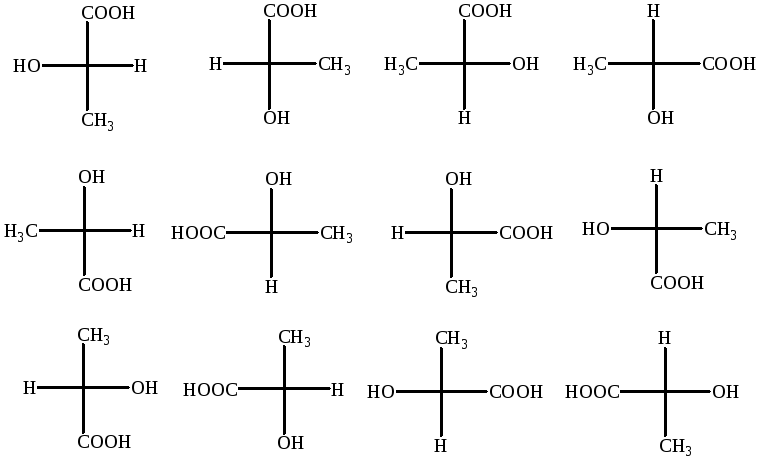
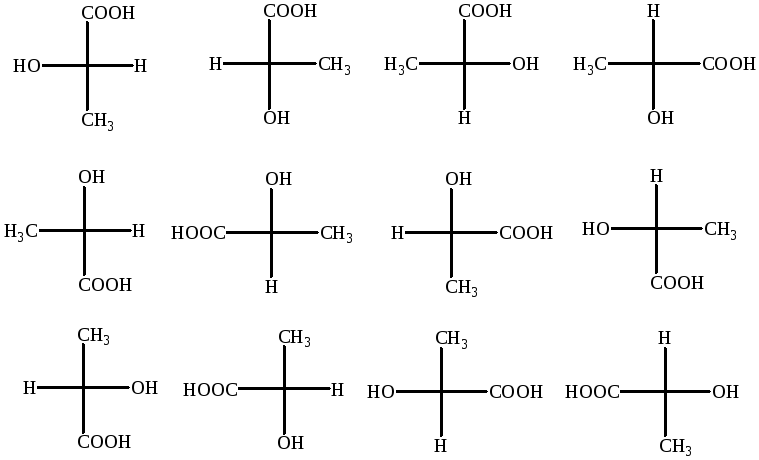
Способы преобразования проекционных формул.
Формулы можно вращать в плоскости чертежа на 180о.
Произвести четное число перестановок заместителей у хирального центра.
Вращение трех заместителей по часовой или против часовой стрелки, не затрагивая четвертый.
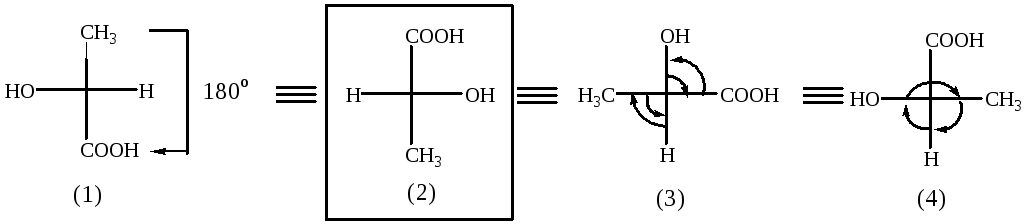
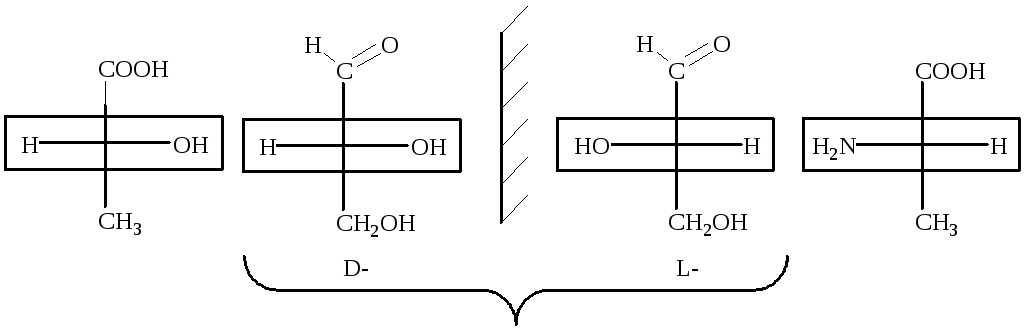
Проекция (2) – стандартная проекция Фишера: у нее атомы углерода на вертикальной линии со старшей функцией наверху, неуглеродные заместители – на горизонтальной линии. В точках пересечения С*; символ атома углерода не пишется. В стандартной проекции выделяется стереохимический ключ – хиральный атом с не углеводородными заместителями (берется в рамку), который определяет принадлежность изомера к D- или L-стереохимическому ряду. Стереохимический ключ у моносахаридов - асимметрический атом углевода, наиболее удаленный от карбонильной группы. У α-гидрокси- и α-аминокислот стереохимический ключ – асимметрический атом углерода в α-положении.
М.А. Розанов в 1906 г. предложил структуру (+) глицеринового альдегида, которому условно приписали D–конфигурацию.
D-Стереохимический ряд – ряд стереоизомеров, имеющих конфигу-рацию, сходную с конфигурацией D-глицеринового альдегида (водород слева).
L-Стереохимический ряд – ряд стереоизомеров, имеющих конфигу-рацию, сходную с конфигурацией L-глицеринового альдегида (водород справа).
 D-молочная
кислота глицериновые альдегиды
L-аланин
D-молочная
кислота глицериновые альдегиды
L-аланин
У моносахаридов стереохимический ключ – последний, наиболее уда-ленный от карбонила, асимметрический атом углерода.
У α-гидрокси- и α-аминокарбоновых кислот – α-углеродный атом.

D-винная кислотаD-глицериновый альдегидD-рибоза
В 1951 г. Бийо установил, что конфигурат (+) – глицеринового альдегида имеет D–конфигурацию. Абсолютную конфигурацию других соединений определяют относительно этого стандарта.
Смесь равных количеств энантиомеров, оптически не активное вещество, называют рацерматом (рацермической смесью).
Соединения, которые содержат два и более асимметричных атома образуют наряду с энантиомерами диастереомеры, которые не являются по отношению друг другу оптическими антиподами. Диастереомеры обладают различными физико – химическими свойствами и могут быть разделены аналогично геометрическим изомерам.
Диастереомерия – вид пространственной изомерии, характеризую-щийся существованием стереоизомеров, кроме энантиомеров.
σ-Диастереомерия обусловлена наличием двух и более хиральных центров.
Теоретически возможное число σ-стереомеров определяется по формуле Фишера:
![]()
где N – число стереомеров, n – число хиральных центров.
Среди этих изомеров каждому стереомеру соответствует один энантиомер, остальные (N-2) – диастереомеры.
Пример. 2,3,4-тригидроксибутаналь.
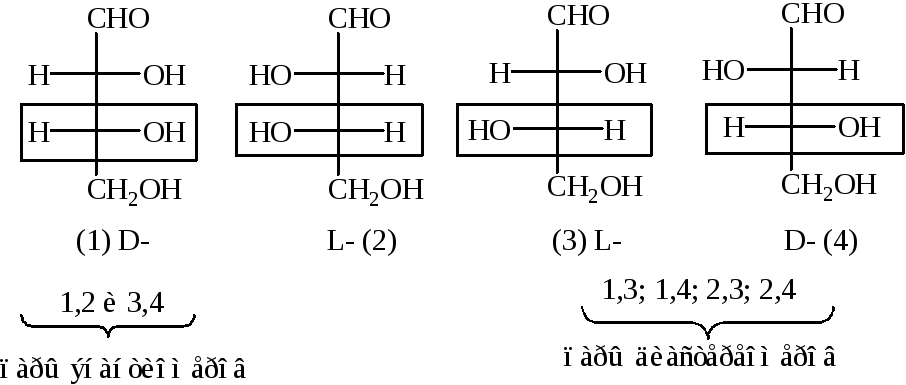
Энантиомеры – пара стереомеров, у которых конфигурация у всех хиральных центров с одинаковым окружением противоположная.
Диастереомеры – пара стереомеров, у которых конфигурация одних хиральных атомов одинаковая, у других – противоположная.
Мезо-форма – ахиральный диастереомер, не имеющий энантиомера. Оба хиральных центра имеют идентичные заместители, имеют плоские симметрии.
Пример. Винные кислоты (2,3 – дигидроксибутандиовая кислота).
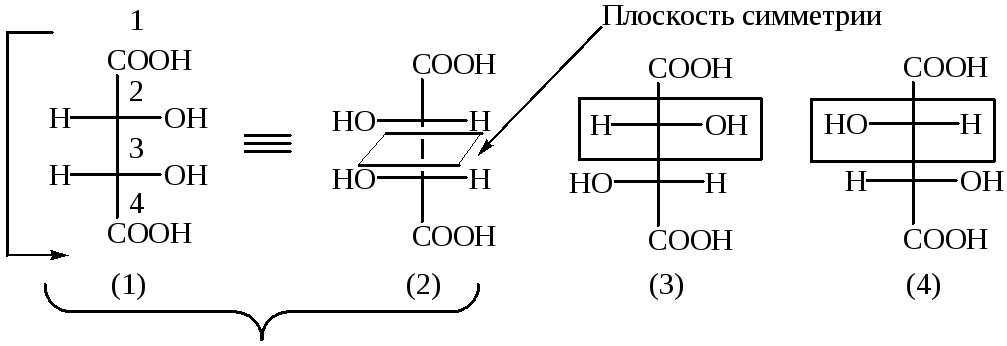
Мезовинная кислота D-винная кислотаL-винная кислота
Псевдоасимметрический атом углерода – sp3-гибридизованный атом углерода с четырьмя заместителями, являющийся центром симметрии и лежащий в плоскости симметрии (разновидность мезоформы)