
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 8 клас
.pdf
Серія «Мій конспект» Заснована 2008 року
Книга скачана с сайта http://e kniga.in.ua
Издательская группа «Основа» — «Электронные книги»
Харків Видавнича група «Основа»
2012
УДК 37.016 ББК 74.262.4 С77
Старовойтова І. Ю.
С77 Хімія. 8 клас / І. Ю. Старовойтова, О. В. Люсай. — Х. : Вид. група «Основа», 2012. — 128 с. — (Серія «Мій конспект»).
ISBN 978-611-00-0232-5.
Посібник містить розробки всіх уроків хімії для 8 класу за чинною програмою загальноосвітньої школи. У розробках уроків широко використовуються сучасні наукові дані й прогресивні педагогічні технології. Докладно описано проведення всіх лабораторних і практичних робіт, передбачених програмою. Для всіх тем наведено кілька варіантів завдань для перевірки знань з теми. Посібник має перфоровані відривні аркуші з полями для внесення змін та доповнень до уроку.
УДК 37.016 ББК 74.262.4
Навчальне видання
Серія «Мій конспект»
Старовойтова Ірина Юріївна Люсай Олена Вікторівна
Хімія 8 клас
Навчально-методичний посібник
Головний редактор К. М. Задорожний
Редактор Л. В. Мариненко Коректор О. М. Журенко
Технічний редактор О. В. Лєбєдєва Комп’ютерне верстання Є. С. Островський
Підп. до друку 26.06.2009. Формат 60×90/8. Папір офсет. Гарнітура Шкільна. Друк офсет. Ум. друк. арк. 18,0. Зам. № 9—07/03—05.
ТОВ «Видавнича група “Основа”».
Свідоцтво суб’єкта видавничої справи ДК № 2911 від 25.07.2007. Україна, 61001 Харків, вул. Плеханівська, 66.
Тел. (057) 731-96-32. E-mail: chem@osnova.com.ua
Віддруковано з готових плівок ПП «Тріада+» Свідоцтво суб’єкта видавничої справи ДК № 1870 від 16.07.2007.
Харків, вул. Киргизька, 19. Тел.: (057) 757-98-16, 757-98-15.
ISBN 978-611-00-0232-5
©Старовойтова І. Ю., Люсай О. В., 2009
©ТОВ «Видавнича група “Основа”», 2012

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Повторення основних питань курсу хімії 7 класу
Урок 1
тема. Основні поняття хімії Цілі уроку: повторити хімічні поняття, що були розглянуті під час ви-
вчення хімії в 7 класі («речовина», «атом», «молекула», «йон»,«хімічнийелемент»,«відноснаатомнаймолекулярна маси», «прості та складні речовини», «хімічна формула», «фізичні й хімічні явища», «хімічні рівняння»).
Тип уроку: узагальнення й систематизація знань. Форми роботи: фронтальна бесіда, групова робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, опорні схеми.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань
У 7 класі ми познайомилися з основними хімічними поняттями й термінами, якими користуються в хімії.
Фронтальна бесіда
— Назвіть, перелічіть ці поняття.
Учні з допомогою вчителя називають основні хімічні поняття.
(Речовина, чисті речовини й суміші, прості та складні речовини, атом, молекула, хімічний елемент, хімічна формула, фізичні й хімічні явища, хімічні реакції, рівняння хімічних реакцій та ін.)
ІІІ. Узагальнення й систематизація знань
Робота в парах з опорною схемою
Опорна схема 1 «Основні поняття хімії»
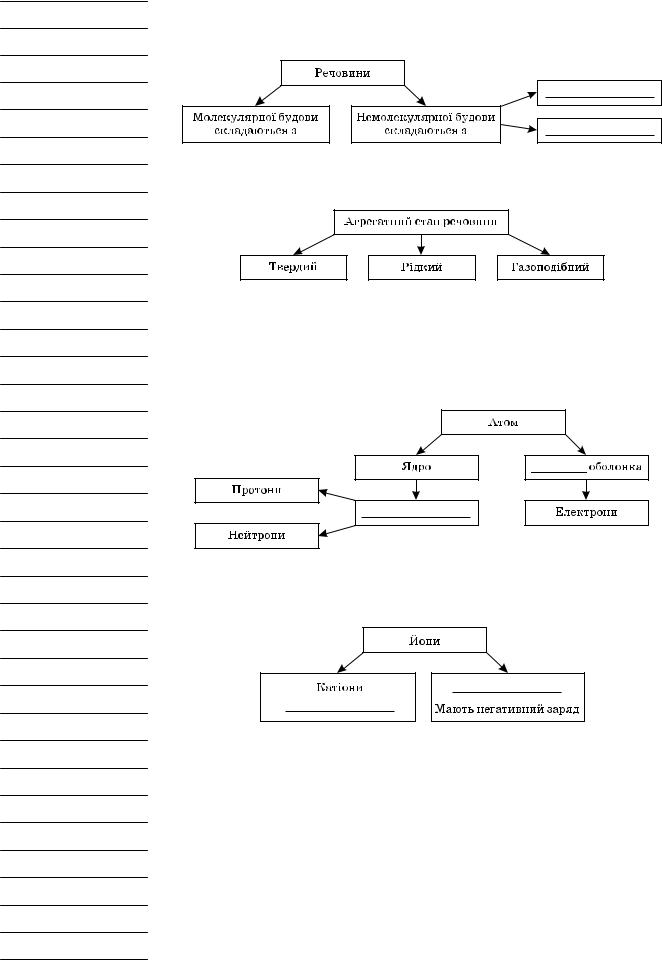
Хімія — наука про ____________, їх властивості, перетворення та явища, що супроводжують ці перетворення.
Речовини — це те, із чого складаються _______________________. Речовини, що існують у природі, постійно зазнають різних змін. Явища — різні ______________, що відбуваються з речовинами.
Фізичні явища — це явища, що не супроводжуються перетвореннями одних речовин на інші (зазвичай змінюється агрегатний стан речовин або їхня форма).
_____________ явища — це явища, у результаті яких з певних речовин утворюються інші.
Хімічні явища називають ___________________________.
Кожна речовина має суворо визначені властивості.
Речовина — ______________________________________________.
Властивості речовин — це ознаки, що дозволяють відрізнити одні речовини від інших або встановити подібність між ними.
3
Наведіть приклади: ______________________________________________
Усі речовини, що існують у природі, являють собою сукупність частинок (атомів, молекул, йонів).
Кожна речовина залежно від умов (температури, тиску) може перебувати в певному агрегатному стані.
________________ — дрібна електронейтральна хімічно неподільна частинка речовини, що складається з позитивно зарядженого ядра й негативно зарядженої електронної оболонки.
Електрон — одна з елементарних частинок ___________________ зарядом. Атомне ядро — центральна, позитивно заряджена частина атома, що скла-
дається з нуклонів, зв’язаних між собою ядерними силами.
_________________________ — вид атомів з певним зарядом ядра.
Молекула — найменша частинка _____________________, що характеризується його хімічними властивостями.
Склад речовин молекулярної будови прийнято виражати з допомогою хімічних формул.
Хімічна формула — умовний запис ___________________ з допомогою хімічних символів та індексів.
Хімічне рівняння — _______________________ хімічної реакції з допомо-
гою _____________________.
IV. Підбиття підсумків уроку
Учні разом з учителем перевіряють правильність заповнення схем, виправляють помилки. Учитель підбиває підсумки уроку, оцінює, заохочує найбільш активних учнів.
V. Домашнє завдання
Повторити основні хімічні поняття.
4

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 2
тема. Прості речовини кисень і залізо Цілі уроку: повторити вивчені відомості про прості речовини — метали
й неметали на прикладі кисню й заліза, їх фізичні та хімічні властивості; удосконалювати навички складання хімічних формул і рівнянь.
Тип уроку: узагальнення й систематизації знань. Форми роботи: групова, індивідуальна.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, картки із завданнями.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання
Опитування по ланцюжку: учні відповідають на запитання з теми «Основні поняття хімії» та ставлять своє питання наступному учневі.
ІІІ. Узагальнення й систематизація вивченого матеріалу
yy На які групи можна поділити всі речовини? (На прості й складні)
yy А на які групи можна поділити прості речовини? (На метали й неметали) yy За якою ознакою? (За фізичними й хімічними властивостями)
yy Які прості речовини вивчили в 7 класі? (Кисень і залізо)
Групова робота
Учні об’єднуються в групи, одержують завдання, заповнюють опорну схему.
Група 1. Оксиген
Хімічний символ — __________
Відносна атомна маса Ar (O) = _______________
Будова атома: +))
Число протонів ___________ р |
Число електронів __________ e− |
Число нейтронів __________ n |
Валентність _________________ |
Група 2. Кисень
Тип речовини ____________
Має ____________________ будову. Хімічна формула _________________
Відносна молекулярна маса Mr (O) = _______________
Фізичні властивості Розчинність у воді _______________________________
Агрегатний стан ___________ |
Колір _______________________ |
Запах ____________________ |
Смак _______________________ |
Група 3. Способи одержання кисню
1.Лабораторні способи Розкладання оксигеновмісних речовин:
KMnO4 → K2MnO4 + +
H2O2 → |
|
|
|
|
+ |
|
|
|
|
|
|
||
KNO3 → KNO2 + |
|
|
|
|
|||||||||
KClO3 → |
|
|
|
+ |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||||
H2O → |
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2.Промисловий спосіб
___________________
Поширення в природі:
___________________
5

Група 4. Хімічні властивості кисню
Взаємодія з неМе
C +O2 → |
S +O2 → |
P +O2 → |
N2 +O2 → |
Взаємодія з Ме |
|
Mg +O2 → |
Li +O2 → |
Al+O2 → |
Cu +O2 → |
Окиснення — це реакція взаємодії ___________________
Горіння — це реакція _______________, що супроводжується виділенням
_______________ і _______________.
Оксиди — складні речовини, що складаються з ___________ елементів,
один з яких _______________.
Група 5. Ферум
Хімічний символ — _____________________
Відносна атомна маса Ar (Fe) = _________________
Будова атома: +))))
Число протонів ___________ р |
Число електронів _________ e− |
Число нейтронів __________ n |
Валентність ________________ |
Група 6. Залізо
Тип речовини _____________________
Має ___________________ будову.
Хімічна формула _____________
Фізичні властивості:
Розчинність у воді _____________________
Агрегатний стан ___________ |
Колір ________________ |
Запах ____________________ |
Смак ________________ |
Специфічні властивості _______________________________
Група 7. Способи одержання заліза
1.Доменне виробництво чавуну.
2.Відновлення заліза зі сполук.
Fe2O3 +H2 →
Fe3O4 +CO →
Fe2O3 +Al →
Fe2O3 +C → Поширення в природі: _____________________
Група 8. Хімічні властивості заліза
1. Взаємодія з неметалами.
Fe +O2 →
Fe +S →
Fe +Cl2 →
2. Взаємодія з кислотами.
Fe +HCl → Корозія — це __________________.
Способи захисту від корозії: ________________________.
Учні складають звіт про виконане завдання, по черзі коментують допущені помилки. Учитель узагальнює відповіді, звертаючи особливу увагу на способи одержання й хімічні властивості простих речовин.
IV. Підбиття підсумків уроку
Учитель підбиває підсумки уроку, оцінює роботу учнів.
V. Домашнє завдання
Повторити матеріал про прості речовини — кисень і залізо.
Творче завдання. Навести свої приклади хімічних властивостей кисню й заліза (по два-три рівняння реакцій).
6

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Тема 1. Кількість речовини. Розрахунки за хімічними формулами
Урок 3
тема. Кількість речовини. Моль — одиниця кількості речовини. Стала Авогадро
Цілі уроку: сформувати уявлення учнів про хімічне поняття «кількість речовини»; показати сутність фізичної величини кількості речовини; ознайомити з одиницею вимірювання кількості речовини; увести поняття «моль», «стала Авогадро».
Тип уроку: вивчення нового матеріалу. Форми роботи: розповідь учителя, бесіда.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань
Фронтальна бесіда
1)Із чого складаються всі речовини на Землі? (З атомів, молекул, йонів)
2)Наведіть приклади речовин молекулярної та немолекулярної будови.
(I2, Cl2; NaCl, CaF2, алмаз)
3)Вякиходиницяхвимірюютьсярозміриатомів?(нм,тобто 10−9 м, ra = 10−14 см
(якщо атом збільшити до розміру друкарської крапки, то пропорційно збільшена людина досягала б зросту близько 7 км))
4)Якою є маса атома? (Це маленька частинка, реальна маса якої оцінюється величиною порядку 10−27 − 10−26 кг)
5)Скільки молекул води H2O міститься в краплі води? (Багато, порядку
1023 молекул)
6)А скільки атомів Карбону міститься в діаманті вагою 1 карат?
Розв’язати задачу нам допоможе величина, з якою ми познайомимося на
сьогоднішньому уроці.
ІІІ. Вивчення нового матеріалу
Ще у ХVIII столітті для хімічних обчислень водночас із масою й об’ємом було введено фізичну величину, яка дозволяла розрахувати кількість структурних частинок (атомів, молекул, йонів) у певній порції речовини. Ця величина одержала назву «кількість речовини».
Кількість речовини — це фізична величина, що показує число структурних частинок (атомів, молекул, йонів) у певній порції цієї речовини. Позначається грецькою літерою ν (ню). Одиниця вимірювання кількості речовини — моль.
Відомий італійський учений Амедео Авогадро вивчив і виміряв кількість речовини для різних речовин. З допомогою спеціальних розрахунків А. Авогадро підрахував, що у 12 г вуглецю міститься 6,02 1023 атомів. Таку кількість речовини взяли за 1 моль.
Подібні розрахунки показали, що:
yy у 32 г сірки міститься 6,02 1023 атомів; yy у 18 г води міститься 6,02 1023 молекул.
Ця величина одержала назву «стала Авогадро». Позначається вона NA = 6,02 1023 частинок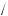 моль, або моль–1. Ця величина не залежить від агрегатного стану речовини.
моль, або моль–1. Ця величина не залежить від агрегатного стану речовини.
7

Отже, 1 моль — це кількість речовини, що містить стільки ж частинок (атомів, молекул, йонів), скільки атомів міститься у 12 г вуглецю, тобто 6,02 1023 частинок.
ν = N ,
NA
де N — число частинок у порції речовини; NA — стала Авогадро.
IV. Закріплення нового матеріалу (керована практика)
1. Обчисліть кількість речовини в порції води, що містить 12,04 1023 молекул.
Дано: |
|
Розв’язання |
|
|
|
|
|
|
|
|
|
|
|||
N(H2O) =12,04 1023 |
молекул |
|
|
ν = |
N |
|
|
ν(H2O) −? |
|
|
|
NA |
|
||
|
|
|
|
|
|||
|
|
|
12,04 1023 молекул |
|
|||
|
|
ν(H |
O) = |
=2 моль. |
|||
|
|
6,02 1023 молекул |
|||||
|
|
2 |
|
|
|||
Відповідь: 2 моль.
2. Обчисліть число атомів Феруму в порції заліза кількістю речовини 5 моль.
Дано: |
Розв’язання |
|
|
ν(Fe) = 5 моль |
ν = |
N |
N = ν NA |
|
|||
N(Fe) — ? |
|
||
|
NA |
||
N(Fe) =5 моль 6,02 1023 атомiв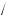 моль =30,1 1023 атомiв.
моль =30,1 1023 атомiв.
Відповідь: 30,01 1023 атомів.
V. Підбиття підсумків
VI. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на питання. Творче завдання. Обчислити кількість атомів Карбону в діаманті масою
1 карат (1 карат = 0,2 г).
Додаток до уроку 4
Варіант |
Формула |
Кількість |
Число |
|
Число атомів |
|
||
речовини |
речовини |
молекул |
|
|
||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
I |
K2SO4 |
0,5 моль |
|
K |
|
S |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
NaNO3 |
1,5 моль |
|
Na |
|
N |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
Ca(OH)2 |
0,8 моль |
|
Ca |
|
Ca |
|
H |
|
|
|
|
|
|
|
|
|
IV |
H3PO4 |
2 моль |
|
H |
|
P |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8

І семестр |
Клас |
Дата проведення уроку |
|
|
|
|
Урок 4 |
тема. |
Обчислення кількості атомів (молекул) у певній кількості |
|
речовини |
Цілі уроку: |
формувати вміння і практичні навички хімічних обчислень |
|
з використанням понять «кількість речовини», «моль», |
|
«стала Авогадро». |
Тип уроку: |
формування вмінь і навичок. |
Форми роботи: |
керована практика, самостійна робота. |
Обладнання: |
Періодична система хімічних елементів Д. І. Менделєєва. |
|
Хід уроку |
|
|
І. Організація класу |
|
|
ІІ. Актуалізація опорних знань |
|
1. |
Тестові завдання (на дошці). |
|
1) |
Кількість речовини вимірюється в одиницях: |
|
|
а) моль; |
б) метр; |
|
в) літр. |
|
2) |
Число частинок, що міститься у 2 моль: |
|
|
а) 12,04 1023; |
б) 6,02 1023; |
|
в) 3,01 1023. |
|
3) |
В 1 моль вуглекислого газу CO2 |
міститься: |
|
а) 1,67 1023 молекул; |
б) 44 молекули; |
в) 6,02 1023 молекул.
2.Якою формулою виражається взаємозв’язок між кількістю речовини та сталою Авогадро?
ν = N , або N = ν NA
NA
3.У чому полягає фізичний зміст «кількості речовини»?
ІІІ. Поглиблення знань, формування вмінь і навичок
Керована практика
Задача 1
Обчисліть кількість молекул у 3 моль натрій карбонату Na2CO3.
Дано: Розв’язання
ν(Na2CO3 ) |
=3 моль |
ν = |
N |
N = ν NA |
||
|
|
N |
|
|||
N(Na2CO3 ) −? |
A |
|||||
|
|
|
||||
N(Na2CO3 ) =3 моль 6,02 1023 молекул моль = |
||||||
|
|
|||||
|
|
=18,06 1023 молекул. |
||||
Відповідь: 18,06 1023 молекул.
Задача 2
Обчисліть кількість атомів Оксигену у 2 моль вуглекислого газу CO2.
Дано: Розв’язання
|
ν(CO2 ) =2 моль |
|
ν = |
N |
N = ν NA |
N(O) — ? |
|
||||
|
NA |
||||
1) |
Обчислюємо кількість молекул CO2 : |
||||
|
|
N(CO2 ) =2 моль 6,02 1023 молекул моль =12,04 1023 молекул. |
|||
2) Одна молекула CO2 містить два атоми Оксигену, отже |
|||||
|
ν(O2 ) = |
2 ν(O) =2 12,08 1023 =24,16 1023 (атомів). |
|||
Відповідь: 24,16 1023 атомів.
9

Задача 3
Обчисліть кількість речовини сульфатної кислоти H2SO4 у зразку, що містить 3,01 1023 молекул.
Дано: |
|
Розв’язання |
|
||||||
|
|
||||||||
N(H2SO4 ) =3,01 1023 молекул |
|
|
|
|
|
ν= |
N |
|
|
ν(H2SO4 ) −? |
|
|
|
|
|
NA |
|
||
|
|
|
|
|
|
|
|||
|
ν(H |
|
|
) = |
3,01 1023 молекул |
|
|||
|
|
SO |
|
= 0,5 моль. |
|||||
|
|
|
6,02 1023 молекул моль |
||||||
|
|
2 |
|
4 |
|
|
|||
Відповідь: 0,5 моль.
IV. Самостійна робота під керівництвом учителя з картками
Завдання: обчисліть число молекул складної речовини й число атомів кожного хімічного елемента в заданій кількості речовини (див. Додаток до уроку на с. 8).
Після виконання завдання виписуємо відповіді на дошці, коригуємо. Складаємо алгоритм розв’язання.
1.Обчислити число молекул складної речовини за формулою N = ν NA.
2.За хімічною формулою речовини визначити число атомів кожного елемента в молекулі складної речовини.
3.Обчислити кількість атомів хімічного елемента в заданій кількості речовини.
V. Керована практика. Розвивальне завдання
Обчисліть кількість речовини кисню, що прореагує без залишку із залізом кількістю речовини 2 моль з утворенням ферум(ІІІ) оксиду.
Для того щоб розв’язати задачу, згадаймо курс хімії 7 класу.
— Що показує рівняння хімічної реакції?
yy Які речовини взаємодіють між собою (формули речовин).
yy В якому співвідношенні ці речовини взаємодіють одна з одною (коефіцієнти в рівнянні реакції).
Правило. Кількість речовини будь-яких попарно взятих речовин у рівнянні реакції співвідносяться як їхні коефіцієнти в рівнянні реакції.
Розв’яжемо задачу. |
|
|
||||
Дано: |
|
Розв’язання |
|
|
||
|
|
|
||||
ν(Fe) = 2 моль |
1) |
Складемо рівняння реакції: |
|
|||
|
|
|
4Fe +3O2 |
→2Fe2O3 |
||
ν(O2 ) |
−? |
|
||||
2) |
Запишемо над рівнянням відомі кількості речовини: |
|||||
|
|
|||||
|
|
|
2 моль |
х моль |
|
|
|
|
|
4Fe |
+ 3O2 |
→2Fe2O3 |
|
|
|
|
||||
3) За рівнянням хімічної реакції, 4 моль заліза реагують із 3 моль кисню:
|
|
|
2 моль |
х моль |
|
|
|
|
4Fe |
+ 3O2 |
→2Fe2O3 |
||
|
|
|
4 моль |
3 моль |
|
|
4) Складемо пропорцію: |
|
|
|
|
|
|
|
2 |
|
= |
x |
; 4x = 6; x = 1,5. |
|
4 |
|
|
||||
3 |
|
|
||||
Отже, ν(O2 ) =1,5 моль. |
|
|
|
|
|
|
Відповідь: 1,5 моль кисню реагують із 2 моль заліза.
VI. Підбиття підсумків
VII. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на питання. Творче завдання. В якій кількості речовини ферум(ІІІ) оксиду міститься
18,06 1023 атомів Феруму? Скільки атомів Феруму міститься в такій же кількості речовини ферум(ІІ) оксиду?
10
