- •Министерство образования и науки Российской Федерации
- •Предисловие
- •Введение
- •Часть 1. Современные представления о строении различных групп материалов
- •Глава 1. Основные различия в свойствах групп материалов
- •Типы химической и физической связей в материалах
- •В материалах:
- •1.2. Материалы с различным типом химической связи
- •1.2.1. Металлы и сплавы (металлический тип связи)
- •1.2.2. Полимеры (ковалентный и молекулярно - ковалентный типы связи)
- •1.2.3. Керамика (ковалентный и ионный типы связи)
- •1.2.4. Карбиды и интерметаллиды (ковалентно - металлический тип связи)
- •1.2.5. Композиционные материалы (смешанный тип связей)
- •Pис. 1.2. Схематическое представление вклада разных типов связи в материалах
- •Вопросы для самопроверки
- •Часть 2. Металлические материалы
- •Глава 2. Строение и свойства металлов и сплавов
- •2.1. Кристаллическое строение металлов и сплавов
- •Кристаллические структуры переходных металлов 4-го периода*
- •Внедрения; б – твердый раствора замещения со статистическим распределением атомов; в – упорядоченный твердый раствор замещения
- •Из сплавов (деформируемых)
- •2.2. Несовершенства кристаллической структуры
- •Линейные и точечные несовершенства кристаллической структуры
- •2.3. Основные свойства и характеристики металлов и сплавов
- •Характеристики механических свойств
- •Характеристики физических свойств
- •Характеристики химических свойств
- •Характеристики технологических свойств.
- •2.4. Пластическая деформация
- •Пластической деформации [с.В. Грачев, в.Р. Бараз и др.]
- •В зависимости от степени холодной деформации: ρ – удельное электросопротивление; Ηс – коэрцитивная сила; μ – магнитная проницаемость;
- •Температуры отжига холоднодеформированного металла
- •Температура начала рекристаллизации, интервал температур рекристаллизационного отжига и горячей обработки давлением
- •2.5. Термическая обработка
- •Технологические параметры термообработки
- •Время нагрева τн, температура выдержки tв, время выдержки τ в, скорость охлаждения V охл
- •Скорости охлаждения при различных видах термической обработки
- •Скорость охлаждения при каждом виде термообработки предопределяет равновесность или неравновесность получаемых продуктов фазовых превращений.
- •И отпуске (б). Исходное состояние: пересыщенный при закалке твердый раствор (а); мартенсит углеродистый (б)
- •Термообработка – отжиг
- •Типы отжигов для сплавов разного состава
- •Отжиги первого рода
- •Типы отжигов первого рода
- •Отжиги второго рода
- •Отжиги второго рода. Отжиги углеродистых сталей
- •Общепринятые обозначения линий и критических точек на диаграмме железо-цементит
- •Эвтектоид носит название перлит (п). Перлит – это структура, состоящая из двух фаз: феррита и цементита, частицы которых имеют пластинчатое строение (рис. 2.22, а).
- •Фазовый состав сталей после отжига в зависимости от содержания углерода
- •Технологические параметры специальных отжигов сталей
- •Микроструктура пластинчатого (б) и сферического(зернистого) (в) цементита
- •Для доэвтектоидной стали с 0,45 % углерода; скорости охлаждения: V 1 – с печью; v2 – на воздухе; v3 – в масле; v4 – в воде
- •Продукты диффузионного распада переохлажденного аустенита
- •Перлит может быть получен при охлаждении с печью, сорбит – при охлаждении на воздухе, а троостит–при больших скоростях охлаждения и даже при закалке.
- •Упрочняющая термическая обработка: закалка и старение
- •От температуры (а) и времени (б) старения: t1 ‹ t2 ‹ t3; о – максимум твердости;
- •Закалка и отпуск сталей
- •Закалка сталей на мартенсит
- •Технология закалки
- •Образца(Vц), перлитную структуру на поверхности(Vп) – мартенситную
- •Отпуск сталей
- •От температуры отпуска (и.И. Новиков) Виды отпуска и применение
- •Виды отпуска и структуры сталей
- •2.6. Термомеханическая обработка сталей
- •Рекристаллизации
- •2.7. Поверхностная обработка сталей и сплавов
- •Химико-термическая обработка сплавов.
- •Хто с диффузионным насыщением углеродом и азотом
- •Нитроцементация (азотонауглероживание)
- •Параметры процессов хто, характеристики слоя и свойства сталей
- •Химико-термическая обработка с диффузионным насыщением металлами (диффузионная металлизация)
- •Поверхностная закалка сталей
- •Поверхностная лазерная обработка
- •Виды поверхностной лазерной обработки
- •Поверхностное пластическое деформирование
- •Способы ппд
- •2.8. Обеспечение служебных характеристик и повышение технико-экономической эффективности применения металлических материалов
- •2.8.1. Статическая прочность сплавов
- •Обеспечение статической прочности сплавов композиционных и гетерофазных материалов
- •2.8.2. Циклическая прочность
- •Факторы, влияющие на предел выносливости
- •2.8.3. Контактная выносливость
- •Способы обеспечения контактной выносливости:
- •Коэффициент вязкости разрушения различных материалов
- •2.8.5. Износостойкость
- •Стали и сплавы для работы в контакте с рабочей средой
- •Твердость и модуль упругости карбидов
- •2.8.6. Жаропрочность
- •2.8.7. Термостойкость
- •2.8.8. Поверхностная стойкость
- •Обеспечение жаростойкости
- •Вопросы для самопроверки
- •Глава 3. Сплавы на основе железа
- •3.1. Машиностроительные конструкционные стали
- •3.1.1. Классификация конструкционных сталей
- •Классификация сталей по химическому составу
- •Классификация и маркировка в зависимости от качества стали
- •3.1.2. Углеродистые стали
- •3.1.3. Легированные стали
- •Влияние легирующих элементов на структуру и свойства сталей
- •Влияние легирующих элементов на феррит
- •Влияние легирующих элементов на аустенит и мартенсит
- •Цементуемые легированные стали
- •Улучшаемые легированные стали
- •Механические свойства некоторых улучшаемых сталей
- •Критический диаметр легированных сталей
- •Характеристика высокопрочных сталей
- •Комплекс механических свойств среднеуглеродистых легированных сталей, упрочняемых закалкой с последующим низким отпуском
- •Н18к9м5т от температуры старения
- •Механические свойства мартенситно-стареющих сталей системы Fe–Ni–Co–Mo–Ti
- •3.1.4. Стали для подшипников качения
- •Требования к подшипниковым сталям и пути обеспечения необходимых свойств
- •Термическая обработка подшипниковых сталей типа шх
- •3.1.5. Стали рессорно-пружинные
- •Предел текучести рессорно-пружинных сталей общего назначения*
- •Марки и применение рессорно-пружинных сталей
- •3. 2. Стали специального назначения
- •3.2.1. Коррозионностойкие стали
- •3.2.2. Жаростойкие стали
- •3.2.3. Жаропрочные стали
- •Двс и пути их обеспечения
- •Условия эксплуатации:
- •3.3. Чугуны
- •Химический состав конструкционных чугунов
- •Форма графита и названия чугунов
- •Зависимость механических свойств чугунов от формы графита и структуры металлической части
- •3.3.1. Серые чугуны
- •Применение серых чугунов
- •3.3.2. Высокопрочные чугуны
- •Применение высокопрочных чугунов
- •Применение чугунов с вермикулярным графитом
- •3.3.4.Ковкие чугуны
- •Применение ковких чугунов
- •Применение специальных чугунов
- •3.4. Порошковые конструкционные и легированные стали
- •3.4.1. Классификация порошковых сталей
- •Марки и применение пористых конструкционных материалов
- •3.4.2. Применение порошковых сталей
- •Вопросы для самопроверки
- •Глава 4. Цветные металлы и сплавы
- •4.1. Алюминиевые сплавы
- •Удельная прочность конструкционных сплавов
- •4.1.1. Классификация и маркировка алюминиевых сплавов
- •Соответственно
- •Условные обозначения видов термической обработки деформируемых сплавов
- •4.1.2. Деформируемые сплавы
- •Разрыву и относительное удлинение в мягком состоянии
- •Подготовленная для плакировки
- •Характеристики надежности сплава в95
- •Механические свойства алюминиевых деформируемых сплавов, упрочняемых термообработкой
- •4.1.3. Литейные алюминиевые сплавы Сплавы на основе системы Al – Si
- •Сплавы на основе системы Al – Cu
- •Сплавы на основе системы Al – Mg
- •4.2. Медь и медные сплавы
- •И зависимость механических свойств от содержания цинка (б)
- •(Кроме бериллиевых бронз)
- •4.2.1. Латуни
- •Механические свойства *и назначение литейных латуней
- •4.2.2. Бронзы
- •Механические свойства*деформируемых (гост 5017–74) и литейных (гост 613–79) оловянных бронз
- •Механические свойства* деформируемых и литейных алюминиевых бронз
- •Механические свойства бериллиевой бронзы БрБ2 в зависимости от состояния сплава
- •4.3. Титановые сплавы
- •4.3.1. Легирующие элементы титановых сплавов
- •4.3.2.Фазовые превращения в титановых сплавах
- •Сплавов (легированных β - стабилизаторами)
- •4.3.3. Термическая обработка титановых сплавов
- •4.3.4. Классификация промышленных титановых сплавов
- •4.3.5. Деформируемые сплавы
- •Химические составы и свойства после отжига титановых деформируемых сплавов
- •Применение и свойства титановых деформируемых сплавов
- •4.3.6.Литейные сплавы
- •4.4. Магниевые сплавы
- •4.5. Антифрикционные (подшипниковые) сплавы на оловянной, свинцовой и цинковой основах
- •Критериями оценки антифрикционных материалов являются:
- •Требуемые свойства сплавов для подшипников скольжения
- •Темное поле – твердый раствор сурьмы в олове; светлые крупные частицы – химическое соединение SnSb, мелкие частицы – Cu3Sn (справа – схематическое изображение микроструктуры)
- •Вопросы для самопроверки
- •Часть 3. Неметаллические материалы
- •Глава 5. Общая характеристика неметаллических материалов
- •5.1. Классификация, строение и способы получения полимеров
- •5.2. Фазовые состояния и надмолекулярная структура полимеров
- •Надмолекулярная структура аморфных полимеров
- •5.3. Физические состояния полимеров
- •Термомеханические кривые кристаллических полимеров
- •Термомеханические кривые сетчатых полимеров
- •5.4. Способы управления структурой и свойствами полимерных материалов
- •Вопросы для самопроверки
- •Глава 6. Основные свойства неметаллических материалов
- •6.1. Механические свойства
- •6.2. Теплофизические свойства
- •6.3. Диэлектрические свойства
- •Классификация диэлектриков по диэлектрической проницаемости
- •Классификация диэлектриков по диэлектрическим потерям
- •Вопросы для самопроверки
- •Глава 7. Пластические массы
- •7.1. Основные виды модифицирующих добавок
- •7.2. Термопластичные полимеры и материалы на их основе
- •Полиэтилен
- •Полипропилен
- •Полиизобутилен
- •Полистирол
- •Политетрафторэтилен (ф-4)
- •Политрифторхлорэтилен (ф-3)
- •Поливинилхлорид
- •Полиакрилаты
- •Полиамиды
- •Полиуретаны
- •Поликарбонаты
- •Полиимиды
- •Полиэтилентерефталат
- •Полиформальдегид
- •Пентапласт
- •Марочный ассортимент и области применения термопластов
- •7.3. Термореактивные полимеры и материалы на их основе
- •Фенолоформальдегидные смолы
- •Эпоксидные смолы
- •Полиэфирные смолы
- •Кремнийорганические смолы
- •Марочный ассортимент и области применения основных термореактивных пресс-материалов и литьевых пм
- •7.4. Термоэластопласты
- •7.5. Методы получения изделий из пластических масс
- •7.5.1. Прессование
- •7.5.2. Литье под давлением
- •7.5.3. Экструзия
- •7.5.4. Термоформование
- •7.5.5. Механическая обработка пластмасс
- •7.6. Газонаполненные пластики
- •Вопросы для самопроверки
- •Глава 8. Волокнистые полимерные композиционные материалы
- •Типичные классификационные модели ап
- •8.1. Стеклопластики
- •8.2. Углепластики
- •8.3. Органопластики
- •Свойства элементарных волокон
- •8.4. Базальтопластики
- •8.5. Термопластичные композиционные материалы
- •8.6. Методы формования изделий из армированных пластиков
- •8.6.1. Контактное формование и напыление
- •8.6.2. Формование под давлением
- •8.6.3. Формование прессованием и пропиткой в замкнутой форме
- •8.6.4.Формование намоткой
- •8.6.5. Пултрузия
- •Вопросы для самопроверки
- •Глава 9. Природные полимеры и их производные Эфиры целлюлозы
- •Вопросы для самопроверки
- •Глава 10. Резиновые материалы
- •10.1. Классификация каучуков
- •10.2. Компоненты резиновых смесей
- •10.3. Способы получения резинотехнических изделий
- •10.4. Прорезиненные ткани
- •10. 5. Применение резинотехнических изделий
- •Вопросы для самопроверки
- •Глава 11. Клеевые материалы
- •11.1.Клеи на основе термопластичных полимеров
- •11.2. Клеи на основе эластомеров
- •11.3. Клеевые (липкие) ленты
- •11.4. Клеи на основе термореактивных смол
- •Вопросы для самопроверки
- •Глава 12. Герметики
- •Вопросы для самопроверки
- •Глава 13. Лакокрасочные материалы
- •13.1. Требования к лакокрасочным материалам
- •13.2. Классификация и виды лакокрасочных материалов
- •13.3. Полимерные порошковые композиции и покрытия на их основе
- •Способы нанесения порошковых покрытий
- •Вопросы для самопроверки
- •Глава 14. Обивочные, прокладочные, уплотнительные и электроизоляционные материалы
- •Вопросы для самопроверки
- •Глава 15. Неорганические материалы
- •15.1. Технические керамики
- •Гексагональными слоями ( а и в) атомов кислорода
- •15.2. Неорганические стекла
- •Стекла с особыми свойствами
- •Стекла в автомобилестроении
- •15.3. Стеклокристаллические материалы
- •15.4. Слюда и слюдяные материалы
- •15.5. Асбест и материалы на его основе
- •Вопросы для самопроверки
- •Глава 16. Жидкокристаллические материалы
- •16.1. Классификация, структура и свойства жидких кристаллов
- •16.2. Жидкокристаллические композиты
- •Вопросы для самопроверки
- •Список литературы Основные литературные источники
- •Дополнительные литературные источники
Вопросы для самопроверки
1. Почему вещества с ковалентным и ионным типами связи имеют высокие температуры плавления?
2. Почему металлы являются проводниками, а оксиды – диэлектриками и полупроводниками?
3. Каким образом коэффициент теплового расширения материалов связан с типом химической связи?
4. Материалы с каким типом связи являются наименее трудоемкими в производстве деталей и конструкций?
5. Материалы с каким типом связи являются наиболее трудоемкими в производстве деталей?
6. В чем преимущество металлов и сплавов перед другими материалами?
7. Вещества с какими типами связи являются матрицей и наполнителями большинства композиционных материалов?
Часть 2. Металлические материалы
Глава 2. Строение и свойства металлов и сплавов
2.1. Кристаллическое строение металлов и сплавов
Металлы и их сплавы относятся к поликристаллическим телам, которые характеризуются закономерным периодическим расположением атомов или ионов в пространстве. Если соединить атомы воображаемыми линиями в трех взаимно перпендикулярных направлениях, то получится пространственная кристаллическая решетка. Ее наименьшим структурным образованием является элементарная ячейка, контур которой представляет собой составленное из атомов геометрическое тело, например, куб или шестигранную призму.
|
| ||||||
|
|
а |
|
б |
|
в |
|
α-Fe,
β-Ti
Mo,
W, V
γ- Fe, Al, Cu,
Ni, Ag, Au
Рис. 2.1. Типы кубических решеток: простая (а), объемноцентрированная (б), гранецентрированная (в) и примеры металлов, имеющих такие решетки
Кубическая решетка может быть простой, т.е. такой, в вершинах которой находятся атомы (ионы); объемноцентрированной (ОЦК), у которой один атом расположен в центре куба; гранецентрированной, у которой атомы расположены в центрах граней (ГЦК) (рис. 2.1). Кристаллические решетки характеризуются параметром (межатомное расстояние, измеряемое между двумя соседними плоскостями), координационным числом (количеством атомов – соседей, находящихся на ближайшем расстоянии от данного атома) и плотностью упаковки.
|
а |
б |
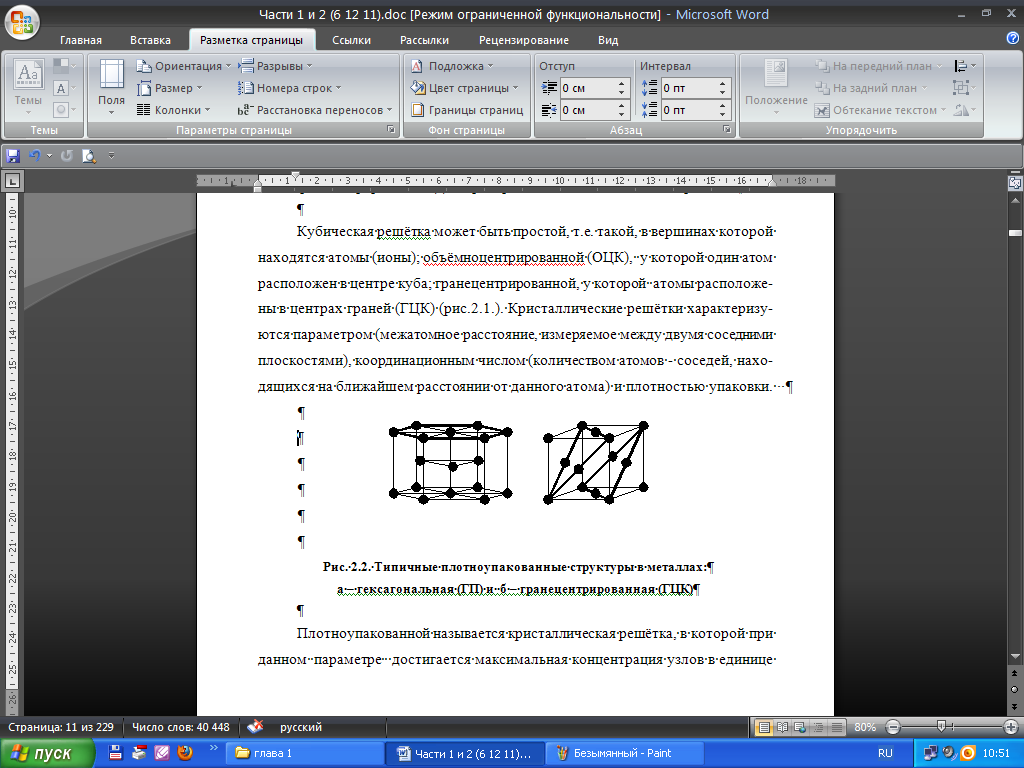
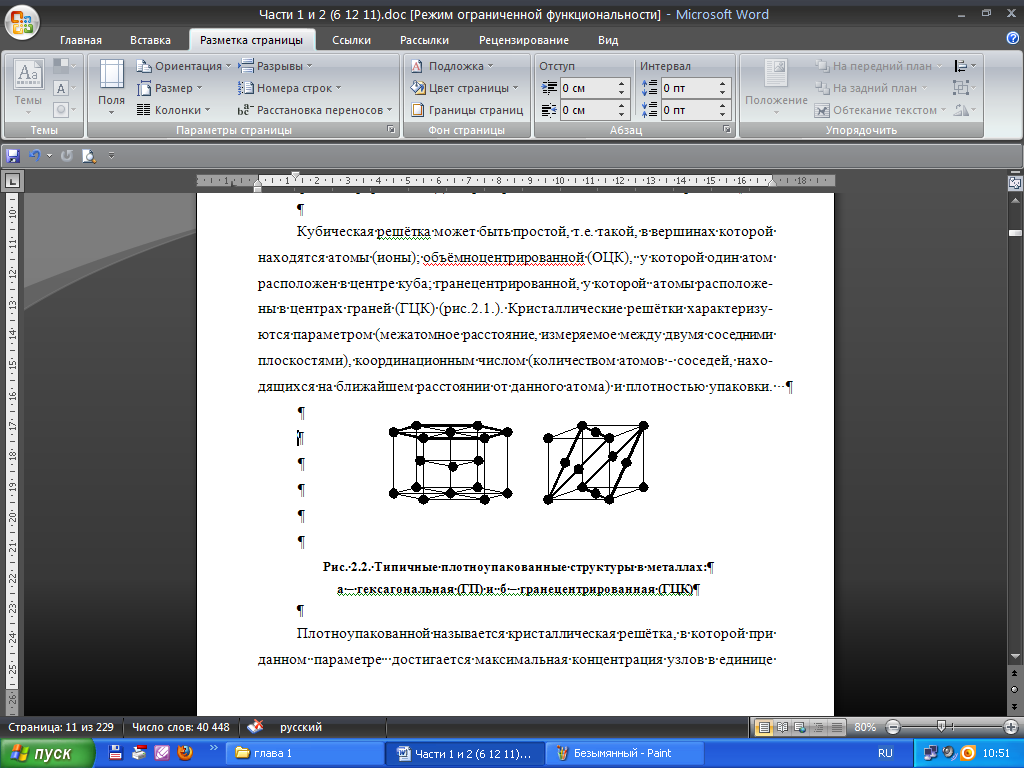
Рис. 2.2. Типичные плотно упакованные структуры в металлах:
а – гексагональная (ГП) и б – гранецентрированная (ГЦК)
Плотно упакованной называется кристаллическая решетка, в которой при данном параметре достигается максимальная концентрация узлов в единице объема. Плотноупакованной является гранецентрированная решетка, а также гексагональная плотноупакованная решетка (ГПУ) (рис. 2.2). Типы кристаллических решеток определяются при помощи рентгеноструктурного анализа.
Существуют кристаллы, которые могут иметь различные кристаллические решетки в зависимости от температуры (две или несколько). Такое явление называется полиморфизмом или аллотропией. Наибольшее значение полиморфизм имеет в переходных металлах, применяемых в технике. К ним относятся: железо, кобальт, скандий, титан (по две модификации), марганец (четыре модификации). Модификации металлов обозначаются малыми греческими буквами; при этом низкотемпературная модификация обычно обозначается α. Например, для железа – α и γ; для титана – α и β (табл. 2.1).
Объемноцентрированные кристаллические решетки имеют: α - железо, β - титан, ванадий, хром, молибден, вольфрам; гранецентрированные решетки имеют: γ – железо, никель, алюминий, медь; гексагональные плотно упакованные имеют: магний, α - титан, цинк. Кристаллические решетки представляют собой идеальную, совершенную структуру кристалла.
Таблица 2.1