
- •Глава 1 синдром системного ответа на воспаление 10
- •Глава 2 малоинвазивные технологии в хирургии 19
- •Глава 3. Шея 36
- •Глава 4. Щитовидная железа.Паращитовидные железы 42
- •Глава 5. Молочные железы 73
- •Глава 6 грудная клетка, трахея, бронхи, легкие, плевра 103
- •Глава 7. Пищевод 172
- •Глава 8 диафрагма 204
- •Глава 9. Живот 210
- •Глава 10 грыжи живота 223
- •Глава 11. Желудок и двенадцатиперстная кишка 243
- •Глава 12. Печень 314
- •Глава 13. Желчный пузырь и желчные протоки 337
- •Глава 14. Поджелудочная железа 360
- •Глава 15. Селезенка 394
- •Глава 16. Средостение 407
- •Глава 17 сердце. Перикард 422
- •Глава 18. Аорта и периферические артерии 455
- •Глава 19. Вены конечностей 503
- •Глава 20 лимфатические сосуды конечностей 533
- •Глава 1 синдром системного ответа на воспаление
- •Глава 2 малоинвазивные технологии в хирургии
- •2.1. Видеоэндоскопическая хирургия
- •2.1.1. Видеолапароскопическая хирургия
- •2.1.2. Торакоскопическая хирургия
- •2.2. Интервенционная радиология
- •Глава 3. Шея
- •3.1. Пороки развития
- •3.2. Повреждения органов шеи
- •3.3. Абсцессы и флегмоны
- •3.4. Лимфаденит (специфический и неспецифический)
- •3.5. Опухоли шеи
- •Глава 4. Щитовидная железа.Паращитовидные железы
- •4.1. Методы исследования
- •4.2. Заболевания щитовидной железы
- •4.2.1. Диффузный токсический зоб (болезнь Грейвса, базедова болезнь)
- •4.2.2. Токсическая аденома (болезнь Пламмера)
- •4.2.3. Многоузловой токсический зоб
- •4.2.4. Эндемический зоб (йоддефицитные заболевания)
- •4.2.5. Спорадический зоб (простой нетоксический зоб)
- •4.2.6. Аберрантный зоб
- •4.2.7. Тиреоидиты
- •4.2.8. Гипотиреоз
- •4.3. Опухоли щитовидной железы
- •4.3.1. Доброкачественные опухоли (фолликулярные аденомы)
- •4.3.2. Злокачественные опухоли.
- •4.4. Паращитовидные железы
- •4.4.1. Заболевания паращитовидных желез
- •4.4.1.1. Гиперпаратиреоз
- •4.4.1.2. Гипопаратиреоз
- •4.4.1.3. Опухоли паращитовидных желез
- •Глава 5. Молочные железы
- •5.1. Методы исследования
- •5.2. Пороки развития
- •5.3. Повреждения молочных желез
- •5.4. Воспалительные заболевания
- •5.4.1 Неспецифические воспалительные заболевания
- •5.4.2. Хронические специфические воспалительные заболевания
- •5.5. Дисгормональные дисплазии молочных желез
- •5.5.1 Мастопатия
- •5.5.2. Выделения из сосков
- •5.5.3. Галактоцеле
- •5.5.4. Гинекомастия
- •5.6. Опухоли молочной железы
- •5.6.1. Доброкачественные опухоли
- •5.6.2. Злокачественные опухоли
- •5.6.2.2. Рак молочной железы in situ
- •5.6.2.3. Рак молочной железы у мужчин
- •5.6.2.4. Саркома молочной железы
- •Глава 6 грудная клетка, трахея, бронхи, легкие, плевра
- •6.1. Методы исследования
- •6.2. Грудная стенка
- •6.2.1. Врожденные деформации грудной клетки
- •6.2.2. Повреждения грудной клетки
- •6.2.3. Воспалительные заболевания
- •6.2.4. Специфические хронические воспалительные заболевания грудной стенки
- •6.2.5. Опухоли грудной стенки
- •6.3. Трахея
- •6.3.1 Пороки развития
- •6.3.2. Травматические повреждения
- •6.3.3. Воспалительные заболевания
- •6.3.4. Стенозы трахеи
- •6.3.5. Пищеводно-трахеальные свищи
- •6.3.6. Опухоли трахеи
- •6.4. Легкие. Бронхи
- •6.4.1. Пороки развития бронхиального дерева и легочной паренхимы
- •6.4.2. Пороки развития сосудов легких
- •6.4.3. Воспалительные заболевания
- •6.4.3.1. Абсцесс легкого
- •6.4.3.2. Гангрена легкого
- •6.4.3.3. Хронический абсцесс легкого
- •6.4.4. Специфические воспалительные заболевания
- •6.4.4.1. Туберкулез легких
- •6.4.4.2. Сифилис легких
- •6.4.4.3. Грибковые заболевания легких (микозы)
- •6.4.4.4. Актиномикоз легких
- •6.4.5. Бронхоэктатическая болезнь
- •6.4.6. Кисты легких
- •6.4.7. Эхинококкоз легких
- •6.4.8. Опухоли легких
- •6.4.8.1. Доброкачественные опухоли
- •6.4.8.2. Злокачественные опухоли
- •6.4.8.2.1. Рак легких
- •6.5. Плевра
- •6.5.1 Травматические повреждения
- •6.5.1.1. Пневмоторакс
- •6.5.2. Воспалительные заболевания плевры
- •6.5.2.1. Экссудативный неинфекционный плеврит
- •6.5.2.2. Острая эмпиема плевры
- •6.5.2.3. Хроническая эмпиема
- •6.5.3. Опухоли плевры
- •6.5.3.1. Первичные опухоли плевры
- •6.5.3.2. Вторичные метастатические опухоли
- •Глава 7. Пищевод
- •7.1. Методы исследования
- •7.2. Врожденные аномалии развития
- •7.3. Повреждения пищевода
- •7.4. Инородные тела пищевода
- •7.5. Химические ожоги и рубцовые сужения пищевода
- •7.6. Нарушения моторики пищевода
- •7.6.1. Ахалазия кардии (кардиоспазм)
- •7.6.2. Халазия (недостаточность) кардии
- •7.7. Рефлюкс-эзофагит (пептический эзофагит)
- •7.8. Дивертикулы пищевода
- •7.9. Опухоли пищевода
- •7.9.1. Доброкачественные опухоли и кисты
- •7.9.2. Злокачественные опухоли
- •7.9.2.2. Саркома
- •Глава 8 диафрагма
- •8.1. Методы исследования
- •8.2. Повреждения диафрагмы
- •8.3. Диафрагмальные грыжи
- •8.4. Грыжи пищеводного отверстия диафрагмы
- •8.5. Релаксация диафрагмы
- •Глава 9. Живот
- •9.1. Методы исследования
- •9.2. Острый живот
- •9.3. Травмы живота
- •9.4. Заболевания брюшной стенки
- •9.5. Опухоли брюшной стенки
- •Глава 10 грыжи живота
- •10.1. Наружные грыжи живота
- •10.1.1. Паховые грыжи
- •10.1.2. Бедренные грыжи
- •10.1.3. Эмбриональные грыжи
- •10.1.4. Пупочные грыжи
- •10.1.5. Грыжи белой линии живота
- •10.1.6. Травматические и послеоперационные грыжи
- •10.1.7. Редкие виды грыж живота
- •10.1.8. Осложнения наружных грыж живота
- •10.2. Внутренние грыжи живота
- •Глава 11. Желудок и двенадцатиперстная кишка
- •11.1. Методы исследования
- •11.2. Пороки развития
- •11.3. Инородные тела желудка и двенадцатиперстной кишки
- •11.4. Химические ожоги и рубцовые стриктуры желудка
- •11.5. Повреждения желудка и двенадцатиперстной кишки
- •11.6. Язвенная болезнь желудка и двенадцатиперстной кишки
- •11.6.1. Осложнения язвенной болезни
- •11.6.1.1. Желудочно-кишечные кровотечения
- •11.6.1.2. Перфорация язвы
- •11.6.1.3. Пилородуоденальный стеноз
- •11.6.1.4. Пенетрация язвы
- •11.7. Острые язвы
- •11.8. Патологические синдромы после операций на желудке
- •11.9. Опухоли желудка и двенадцатиперстной кишки
- •11.9.1. Доброкачественные опухоли желудка
- •11.9.2. Злокачественные опухоли желудка
- •11.9.2.1. Рак желудка
- •11.9.2.2. Саркома желудка
- •11.9.2.3. Лимфома желудка
- •11.9.3. Опухоли двенадцатиперстной кишки
- •Глава 12. Печень
- •12.1. Специальные методы исследования
- •12.2. Пороки развития
- •12.3. Травмы печени
- •12.4. Абсцессы печени
- •12.4.1. Бактериальные абсцессы
- •12.4.2. Паразитарные абсцессы
- •12.5. Паразитарные заболевания печени
- •12.5.1. Эхинококкоз
- •12.5.2. Альвеококкоз
- •12.5.3. Описторхоз
- •12.6. Непаразитарные кисты печени
- •12.7. Хронические специфические воспалительные заболевания
- •12.8. Опухоли печени
- •12.8.1. Доброкачественные опухоли
- •12.8.2. Злокачественные опухоли
- •12.9. Синдром портальной гипертензии
- •12.10. Печеночная недостаточность
- •Глава 13. Желчный пузырь и желчные протоки
- •13.1. Специальные методы исследования
- •13.2. Врожденные аномалии развития желчевыводящих протоков
- •13.3. Повреждения желчных путей
- •13.4. Желчнокаменная болезнь
- •13.4.1. Хронический калькулезный холецистит
- •13.4.2. Острый холецистит
- •13.5. Бескаменный холецистит
- •13.6. Постхолецистэктомический синдром
- •13.7. Опухоли желчного пузыря и желчных протоков
- •13.8. Желтуха
- •Глава 14. Поджелудочная железа
- •14.1. Аномалии и пороки развития
- •14.2. Повреждения поджелудочной железы
- •14.3. Острый панкреатит
- •14.4. Хронический панкреатит
- •14.5. Кисты и свищи поджелудочной железы
- •14.6. Опухоли поджелудочной железы
- •14.6.1. Доброкачественные опухоли
- •14.6.2. Злокачественные опухоли
- •14.6.2.1. Рак поджелудочной железы
- •14.6.3. Нейроэндокринные опухоли
- •Глава 15. Селезенка
- •15.1. Пороки развития
- •15.2. Повреждения селезенки
- •15.3. Заболевания селезенки
- •15.4. Гиперспленизм
- •Глава 16. Средостение
- •16.1. Повреждения средостения
- •16.2. Воспалительные заболевания
- •16.2.1. Нисходящий некротизирующий острый медиастинит
- •16.2.2. Послеоперационный медиастинит
- •16.2.3. Склерозирующий (хронический) медиастинит
- •16.3. Синдром верхней полой вены
- •16.4. Опухоли и кисты средостения
- •16.4.1. Неврогенные опухоли
- •16.4.2. Тимомы
- •16.4.3. Дизэмбриогенетические опухоли
- •16.4.4. Мезенхимальные опухоли
- •16.4.5. Лимфоидные опухоли
- •16.4.6. Кисты средостения
- •Глава 17 сердце. Перикард
- •17.1. Специальные методы исследования
- •17.2. Обеспечение операций на сердце и крупных сосудах
- •17.3. Ранения сердца и перикарда
- •17.4. Врожденные пороки сердца
- •17.4.1. Врожденные аномалии расположения сердца и магистральных сосудов
- •17.4.1.1. Стеноз легочного ствола (изолированное сужение легочной артерии)
- •17.4.1.2. Врожденный стеноз устья аорты
- •17.4.1.3. Открытый артериальный проток
- •17.4.1.4. Дефект межпредсердной перегородки
- •17.4.1.5. Дефект межжелудочковой перегородки
- •17.4.1.6. Тетрада Фалло
- •17.5. Приобретенные пороки сердца
- •17.5.1. Стеноз левого атриовентрикулярного отверстия (митральный стеноз)
- •17.5.2. Недостаточность левого предсердно-желудочкового клапана (митральная недостаточность)
- •17.5.3. Аортальные пороки сердца
- •17.6. Инфекционный эндокардит и абсцессы сердца
- •17.7. Хроническая ишемическая болезнь сердца
- •17.8. Постинфарктная аневризма сердца
- •17.9. Перикардиты
- •17.9.1. Острые перикардиты
- •17.9.2. Выпотные перикардиты
- •17.9.3. Хронические перикардиты
- •17.10. Нарушения ритма
- •17.10.1. Брадикардии
- •17.10.2. Тахикардии
- •Глава 18. Аорта и периферические артерии
- •18.1. Методы исследования
- •18.2. Общие принципы лечения заболеваний артерий
- •18.3. Врожденные пороки
- •18.4. Патологическая извитость артерий (кинкинг)
- •18.5. Гемангиомы
- •18.6. Травмы артерий
- •18.7. Облитерирующие заболевания
- •18.7.1. Облитерирующий атеросклероз
- •18.7.2. Неспецифический аортоартериит
- •18.7.3. Облитерирующий тромбангиит (болезнь Винивартера—Бюргера)
- •18.7.4. Облитерирующие поражения ветвей дуги аорты
- •18.7.5. Облитерирующие заболевания висцеральных ветвей аорты
- •18.7.6. Заболевания почечных артерий. Вазоренальная гипертензия
- •18.7.7. Облитерирующие заболевания артерий нижних конечностей
- •18.8. Аневризмы аорты и периферических артерий
- •18.8.1. Аневризмы аорты
- •18.8.2. Аневризмы периферических артерий
- •18.8.3. Артериовенозная аневризма
- •18.9. Тромбозы и эмболии
- •18.9.1. Эмболия и тромбоз мезентериальных сосудов
- •18.10. Заболевания мелких артерий и капилляров
- •18.10.1. Диабетическая ангиопатия
- •18.10.2. Болезнь Рейно
- •18.10.3. Геморрагический васкулит (болезнь Шенлейна—Геноха)
- •Глава 19. Вены конечностей
- •19.1. Методы исследования
- •19.2. Врожденные венозные дисплазии
- •19.3. Повреждения магистральных вен конечностей
- •19.4. Хроническая венозная недостаточность
- •19.4.1. Варикозное расширение вен нижних конечностей
- •19.4.2. Посттромбофлебитический синдром
- •19.4.3. Трофические язвы венозной этиологии
- •19.5. Острый тромбофлебит поверхностных вен
- •19.6. Острые тромбозы глубоких вен нижних конечностей
- •19.7. Окклюзии ветвей верхней полой вены
- •19.8. Эмболия легочной артерии
- •Глава 20 лимфатические сосуды конечностей
- •20.1. Заболевания лимфатических сосудов
- •20.1.1. Лимфедема
- •20.1.2. Лимфангиомы
- •Глава 21. Тонкая кишка
- •21.1. Аномалии и пороки развития
- •21.2. Травмы тонкой кишки
- •21.3. Заболевания тонкой кишки
- •21.3.1. Дивертикулы тонкой кишки
- •21.3.2. Ишемия кишечника
- •21.3.3. Болезнь Крона
- •21.4. Опухоли тонкой кишки
- •21.5. Кишечные свищи
- •21.6. Синдром "короткой кишки"
- •Глава 22. Червеобразный отросток
- •22.1. Острый аппендицит
- •22.1.1. Типичные формы острого аппендицита
- •22.1.2. Атипичные формы острого аппендицита
- •22.1.3. Острый аппендицит у беременных
- •22.1.4. Острый аппендицит у вич-инфицированных
- •22.1.5. Осложнения острого аппендицита
- •22.1.6. Дифференциальная диагностика
- •2. Острые заболевания, не требующие, как правило, экстренной операции.
- •3. Нехирургические заболевания, протекающие под маской "острого живота".
- •22.2. Хронический аппендицит
- •22.3. Опухоли червеобразного отростка
- •Глава 23. Ободочная кишка
- •23.1. Аномалии и пороки развития
- •23.1.1. Болезнь Гиршпрунга (аганглионарный мегаколон)
- •23.1.2. Идиопатический мегаколон
- •23.2. Воспалительные заболевания ободочной кишки
- •23.2.1. Неспецифический язвенный колит
- •23.3. Дивертикулы и дивертикулез
- •23.4. Доброкачественные опухоли
- •23.4.1. Полипы и пол и поз
- •23.5. Злокачественные опухоли
- •23.5.1. Рак ободочной кишки
- •Глава 24 прямая кишка
- •24.1. Методы исследования
- •24.2. Врожденные аномалии
- •24.3. Травмы прямой кишки
- •24.4. Заболевания прямой кишки
- •24.4.1. Геморрой
- •24.4.2. Трещина заднего прохода
- •24.4.3. Парапроктит и свищи прямой кишки
- •24.4.4. Выпадение прямой кишки
- •24.5. Рак прямой кишки
- •Глава 25 непроходимость кишечника
- •25.1. Острая непроходимость
- •25.1.1. Обтурационная непроходимость
- •25.1.2. Странгуляционная непроходимость
- •25.1.3. Динамическая непроходимость
- •Глава 26. Брюшина и забрюшинное пространство
- •26.1. Брюшина
- •26.1.1. Перитонит
- •26.1.1.1. Абсцессы (отграниченный перитонит) брюшной полости и малого таза
- •26.1.1.2. Туберкулезный перитонит
- •26.1.1.3. Генитальный перитонит
- •26.1.2. Опухоли брюшины
- •26.2. Забрюшинное пространство
- •26.2.1. Повреждение тканей забрюшинного пространства
- •26.2.2. Гнойные заболевания тканей забрюшинного пространства
- •26.2.3. Опухоли забрюшинного пространства
- •26.2.4. Фиброз забрюшинной клетчатки
- •Глава 27 надпочечники
- •27.1. Гормонально-активные опухоли надпочечников
- •27.1.1. Альдостерома
- •27.1.2. Кортикостерома
- •27.1.3. Андростерома
- •27.1.4. Кортикоэстрома
- •27.1.5. Феохромоцитома
- •27.2. Гормонально-неактивные опухоли
- •Глава 28 трансплантация органов и тканей
- •28.1. Источники донорских органов
- •28.2. Иммунологические основы пересадки органов
- •28.3. Реакция отторжения пересаженного органа
- •28.4. Иммунодепрессия
- •28.5. Трансплантация почек
- •28.6. Трансплантация поджелудочной железы
- •28.7. Трансплантация сердца
- •28.8. Пересадка сердце—легкие
- •28.9. Трансплантация печени
- •28.10. Трансплантация легких
- •28.11. Трансплантация тонкой кишки
- •28.12. Врачебный долг и трансплантология
- •Глава 29. Ожирение
2.1.2. Торакоскопическая хирургия
В настоящее время этот вид вмешательства находится в стадии становления. Наибольшее распространение получила диагностическая торакоскопия с прицельной биопсией для морфологической верификации диагноза при том или ином заболевании органов грудной полости или средостения, например при субплевральных новообразованиях легких, мезотелиоме плевры, поражении медиастинальных лимфатических узлов и т. п. Следующие оперативные торакоскопические вмешательства применяются наиболее часто.
Атипическая резекция легкого при доброкачественных новообразованиях. Удаление сегмента легочной ткани производят с помощью миниатюрных сшивающих аппаратов, обеспечивающих надежный гемо- и аэростаз. Удаленный препарат извлекают через мини-торакотомный разрез длиной около 2—4 см.
Лобэктомию выполняют как при периферическом раке легкого, так и при доброкачественных заболеваниях. Обработка сосудов корня доли и бронха производится с помощью сшивающих аппаратов. Лимфатические узлы удаляют, как при "открытой" методике.
Операции на небольших опухолях средостения производят при новообразованиях заднего средостения (невриномы, энтерогенные кисты).
Ткань легкого при спонтанном пневмотораксе ушивают с помощью эндо-корпоральных швов, используя миниатюрный иглодержатель и мягкие зажимы, либо с помощью сшивающего аппарата.
Резекция пищевода, обычно производимая при раке нижнегрудного отдела пищевода (при данной локализации отсутствует связь опухоли с трахеей и главными бронхами), заключается в мобилизации грудного отдела пищевода и внутригрудных лимфатических узлов с пересечением непарной вены с помощью сшивающих аппаратов. Пищевод пересекают в его верхнем отделе (также с помощью сшивающего аппарата) и извлекают через лапаротомный доступ. В последующем производят эзофагопластику "трубкой", выкроенной из большой кривизны желудка, формируют эзофагогастроанастомоз на шее.
В отличие от лапароскопической методики при выполнении торакоскопических операций газ в плевральную полость не нагнетают. Для обеспечения адекватного обзора и манипуляций на органах грудной клетки достаточно отключения легкого на стороне проводимого вмешательства. С этой целью интубируют трахею двухпросветной трубкой и подают газовую смесь в контралатеральное легкое.
Преимущества торакоскопической хирургии те же, что и при лапароскопической методике. Недостатки обусловлены в основном неправильной техникой введения троакаров в плевральную полость (повреждение легкого и крупных сосудов).
2.2. Интервенционная радиология
Данное направление малоинвазивной хирургии развивается в основном по двум направлениям — эндоваскулярная хирургия и чрескожное введение различных инструментов (дренажей, катетеров, эндопротезов, баллонных дилататоров и т. п.) в просвет полых, паренхиматозных органов брюшной полости или их выводных протоков (чаще всего желчевыводящих путей печени).
Оперативные вмешательства, выполняемые с помощью интервенционной радиологии, можно разделить на следующие группы:
восстановление просвета суженных трубчатых структур (артерий, желчевыводящих путей, различных отделов желудочно-кишечного тракта);
дренирование полостных образований во внутренних органах;
окклюзия просвета сосудов.
Эндоваскулярная хирургия как отрасль современной хирургии начала развиваться в 60-х годах XX столетия. Первая операция чрескожного бужирования ограниченного атеросклеротического стеноза подколенной артерии под контролем ангиографии впервые была выполнена С.Dotter и М.Judkins в 1964 г. Расширение пораженной артерии производили с помощью коаксиальных тефлоновых катетеров. Однако наибольшее распространение операция получила после изобретения A.Gruntzig в 1974 г. двухпросветного баллонного катетера, позволяющего под контролем ангиографического исследования и манометрии проводить прецизионное расширение суженных участков пораженных артерий.
Суть метода баллонной дилатации (транслюминальной ангиопластики, баллонной ангиопластики) стенозов артериальных сосудов заключается в следующем. Вначале с помощью ангиографического исследования пораженного отдела сосудистого русла оценивают возможность и целесообразность применения баллонной ангиопластики. Обычно операцию выполняют при ограниченном сужении артерии, протяженностью 1—3 см, и хорошей проходимости артерий дистальнее места стеноза. Затем в зону стеноза вводят двухпросветный баллон-катетер (рис. 2.1) в спавшемся состоянии (наружный его диаметр равен 1,5—2,3 мм). После этого с помощью специальных шприцев под контролем манометрии нагнетают в просвет баллона жидкость под давлением 10—15 атм. При этом происходит равномерное давление на стенки суженного сосуда по всей его окружности. У большинства больных удается добиться значительного расширения и даже полного восстановления нормального просвета пораженной артерии. При рестенозе в отдаленные сроки после операции возможно повторное применение баллонной ангиопластики. Преимуществами данной малоинвазивной операции являются атравматичность, редкие послеоперационные осложнения, отсутствие целого ряда местных и общих осложнений, свойственных "открытым" вмешательствам, непродолжительное время пребывания больного в стационаре.
Рис. 2.1. Баллонный катетер. а — спавшийся; б — раздутый.
 В
В
 настоящее время для улучшения отдаленных
результатов баллонной ангиопластики,
особенно у больных с протяженными
стриктурами, данную процедуру дополняют
эндопротезированием (стентированием)
пораженного отдела сосудистого
русла. Металлический стент (рис. 2.2) в
спавшемся состоянии с помощью
металлического проводника через
прокол в верхней части бедренной артерии
под контролем ангиографии вводят в
пораженный участок сосуда. Затем
металлический ажурный стент раскрывают
в просвете артерии, тем самым расширяя
ее просвет до необходимого диаметра.
Существуют два вида стентов:
саморасширяющиеся после удаления
металлического проводника и стенты,
расправляемые в просвете сосуда с
помощью эндоваскулярного баллона (рис.
2.3). Наиболее часто баллонную ангио
пластику в сочетании с эндопротезированием
или без него применяют для лечения
нижеперечисленных заболеваний.
настоящее время для улучшения отдаленных
результатов баллонной ангиопластики,
особенно у больных с протяженными
стриктурами, данную процедуру дополняют
эндопротезированием (стентированием)
пораженного отдела сосудистого
русла. Металлический стент (рис. 2.2) в
спавшемся состоянии с помощью
металлического проводника через
прокол в верхней части бедренной артерии
под контролем ангиографии вводят в
пораженный участок сосуда. Затем
металлический ажурный стент раскрывают
в просвете артерии, тем самым расширяя
ее просвет до необходимого диаметра.
Существуют два вида стентов:
саморасширяющиеся после удаления
металлического проводника и стенты,
расправляемые в просвете сосуда с
помощью эндоваскулярного баллона (рис.
2.3). Наиболее часто баллонную ангио
пластику в сочетании с эндопротезированием
или без него применяют для лечения
нижеперечисленных заболеваний.
Ишемическая болезнь сердца. У многих больных ангиопластика является альтернативой операции аортокоронарного шунтирования. Возможно применение дилатации и стентирования одновременно нескольких коронарных артерий. При остром инфаркте миокарда методика превосходит по своей эффективности результаты тромболитической терапии. Выполненные по строгим показаниям баллонная дилатация и стентирование коронарных артерий позволяют избежать серьезных осложнений, связанных с широкой торакотомией или стернотомией, использованием аппарата искусственного кровообращения. При этом существенно сокращается длительность пребывания больного в стационаре и время физической и социальной реабилитации.
Митральный порок сердца. Малоинвазивное вмешательство применяют при невыраженном клапанном и подклапанном кальцинозе, отсутствии критического стеноза митрального клапана и признаков его сочетанной недостаточности. Баллонную дилатацию суженного митрального клапана осуществляют под контролем рентгенотелевидения и ангиографического исследования. Преимущества перед открытой операцией те же, что и при лечении ишемической болезни сердца. При тщательном отборе больных указанный способ не уступает по своей эффективности операции комиссуротомии.

Атеросклеротический стеноз подвздошных артерий (рис. 2.4). Малоинвазивное вмешательство выполняют как при одностороннем, так и при двустороннем поражении общей или наружной подвздошной артерии. Лучшие результаты отмечаются при одностороннем поражении и отсутствии признаков стенозирования дистальнее места сужения. В этих случаях хорошая проходимость подвздошных артерий выявляется у 80—90% больных при 5-летнем сроке наблюдения.
Атеросклеротический стеноз артерий бедренно-подколенного сегмента. Показанием к эндоваскулярной дилатации и стентирования сосудов является непротяженный стеноз артерии при сохраненной проходимости выше- и нижележащих отделов сосудистого русла. Однако в связи с тем, что данная ситуация наблюдается нечасто, использование малоинвазивной методики в известной мере ограничено. Тем не менее отдаленные результаты операции, выполненной по строгим показаниям, весьма благоприятны: при 5-летнем сроке наблюдения у 60—70% больных отмечается хорошая проходимость сосудов в зоне операции.
Вазоренальная гипертензия (рис. 2.5). Как известно, наиболее частыми причинами развития вазоренальной гипертензии являются атеросклероти-ческий стеноз или окклюзия почечных артерий, а также их фибромускуляр-ная дисплазия. И в том, и в другом случае баллонная дилатация может быть весьма эффективна. Во всех случаях ангиопластику целесообразно дополнять стентированием. Наиболее благоприятные отдаленные результаты наблюдаются у больных с фибромускулярной дисплазией. Сравнить результаты малоинвазивной методики с исходами традиционной операции довольно сложно (по литературным данным сведения весьма разноречивые), так как четкие показания к ее использованию окончательно не сформулированы и зачастую операционный риск очень высок.


Аневризмы инфраренального отдела брюшной аорты. Традиционным способом лечения этого заболевания является операция резекции аневризмы с последующим аортобедренным протезированием. Первая операция стентирования аневризмы брюшной аорты была выполнена в 1991 г. (J. С. Parodi и соавт.). В отличие от техники ма-лоинвазивных эндоваскулярных вмешательств техника эндопротезирования аорты значительно сложнее, требует надежной фиксации проксимального и дистального концов эндопротеза к стенкам аорты и подвздошной артерии (рис. 2.6). При недостаточно надежной его фиксации к стенкам сосудов сохраняется кровоток в полости аневризмы, что в последующем может привести к смещению стента, а в некоторых случаях и к разрыву стенок самой аневризмы.
Рис. 2.6. Эндопротезирование аневризмы аорты с помощью специального саморасширяющегося эндопротеза с шипами, соединяющими эндопротез со стенкой неизмененного участка аорты.
Основным преимуществом малоинвазивной методики являются ее малая травматичность и редко наблюдающиеся осложнения в раннем послеоперационном периоде. Кроме того, в отличие от "открытой" операции, выполняемой через широкий лапаротомный доступ, значительно меньше нарушается функция легких, сердца, почек, кишечника.
Относительно небольшое число наблюдений за больными, перенесшими малоинвазивное вмешательство в отдаленные сроки после операции, пока еще не позволяет окончательно определить место эндопротезирования аорты в лечении ее аневризматических поражений. Однако по мнению ряда исследователей, имеющих опыт 80—100 подобных операций и более, у тщательно отобранных пациентов данная процедура является весьма надежным и эффективным способом лечения аневризм с указанной локализацией.
Имеются также отдельные сообщения об использовании баллонной ангиопластики при атеросклеротическом стенозе чревного ствола, верхней брыжеечной артерии, подключичных артерий.
К осложнениям баллонной ангиопластики относятся разрывы интимы и мышечной оболочки сосудов, эмболия фрагментами атеросклеротических бляшек дистальных отделов сосудистого русла, тромбоз и рестеноз артерий в зоне операции, смещение стента. Следует также отметить, что малоинвазивные вмешательства на артериях при их атеросклеротическом поражении, так же как и традиционные "открытые" операции, по своей сути являются паллиативными. Это обусловлено дальнейшим прогрессированием атеросклероза и поражением других отделов сосудистого русла. При экстравазальной компрессии чревного ствола (срединной дугообразной связкой диафрагмы) и фибромускулярной дисплазии почечных артерий операция баллонной ангиопластики в сочетании со стентированием участка сосуда приводит к выздоровлению.
Следует упомянуть о других эндоваскулярных малоинвазивных вмешательствах на артериях.

Окклюзия боталлова (артериального) протока при его незаращении с помощью малоинвазивной методики является высокоэффективным и малотравматичным вмешательством, позволяющим избежать ряда осложнений, связанных с широкой стернотомией.
Селективная окклюзия ветвей собственной печеночной артерии используется для лечения метастатического поражения печени при невозможности радикального хирургического удаления метастазов печени или при общем тяжелом состоянии больного, обусловленном заболеваниями. Известно, что кровоснабжение метастатических узлов в печени осуществляется преимущественно артериями, поэтому блокада артериального кровотока вызывает частичный некроз опухолевого узла и замедление прогрессирования ракового процесса в печени. При выполнении операции (доступ — через бедренную артерию) необходимо стремиться установить катетер в долевую или сегментарную ветвь печеночной артерии во избежание ишемии и некроза здоровой паренхимы печени и желчного пузыря.
Химиоэмболизация сосудов печени сочетает в себе регионарную химиотерапию и блокаду притока артериальной крови к опухолевому узлу (рис. 2.8) В качестве блокирующего агента применяют как вышеуказанные компози ты, так и рентгеноконтрастный йодсодержащий препарат липиодол, преимуществом которого является хорошая фиксация его в ткани опухоли, в то время как из здоровых участков паренхимы печени он достаточно быстро удаляется с током крови. Для регионарной химиотерапии наиболее часто используют доксорубицин и митомицин. Учитывая местную фиксацию хи-миопрепарата в опухолевой ткани, можно применять значительно более высокие дозы, чем при системной химиотерапии. Продолжительность жизни пациентов после этого способа лечения в 4—6 раз больше, чем после стандартной общей химиотерапии, особенно у больных с гормонально-активными метастазами в печень (карциноид желудочно-кишечного тракта, нейроэндокринные опухоли островкового аппарата поджелудочной железы). В этих случаях показатель 5-летней переживаемости достигает 25% и более.

Химиоэмболизацию печеночных артерий используют также и при первичном гепатоцеллюлярном раке, когда из-за местного распространения процесса радикальная операция невозможна или чрезвычайно высок операционный риск. При небольших (менее 5 см) солитарных опухолях или изолированном поражении одной доли печени (не более 3 метастатических узлов) показатель 3-летней переживаемости достигает 40—50%, при двустороннем массивном поражении печени химиоэмболизация противопоказана.
Тромбэктомия периферических артерий чаще выполняется при свежем тромбозе или эмболии либо после перенесенных реконструктивных операций на артериях ног (аортобедренное или бедренно-подколенное шунтирование). Подобная малоинвазивная техника позволяет избежать повторной, подчас довольно сложной хирургической операции. Тромбэктомию производят с помощью специального устройства "Ангиоджет". При этом его рабочая часть, введенная в просвет сосуда, в результате создаваемого гидродинамического воздействия позволяет добиться полного разрушения тромба и удаления его мелких фрагментов.
Значительно реже используются малоинвазивные вмешательства на венозных сосудах: это имплантация кава-фильтра, транспеченочное портокавальное шунтирование.
Имплантация кава-фильтра осуществляется для профилактики тромбэктомии легочной артерии при флеботромбозе ног. Наиболее часто используют кава-фильтр Гринфилда, представляющий собой веретенообразную ажурную металлическую корзинку с радиально расположенными фиксаторами на ее проксимальном конце (рис. 2.9). Операцию выполняют из трансъюгулярного доступа. В сложенном виде с помощью металлического проводника кава-фильтр под контролем рентгеновского экрана проводят в нижнюю полую вену ниже уровня впадения почечных вен. После раскрытия корзинки острые металлические фиксаторы внедряются в стенку вены, предотвращая ее смещение. Показанием к использованию кава-фильтра являются рецидивирующие тромбоэмболии ветвей легочной артерии и флотирующие свежие тромбы в просвете крупных тазовых и бедренных вен.

Транспеченочное портокавальное шунтирование для лечения внутри- и надпеченочной формы синдрома портальной гипертензии применяется недавно. Первая подобная операция была выполнена G. M. Richter и соавт. в 1990 г. Показанием к выполнению данной операции являются кровотечение из варикозно расширенных вен пищевода (при безуспешности других способов лечения), стойкий асцит, высокая степень риска операции портоси-стемного шунтирования. Нередко данное вмешательство используют у больных перед операцией трансплантации печени для декомпрессии расширенных абдоминальных вен. Исходы малоинвазивной операции примерно такие же, как и при традиционной операции портосистемного шунтирования. Однако у больных с плохими функциональными и лабораторными показателями деятельности внутренних органов она имеет несомненные преимущества перед "открытой" операцией. Операция проводится следующим образом: пунктируют правую внутреннюю яремную вену; затем проводник с пластмассовым катетером продвигают в дистальном направлении и под контролем рентгенографии и УЗИ транспеченочно формируют канал между правой печеночной веной и правой ветвью (или ветвями первого порядка) воротной вены. Далее после контрольной ангиографии с помощью специальных коаксиальных бужей расширяют канал внутри ткани печени до диаметра 8 мм. Операцию завершают проведением стента в сформированный канал (рис. 2.10).
В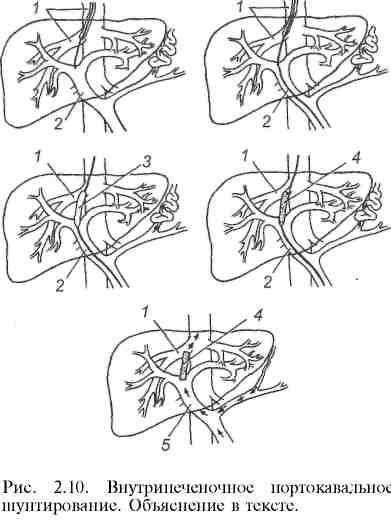 несосудистая
малоинвазив-ная хирургия начала свое
развитие несколько позднее
эндова-скулярной хирургии. Тем не менее
за последние годы именно этот раздел
интервенционной радиологии получил
чрезвычайно широкое внедрение в различные
отрасли абдоминальной хирургии.
Особенно ценным является использование
малоинвазивных технологий в лечении
различных заболеваний печени и
желчевы-водящих путей, поджелудочной
железы.
несосудистая
малоинвазив-ная хирургия начала свое
развитие несколько позднее
эндова-скулярной хирургии. Тем не менее
за последние годы именно этот раздел
интервенционной радиологии получил
чрезвычайно широкое внедрение в различные
отрасли абдоминальной хирургии.
Особенно ценным является использование
малоинвазивных технологий в лечении
различных заболеваний печени и
желчевы-водящих путей, поджелудочной
железы.
Малоинвазивная хирургия печени и желчевыводящих путей.
Практически все оперативные вмешательства у данной группы пациентов выполняют в специальной операционной с рентгеновским оборудованием. Абсцессы печени. Длительное время единственным способом лечения бактериальных абсцессов печени являлась операция лапаротомии и дренирования гнойных полостей. В последние годы дренирование абсцессов производят с помощью пункции и дренирования их под контролем ультразвукового исследования или компьютерной томографии с последующим отмыванием содержимого гнойника растворами антисептиков. Одновременно назначают антибиотикотерапию с учетом чувствительности микробной флоры содержимого абсцесса к антибиотикам. При множественных абсцессах (чаще всего холангиогенных) пунктируют и дренируют наиболее крупные из них. Подобная тактика позволяет более чем в 2 раза снизить послеоперационную деятельность и количество осложнений.
Непаразитарные (простые) кисты печени. В настоящее время операцией выбора в лечении больных с простыми кистами печени являются их пункция и дренирование под контролем ультразвукового исследования или компьютерной томографии с последующей склеротерапией, целью которой является индукция асептического некроза эпителиальной выстилки кисты для постепенной облитерации ее полости на фоне чрескожного дренирования. В качестве склерозантов используют абсолютный спирт или концентрированный раствор глицерина. При небольших кистах (диаметром не более 3— 4 см), как правило, бывает достаточно однократной пункции и экспозиции склерозирующего раствора в течение 10 мин. При кистах большего диаметра необходимо наружное дренирование. Подобная методика применима даже при гигантских кистах печени (диаметром 15—20 см и более), что позволяет избежать достаточно сложных в техническом отношении "открытых" оперативных вмешательств.
Эхинококкоз печени. Как известно, общепринятым способом лечения эхинококкоза печени является традиционный хирургический. В последние годы в нашей стране и в ряде клиник Северной Америки и Европы используется малоинвазивная техника. Суть ее заключается в следующем. Вначале под контролем УЗИ или КТ производят тонкоигольную пункцию кисты, ас-пирируют ее содержимое и отправляют на срочное микроскопическое исследование, при котором выявляют живые протосколексы паразита. Затем в полость кисты вводят противопаразитарный препарат (20—30% раствор натрия хлорида или концентрированный раствор глицерина). После 10— 15-минутной экспозиции раствор аспирируют и вновь подвергают микроскопическому исследованию. Обнаружение в растворе погибших протоско-лексов свидетельствует об адекватном противопаразитарном воздействии препарата. Операцию завершают наружным дренированием полости кисты. Через несколько дней по металлическому проводнику в полость кисты последовательно вводят дренажи большего диаметра для полноценной аспирации фрагментированной хитиновой оболочки через холедоскоп, введенный через дренажную трубку. Если же часть фиброзной капсулы паразита выступает на поверхности печени, удаление хитиновой оболочки можно произвести с помощью видеоэндоскопии. Для профилактики рецидива эхи-нококкоза в послеоперационном периоде проводят курс противопаразитар-ной терапии альбендозолом.
Методика показана при выявлении живых эхинококковых кист, при рецидивном эхинококкозе, когда после ранее перенесенных операций в брюшной полости развивается спаечный процесс, существенно затрудняющий проведение повторного "открытого" хирургического вмешательства. При погибшем эхинококке, содержащем густой вязкий детрит, а также при кальцинозе его стенок малоинвазивная техника операции противопоказана. При правильной технике малоинвазивной эхинококкэктомии, выполненной по строгим показаниям, летальных исходов не наблюдается, частота послеоперационных осложнений также минимальна, кроме того, значительно сокращается время пребывания больного в стационаре.
Первичный и вторичный рак печени. Для лечения больных с первичным ге-патоцеллюлярным раком или метастатическим поражением печени, когда по тем или иным причинам радикальная операция невозможна, применяют чрескожную алкоголизацию опухолевых узлов. С этой целью под контролем УЗИ в периферические отделы опухоли вводят абсолютный спирт (3— 5 мл) — ткань опухоли вместе с питающими ее сосудами некротизируется. В последующем некроз распространяется и на центральные зоны новообразования, происходят частичный регресс массы опухоли и замедление ее роста. Показанием к склерозирующей терапии являются опухолевый узел диаметром не более 3 — 4 см или множественные узлы (не более 3) диаметром 3 см. Нередко ее сочетают с химиоэмболизацией ветвей печеночной артерии, что увеличивает продолжительность жизни пациентов.
Острый холецистит. Широкое распространение получила операция хо-лецистостомии под контролем УЗИ у лиц пожилого и старческого возраста. Она позволяет быстро купировать воспалительный процесс и подготовить пациента для плановой операции в более выгодных условиях. Во избежание желчеистечения пункцию и дренирование желчного пузыря производят через ткань печени, прилежащую к его дну.

Рубцовая стриктура гепатикохоледоха или билиодигестивного соустья. В этих ситуациях можно использовать как традиционное лечение (реконструктивная операция), так и малоинвазивную методику дилатации желчного протока (билиодигестивное соустье). Реконструктивные операции достаточно сложны в техническом отношении, сопровождаются довольно часто осложнениями в послеоперационном периоде. Вот почему в настоящее время при соответствующих условиях (расширение внутрипеченочных желчных протоков на фоне механической желтухи) все чаще используют малоинвазивные операции. Технически они относительно несложны. После пункции внут-рипеченочного протока под контролем УЗИ и холангиографии выполняют баллонную дилатацию суженного участка внепеченочного желчного протока (или билиодигестивного соустья). Эффективность процедуры контролируют с помощью рентгеноскопии и затем дренируют желчные пути наружно-внутренним дренажом. Через несколько месяцев после формирования достаточно широкого канала дренаж удаляют.
Кроме того, наружно-внутреннее дренирование желчных путей применяют при лечении целого ряда заболеваний, сопровождающихся механической желтухой (рак внепеченочных желчных протоков, головки поджелудочной железы, большого дуоденального сосочка).
Малоинвазивная хирургия заболеваний поджелудочной железы
Острый деструктивный панкреатит. Наиболее частым малоинвазивным вмешательством при этом заболевании является пункция ограниченных скоплений жидкости в сальниковой сумке или парапанкреатической клетчатке под контролем УЗИ. При пункции используют специальные сверхтонкие иглы (иглы Chiba), наружный диаметр которых менее 1 мм, поэтому их возможно провести через желудок или левую долю печени без риска получить какое-либо осложнение. На основании бактериологического исследования устанавливают, является ли эта жидкость стерильной или инфицированной, определяют вид флоры и ее чувствительность к антибиотикам. Стерильные скопления жидкости у подавляющего большинства больных при проведении адекватного лечения основного заболевания рассасываются. При выявлении бактериальной обсемененности (т. е. по сути дела абсцедировании) необходимо дренировать (чрескожно) полость под контролем УЗИ с последующим фракционным или проточным введением через дренаж раствора антисептиков. У больных с множественными абсцессами сальниковой сумки, массивным расплавлением парапанкреатической клетчатки предпочтение следует отдать традиционному оперативному лечению, хотя имеются сообщения и об успешном лечении данной категории пациентов с помощью наружного дренирования под контролем УЗИ или КТ.
Прицельная пункция очага панкреонекроза под ультразвуковым контролем обычно выполняется с целью получения материала для микробиологического исследования. При инфицированном некрозе показано оперативное лечение. Если же материал оказывается стерильным, то необходимости в срочном хирургическом вмешательстве нет.
Постнекротические кисты поджелудочной железы. Сформированные (зрелые) кисты с хорошо выраженными стенками наиболее часто лечат оперативным путем, однако есть сообщения об их успешном лечении с помощью чрескожной пункции с последующей склерозирующей терапией. В ранние сроки формирования кисты (несколько недель от начала приступа острого панкреатита) традиционную "открытую" операцию цистоэнтеростомии выполнить технически невозможно, так как на этой стадии развития стенки очень тонкие и, кроме того, у большинства больных они подвергаются обратному развитию. При крупных кистах, особенно при подозрении на их инфицирование, целесообразно пункционное наружное дренирование под контролем УЗИ. После пункции необходимо ввести в полость кисты рентгеноконтрастное вещество и произвести цистографию для выявления связи полости кисты с выводными протоками поджелудочной железы. Если кисты сообщаются с протоками железы, склерозирующая терапия противопоказана.
При несформированных экстрапанкреатических кистах, расположенных позади желудка, применяют малоинвазивную операцию — цистогастростомию. Для этого под контролем УЗИ и гастроскопии чрескожно, через переднюю и заднюю стенки желудка в просвет кисты вводят тонкий дренаж диаметром около 1,5 мм с множественными боковыми отверстиями, один конец которого располагается в полости самой кисты, другой — в просвете желудка. При этом жидкость из полости кисты начинает поступать в просвет желудка, что хорошо видно при гастроскопии. Операцию обычно сочетают с наружным пункционным дренированием кисты для отмывания некротических тканей поджелудочной железы и забрюшинной клетчатки. Ма-лоинвазивная техника позволяет избежать достаточно сложных, травматических "открытых" операций, сопровождающихся тяжелыми осложнениями в послеоперационном периоде.
Рак поджелудочной железы. На основании УЗИ и КТ порой бывает довольно сложно отличить злокачественную опухоль поджелудочной железы от доброкачественной, хронического псевдотуморозного панкреатита или последствий ранее перенесенного острого деструктивного панкреатита.
Прицельная пункция патологического очага поджелудочной железы под контролем УЗИ или КТ, производимая с дифференциально-диагностической целью, довольно широко применяется. При этом у 90% больных раком поджелудочной железы удается получить морфологическую верификацию диагноза.
Паллиативной операцией при неоперабельном раке головки поджелудочной железы, осложненном механической желтухой, является наружно-внутреннее дренирование желчных путей под контролем УЗИ или КТ. При этом средняя продолжительность жизни пациентов даже несколько выше, чем после традиционных "открытых" желчеотводящих операций, существенно ниже и частота развития послеоперационных осложнений. Данную процедуру используют и для подготовки больных раком поджелудочной железы к радикальной операции для ликвидации механической желтухи и уменьшения интоксикации.
Абсцессы брюшной полости. Многие десятилетия единственным способом их лечения были лапаротомия и дренирование брюшной полости. В настоящее время в данных ситуациях широкое распространение получила малоин-вазивная операция наружного дренирования абсцессов под контролем УЗИ и КТ. Она может быть использована при гнойниках брюшной полости, осложняющих течение какого-либо острого заболевания (аппендицит, холецистит, панкреатит, дивертикулит и т. д.) или возникающих после различных оперативных вмешательств на органах брюшной полости.
