
ГОС / 60
.doc60. Опыты Резерфорда. Планетарная модель атома. Ядро. Составные элементы ядра, изотопы и изобары. Заряд ядра. Масса, энергия связи и дефект массы. Форма и размер ядра.
1. Опыты Резерфорда по рассеянию α – частиц (дать схему установки).
В 1911г. Резерфорд с сотрудниками придумал эксперимент по рассеянию α-частиц тонкими фольгами. Источник излучения и фольга помещались в камеру, из которой выкачен воздух. α-излучение подало на фольгу и экран, покрытый сернистым цинком. Источник и фольга могли поворачиваться, что позволяло изучать рассеяние α-частиц фольгой под разными углами. Фольга была такой тонкой, что не задерживала α-частицы.
Итоги эксперимента:
Оказалось, что
большинство α-частиц проходят фольгу.
При угле примерно равном
![]() также зафиксировано рассеяние(часть
α-частиц, рассеянных под углом
также зафиксировано рассеяние(часть
α-частиц, рассеянных под углом
![]() возвращаются назад). Из эксперимента
Резерфорд предположил, что небольшое
число α-частиц рассеянных под углом
примерно
возвращаются назад). Из эксперимента
Резерфорд предположил, что небольшое
число α-частиц рассеянных под углом
примерно
![]() обусловлено взаимодействием их с большим
положительным зарядом сконцентрированном
в очень малом объеме.
обусловлено взаимодействием их с большим
положительным зарядом сконцентрированном
в очень малом объеме.
Используя методы
статистической физики, Резерфорд получил
формулу, из которой следует зависимость
числа рассеянных частиц в телесном угле
![]() .
Оказалось, что количество частиц в угле
.
Оказалось, что количество частиц в угле
![]()
![]() .
.
Угол рассеяния зависит от Z-порядкового номера, от начальной кинетической энергии, от прицельного параметра Р .
![]() θ~z,
θ~z,![]() ,
р.
,
р.
Формула Резерфорда
показывает вероятность рассеяния в
зависимости от этих параметров
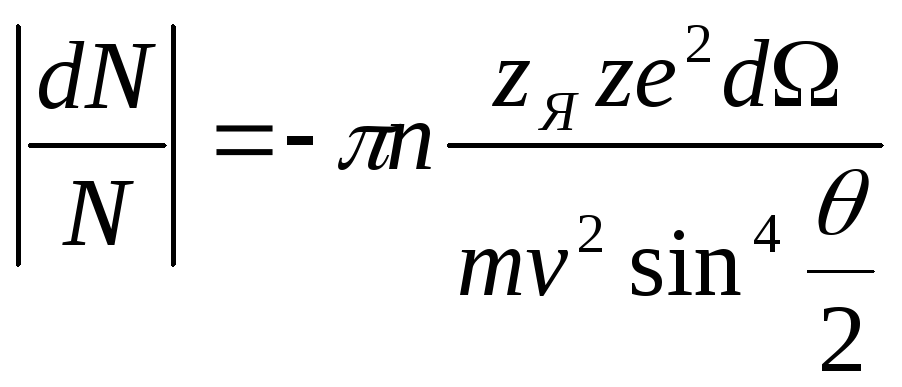 ,
где
n
– число
рассеивающих центров фольги, приходящихся
на единицу площади.
,
где
n
– число
рассеивающих центров фольги, приходящихся
на единицу площади.
1)
![]() ,
где r
– минимальное
расстояние на которое приблизится
α-частица к ядру
,
где r
– минимальное
расстояние на которое приблизится
α-частица к ядру
![]() .
.
Ядро в целом мало влияния оказывает на электроны.
Выводы:
1. вещества состоят
из положительно заряженных ядер и их
размеры порядка
![]() и электронов, окружающих это ядро,
поэтому фольга практически прозрачна
для α-частиц. Там самым была опровергнута
модель атома Томсона.
и электронов, окружающих это ядро,
поэтому фольга практически прозрачна
для α-частиц. Там самым была опровергнута
модель атома Томсона.
2. Планетарная модель атома. Резерфорд на основании эксперимента создал модель атома, согласно которой атом представляет собой положительно заряженное массивное ядро в центре атома и вокруг ядра находятся электроны.
По Резерфорду,
чтобы система электростатически была
стабильной электроны должны вращаться
вокруг ядра. Однако из классической
электродинамики известно, что электроны
должны излучать электромагнитные волны
и терять энергию. Согласно классической
электродинамике электрон должен был
упасть на ядро и весь атом просуществовал
бы
![]() .
Получилось, что модель атома Резерфорда
противоречит классической физике.
.
Получилось, что модель атома Резерфорда
противоречит классической физике.
3. Состав атомного ядра и его характеристики (заряд, масса).
Атомное ядро состоит из частиц: протона и нейтрона, которые получили название нуклонов («ядерных частиц»).
Протон.
Протон (р) обладает зарядом
![]() и
массой
и
массой
![]() МэВ.
(48.1)
МэВ.
(48.1)
Для сравнения
укажем, что масса электрона
![]() МэВ.
(48.2)
МэВ.
(48.2)
Из сопоставления
(48.1) и (48.2) следует, что
![]() .
.
Протон имеет спин,
равный половине (![]() ),
и собственный магнитный момент
),
и собственный магнитный момент
![]() ,
(48.3) где
,
(48.3) где
![]() Дж/Тл
(48.4)
Дж/Тл
(48.4)
— единица магнитного
момента, называемая ядерным магнетоном.
Из сравнения с
![]() вытекает, что
вытекает, что
![]() в 1836 раз меньше магнетона Бора
в 1836 раз меньше магнетона Бора![]() .
Следовательно, собственный магнитный
момент протона примерно в 660 раз меньше,
чем магнитный момент электрона.
.
Следовательно, собственный магнитный
момент протона примерно в 660 раз меньше,
чем магнитный момент электрона.
Нейтрон.
Электрический заряд нейтрона равен
нулю, а масса![]() =
939,57 МэВ (48.5)
=
939,57 МэВ (48.5)
очень близка к
массе протона. Разность масс нейтрона
и протона
![]() составляет
1,3 МэВ, т. е. 2,5
составляет
1,3 МэВ, т. е. 2,5![]() .
Нейтрон обладает спином, равным половине
(
.
Нейтрон обладает спином, равным половине
(![]() ),
и (несмотря на отсутствие электрического
заряда) собственным магнитным моментом
),
и (несмотря на отсутствие электрического
заряда) собственным магнитным моментом
![]() (48.6) (знак минус
указывает на то, что направления
собственных механического и магнитного
моментов противоположны).
(48.6) (знак минус
указывает на то, что направления
собственных механического и магнитного
моментов противоположны).
Отметим, что
отношение экспериментальных значений
![]() и
и
![]() с
большой степенью точности равно – 3/2.
Это было замечено лишь после того, как
такое значение было получено теоретически.
с
большой степенью точности равно – 3/2.
Это было замечено лишь после того, как
такое значение было получено теоретически.
В свободном
состоянии нейтрон нестабилен (радиоактивен)
— он самопроизвольно распадается,
превращаясь в протон и испуская электрон
(![]() )
и еще одну частицу, называемую антинейтрино
(
)
и еще одну частицу, называемую антинейтрино
(![]() ).
Период полураспада (т. е. время, за которое
распадается половина первоначального
количества нейтронов) равен примерно
12 мин. Схему распада можно написать
следующим образом:
).
Период полураспада (т. е. время, за которое
распадается половина первоначального
количества нейтронов) равен примерно
12 мин. Схему распада можно написать
следующим образом:
![]() .
(48.7)
.
(48.7)
Вопрос о массе
нейтрино (и антинейтрино) остается
открытым: пока с достоверностью не
установлено, отлична она от нуля или
нет. Во всяком случае, она пренебрежимо
мала по сравнению с массой электрона.
Масса нейтрона больше массы протона на
2,5![]() .
Следовательно, масса нейтрона превышает
суммарную массу частиц, фигурирующих
в правой части уравнения (48.7), на 1,5
.
Следовательно, масса нейтрона превышает
суммарную массу частиц, фигурирующих
в правой части уравнения (48.7), на 1,5![]() т.
е. на 0,77 МэВ. Эта энергия выделяется при
распаде нейтрона в виде кинетической
энергии образующихся частиц.
т.
е. на 0,77 МэВ. Эта энергия выделяется при
распаде нейтрона в виде кинетической
энергии образующихся частиц.
Характеристики атомного ядра. Одной из важнейших характеристик атомного ядра является зарядовое число Z. Оно равно количеству протонов, входящих в состав ядра, и определяет его заряд, который равен +Ze. Z определяет порядковый номер химического элемента в периодической таблице Менделеева. Поэтому его также называют атомным номером ядра.
Число нуклонов
(т. е. суммарное число протонов и нейтронов)
в ядре обозначается буквой А
и называется массовым числом ядра. Число
нейтронов в ядре равно
![]() .
.
Для обозначения
ядер применяется символ
![]() ,
где под Х
подразумевается химический символ
данного элемента. Слева вверху ставится
массовое число, слева внизу – атомный
номер (последний значок часто опускают).
Иногда массовое число пишут не слева,
а справа от символа химического элемента
(
,
где под Х
подразумевается химический символ
данного элемента. Слева вверху ставится
массовое число, слева внизу – атомный
номер (последний значок часто опускают).
Иногда массовое число пишут не слева,
а справа от символа химического элемента
(![]() ).
).
Масса ядра.
Второй основной характеристикой ядра
является его масса. Масса ядра меньше
массы атома ~ на
![]() ,
т. е. на массу всех электронов данного
атома. Масса электрона много меньше
массы ядра. Отношение массы электрона
,
т. е. на массу всех электронов данного
атома. Масса электрона много меньше
массы ядра. Отношение массы электрона
![]() к массе протона
к массе протона
![]() равно
равно
![]() .
.
4. Изотопы, изобары (примеры).
Ядра с одинаковым
Z,
но разными А
называются изотопами. Большинство
химических элементов имеет по нескольку
стабильных изотопов. Так, например, у
кислорода имеется три стабильных
изотопа:
![]() ,
у олова — десять, и т. д. Водород имеет
три изотопа:
,
у олова — десять, и т. д. Водород имеет
три изотопа:
![]() – обычный водород,
или протий (Z=1,
N=0),
– обычный водород,
или протий (Z=1,
N=0),
![]() – тяжелый водород,
или дейтерий (Z=1,
N=1)
– тяжелый водород,
или дейтерий (Z=1,
N=1)
![]() – тритий (Z=1,
N=2).
– тритий (Z=1,
N=2).
дейтерий обозначают также символом D, а тритий — символом Т. Протий и дейтерий стабильны, тритий радиоактивен.
Ядра с одинаковым
массовым числом А называются изобарами.
В качестве примера можно привести
![]() и
и
![]() .
.
5. Энергия связи атомного ядра, дефект масс.
Масса ядра
![]() меньше суммы масс входящих в него частиц.
Это обусловлено тем, что при объединении
нуклонов в ядро выделяется энергия
связи нуклонов друг с другом.
меньше суммы масс входящих в него частиц.
Это обусловлено тем, что при объединении
нуклонов в ядро выделяется энергия
связи нуклонов друг с другом.
Энергия покоя
частицы связана с ее массой соотношением
![]() .
Следовательно, энергия покоящегося
ядра меньше суммарной энергии
невзаимодействующих покоящихся нуклонов
на величину
.
Следовательно, энергия покоящегося
ядра меньше суммарной энергии
невзаимодействующих покоящихся нуклонов
на величину
![]() .
(7.7.1)
.
(7.7.1)
Эта величина и
есть энергия связи нуклонов в ядре. Она
равна той работе, которую нужно совершить,
чтобы разделить образующие ядро нуклоны
и удалить их друг от друга на такие
расстояния, при которых они практически
не взаимодействуют друг с другом.
Равенство (7.7.1) практически не нарушится,
если заменить массу протона
![]() массой водорода
массой водорода
![]() ,
а массу ядра
,
а массу ядра
![]() – массой атома
– массой атома
![]() .
Действительно, если пренебречь
сравнительно ничтожной энергией связи
электронов с ядрами, указанная замена
будет означать добавление к уменьшаемому
и вычитаемому выражения, стоящего в
фигурных скобках, одинаковой величины,
равной
.
Действительно, если пренебречь
сравнительно ничтожной энергией связи
электронов с ядрами, указанная замена
будет означать добавление к уменьшаемому
и вычитаемому выражения, стоящего в
фигурных скобках, одинаковой величины,
равной
![]() .
Таким образом, формуле (7.7.1) можно придать
вид
.
Таким образом, формуле (7.7.1) можно придать
вид
![]() (7.7.2)
(7.7.2)
Эта формула удобнее, чем (49.1), потому что в таблицах обычно даются не массы ядер, а массы атомов.
Энергия связи,
приходящаяся на один нуклон, т. е.
![]() ,
называется удельной энергией связи
нуклонов в ядре.
,
называется удельной энергией связи
нуклонов в ядре.
Величина
![]() (7.7.3)
(7.7.3)
называется дефектом
массы ядра. дефект массы связан с энергией
связи соотношением
![]() .
.
6. Форма и размеры атомных ядер.
