
- •2.Натурфилософия античного мира
- •3.Методология и методы. Эмпирические методы
- •5.Теоретические методы исследования,
- •10.Понятие массы в современной физике. Его поливалентность. Принцип эквивалентности. Философские аспекты геометризации пространства.
- •11.Общая теория относительности. Доказательства её истинности.
- •12.Три закона Ньютона. Инерциальные системы отсчёта.
- •13.Динамика поступательного движения. Основные понятия и законы поступательного движения. Закон сохранения момента импульса.
- •15.Вращательное движение. Момент силы и момент импульса.
- •16.Уравнение динамики вращательного движения. Момент инерции.
- •17.Закон сохранения момента импульса.
- •19.Закон збереження енергії в термодинаміці
- •24. Основні поняття молекулярної фізики та термодинаміки
- •26 Робота при ізопроцесах
- •28Вн́утрішня ене́ргія тіла
- •31.Зворотні і незворотні процеси. Ентропія
- •32. Температурні цикли. Цикл Карно
- •29. Енергія, робота, теплота
24. Основні поняття молекулярної фізики та термодинаміки
Розділ фізики, що вивчає залежність будови і фізичних властивостей тіл від характеру руху і взаємодії між частинками, з яких складаються тіла, називаються молекулярною фізикою. В основі теорії лежать три важливі положення, підтверджені експериментально і теоретично:
1) Усі тіла складаються з найдрібніших частинок – атомів, молекул, до складу яких входять ще дрібніші елементарні частинки. Будова будь-якої речовини переривчаста. 2) Атоми і молекули речовини завжди перебувають у безперервному хаотичному русі, який називається тепловим. 3) Між частинками будь-якої речовини існують сили взаємодії – притягання і відштовхування.
Ці положення підтверджуються явищами дифузії, броунівського руху, особливостями будови і властивостями газів, рідин, твердих тіл та іншими явищами.
Основні поняття МКТ:
Молекула – найменша стійка частинка речовини, яка зберігає її хімічні властивості.
Кількість речовини – характеристика фізичного тіла, яка пропорційна кількості молекул у тілі. Основна одиниця кількості речовини в СІ – моль (?).
Моль – кількість речовини, що містить стільки молекул (атомів), скільки атомів у 0,012кг вуглецю.
Один моль будь-якої речовини містить однакову кількість атомів або молекул. Це число називається числом Авогадро (NA).
NA = 6,02? 1023 моль-1.
Відомо, що моль за нормальних умов має об’єм V0 = 22,4? 10-3м3. Отже, в 1м3 будь-якого газу за нормальних умов міститься однакове число молекул:
![]()
Це число називають сталою Лошмідта . Маса окремого атома або молекули дуже мала, тому зручно користуватися відносними значеннями мас молекул (або атомів). Відносною молекулярною (або атомною) масою речовини M називають відношення маси молекули (або атома) m0 даної речовини до однієї дванадцятої маси m0c ізотопу 12С атома вуглецю.
Відносна молекулярна або атомна маса – безрозмірна величина.
Молярна маса М – маса 1 моля речовини. Вона дорівнює добутку маси молекули на сталу Авогадро.
Доказом хаотичного руху молекул є спостережуваний під мікроскопом безладний безперервний рух нерозчинних у рідині малих крупинок твердої речовини, розмір яких має порядок 10-10м. У 1827р. англійський ботанік Р.Броун, спостерігаючи квітковий пилок під мікроскопом, виявив, що він рухається.
Дифузія – це явище проникнення молекул одного виду у проміжки між молекулами іншого виду
Термодинáміка - розділ теоретичної фізики, що стосується законів явищ поширення та збереженнятепла. Розрізняють феноменологічну та статистичну термодинаміки. Остання в свою чергу поділяється на класичну й квантову.Термодинаміка вивчає процеси, які відбуваються в тілах, що перебувають утепловій рівновазіз іншими тілами. Важливою характеристикою теплової рівноваги єтемпература.Рівняння станупов'язує між собою такі характеристики тіл, яктиск,об'ємта температуру.Зміни термодинамічного стану фізичних систем вивчаються при рогзляді термодинамічних процесів.Термодинаміка вводить феноменологічно таке поняття, якентропія.Термодинаміка була створена завдяки потребі побудови теоретичного підґрунтя для опису роботитеплових двигунів.
Основним законом термодинаміки є так званий перший закон термодинаміки- формулюваннязакону збереження енергії.Другий закон термодинамікивстановлює неможливість повного перетворення теплоти в механічнуроботу.
Об'єктом дослідження термодинаміки є термодинамічна система- сукупністьтіл, які взаємодіють між собою та оточенням. Термодинамічна система називаєтьсязакритоюабовідкритою, в залежності від того, чи вона може обмінюватися речовиною з навколишніми тілами. Якщо система не може обмінюватися з навколишніми тілами ні речовиною, ні енергією, то вона називаєтьсяізольованою.Рівноважна термодинаміка вивчає термодинамічні системи в станітермодинамічної рівноваги. В такому стані систему можна охарактеризувати параметром, який називаєтьсятемпературою. В рівноважному стані температура однакова для усіх частин термодинамічної системи, а у випадку неізольованої термодинамічної системи вона збігається з температурою навколишніх тіл, які в термодинаміці називаютьтермостатом. Існування рівноважного стану часто називаютьнульовим законом термодинаміки.Кожна рівноважна термодинамічна система характеризується набором термодинамічних змінних(параметрів):об'ємом,тиском, хімічним складом, температурою, ентропією,хімічними потенціаламита іншими. Не всі з цих параметрів є незалежними. В рівноважному стані їхні значення зв'язані між собоюрівняннями стану. Якщо термодинамічну систему помістити в зовнішнє поле, наприклад,електричне, то термодинамічними параметрами стають також величина прикладеного поля і відклик системи на це поле, у випадку електричного поля -напруженість електричного поляіелектрична індукція.
Ідеа́льний газ (рос. идеальный газ; англ. ideal gas, нім. ideales Gas n) — це газ, в якомумолекулиможна вважатиматеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями до ідеального газу є реальні розріджені гази,тискв яких не перевищує 200атмосфері які перебувають при не дуже низькійтемпературі, оскільки за таких умов відстань між молекулами набагато перевищує їх розміри.
Розрізняють три типи ідеального газу:
Класичний ідеальний газ або газ Максвелла-Больцмана.
Ідеальний квантовий газ Бозе(складається збозонів). Див.статистика Бозе-Ейнштейна.
Ідеальний квантовий газ Фермі(складається зферміонів). Див.статистика Фермі-Дірака.
Уравнение состояния идеального газа – уравнение Менделеева-Клапейрона.
Рівн́яння стáну ідеáльного гáзу — формула, що встановлює залежність міжтиском, молярним об'ємом іабсолютноютемпературоюкласичногоідеального газу. Рівняння має вигляд:
![]() ,
де:
,
де:
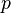 —тиск,
—тиск,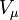 —молярний
об'єм,
—молярний
об'єм,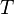 —абсолютна
температура,
—абсолютна
температура,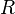 —універсальна
газова стала.
—універсальна
газова стала.
Оскільки
![]() ,
де
,
де![]() —кількість
речовини, то рівняння можна записати
у вигляді:
—кількість
речовини, то рівняння можна записати
у вигляді:
![]()
![]()
Останнє рівняння називають об'єднаним газовим законом. З нього випливають закони Бойля—Маріотта, Шарля і Гей—Люссака:
![]() —закон
Гей-Люссака
—закон
Гей-Люссака
![]() —закон Шарля
(другий закон Гей-Люссака)
—закон Шарля
(другий закон Гей-Люссака)
![]() —закон
Бойля-Маріотта
—закон
Бойля-Маріотта
Закон
Бойля—Маріотта названий на честь
ірландського фізика,хімікаіфілософаРоберта Бойля (1627—1691), що відкрив його
в1662, а також
на честь французького фізика Едма
Маріотта (1620—1684), який відкрив цей закон
незалежно від Бойля в1676році. Якщо записати![]() ,
де m — маса,
,
де m — маса,![]() —молярна
маса, рівняння стану виглядатиме
так:
—молярна
маса, рівняння стану виглядатиме
так:
![]()
Ця форма запису носить назву рівняння (закона) Клапейрона—Менделєєва.
Інша форма запису, яка частіше використовується в статистичній фізиці:
![]() ,
,
де
N — кількість частинок,
![]() —стала
Больцмана.
—стала
Больцмана.
Її можна також переписати у вигляді
![]() ,
,
де n = N/V — густина частинок.
Уравнение ) называется уравнением Менделеева – Клапейрона и является основным уравнением, связывающим параметры газа в состоянии теплового равновесия. Поэтому его называют уравнением состояния идеального газа.
помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех параметров - давление, объем или температура - остаются неизменными. Количественные зависимости между двумя параметрами газа при фиксированном значении третьего называют газовыми законами. 25. Ізопроцеси
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами (от греческого слова «изос» - равный). Правда, в действительности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра. Всегда имеются те или иные воздействия, нарушающие постоянство температуры, давления или объема. Лишь в лабораторных условиях удается поддерживать постоянство того или иного параметра с высокой точностью, но в действующих технических устройствах и в природе это практически неосуществимо. Изопроцесс - это идеализированная модель реального процесса, которая только приближенно отражает действительность.
Изотермический процесс. Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим. Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой - термостатом. Иначе при сжатии или расширении температурагаза будет меняться. Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса. Согласно уравнению состояния идеального газа (10.4) в любом состоянии с неизменной температурой произведение давления газа на его объем остается постоянным:
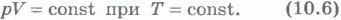
Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно. Этот закон экспериментально был открыт английским ученым Р. Бойлем (1627-1691) и несколько позже французским ученым Э. Мариоттом (1620-1684). Поэтому он носит названиезакона Бойля - Мариотта. Закон Бойля - Мариотта справедлив обычно для любых газов, а также и для их смесей, например для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными. Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой. Изотерма газа изображает обратно пропорциональную зависимость между давлением и объемом. Кривую такого рода в математике называют гиперболой (рис.10.1).
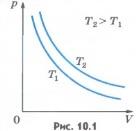
Различным постоянным температурам соответствуют различные изотермы. При повышении температуры газа давление согласно уравнению состояния (10.4) увеличивается, если V=const. Поэтому изотерма, соответствующая более высокой температуре T2, лежит выше изотермы, соответствующей более низкой температуре T1 (см. рис.10.1). Для того чтобы процесс происходил при постоянной температуре, сжатие или расширение газа должно происходить очень медленно. Дело в том, что, например, при сжатии газ нагревается, так как при движении поршня в сосуде скоростьмолекул после ударов о поршень увеличивается, а следовательно, увеличивается и температура газа. Именно поэтому для реализации изотермического процесса надо после небольшого смещения поршня подождать, когда температура газа в сосуде опять станет равной температуре окружающего воздуха. Кроме этого, отметим, что при быстром сжатии давление под поршнем сразу становится больше, чем во всем сосуде. Если значения давления и температуры в различных точках объема разные, то в этом случае газ находится в неравновесном состоянии и мы не можем назвать значения температуры и давления, определяющие в данный момент состояние системы. Если систему предоставить самой себе, то температура и давление постепенно выравниваются,системаприходит в равновесное состояние.Равновесное состояние - это состояние, при котором температура и давление во всех точках объема одинаковы. Параметры состояния газа могут быть определены, если он находится в равновесном состоянии. Процесс, при котором все промежуточные состояния газа являются равновесными, называют равновеснымпроцессом. Очевидно, что на графиках зависимости одного параметра от другого мы можем изображать только равновесные процессы. Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческого слова «барос» - вес). Согласно уравнению (10.4) в любом состоянии газа с неизменным давлением отношение объема газа к его температуре остается постоянным:
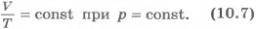
Для газа данной массы при постоянном давлении отношение объема к температуре постоянно. Этот закон был установлен экспериментально в 1802 г. французским ученым Ж. Гей-Люссаком (1778-1850) и носит название закона Гей-Люссака. Согласно уравнению (10.7) объем газа при постоянном давлении пропорционален температуре:
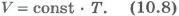
Эта зависимость графически изображается прямой, которая называется изобарой (рис.10.2). Разным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре согласно закону Бойля - Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению p2, лежит ниже изобары, соответствующей более низкому давлению p1.
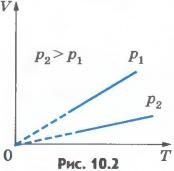
В области низких температур все изобары идеального газа сходятся в точке T=0. Но это не означает, что объем реального газа обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния (10.4) неприменимо. Именно поэтому, начиная с некоторого значения температуры, зависимость объема от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может. Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем, если внешнее давление постоянно. Постоянство давления в цилиндре обеспечивается атмосферным давлениемна внешнюю поверхность поршня.Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным (от греческого слова «хорема» - вместимость). Из уравнения состояния (10.4) вытекает, что в любом состоянии газа с неизменным объемом отношение давления газа к его температуре остается постоянным:
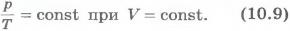
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. Этот газовый закон был установлен в 1787 г. французским физиком Ж.Шарлем (1746-1823) и носит название закона Шарля. Согласно уравнению (10.9) давление газа при постоянном объеме пропорционально температуре:
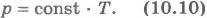
Эта зависимость изображается прямой, называемой изохорой (рис.10.3). Разным объемам соответствуют разные изохоры. С ростом объема газа при постоянной температуре давление его согласно закону Бойля - Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей меньшему объему V1.
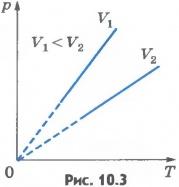
В соответствии с уравнением (10.10) все изохоры идеального газа начинаются в точке T=0. Значит, давление идеального газа при абсолютном нуле равно нулю. Увеличение давления газа в любом сосуде или в электрической лампочке при нагревании можно считать изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объема. Газовые законы - частный случай уравнения состояния идеального газа, один из параметров которого остается постоянным.
25. Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'. В то же время силы давления, действующие со стороны газа на поршень, совершают работу A = –A'. Если объем газа изменился на малую величину ΔV, то газ совершает работу pSΔx = pΔV, где p – давление газа, S – площадь поршня, Δx – его перемещение.
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
|
|
или в пределе при ΔVi → 0:
|
|
В изохорном процессе (V = const) газ работы не совершает, A = 0.
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением:
|
A = p (V2 – V1) = pΔV. |
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением Q = A.
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими.
Работа газа в адиабатическом процессе выражается через температуры T1 и T2 начального и конечного состояний:
|
A = CV (T2 – T1). |
Изобарный процесс (др.-греч.ἴσος «одинаковый» и βάρος «тяжесть») —термодинамический процесс, происходящий в системе при постоянномдавлениии постоянной массе идеального газа.
Согласно
закону
Гей-Люссака, при изобарном процессе
видеальном
газе![]() .
.
Работа,
совершаемая газом при расширении или
сжатии газа, равна
![]() .
.
Количество
теплоты, получаемое или отдаваемое
газом, характеризуется изменением
энтальпии:![]() .
.
Универса́льная га́зовая постоя́нная (также — постоянная Менделеева)— термин, впервые введённый в употребление Д. Менделеевымв1874г. Численно равна работе расширения одногомоляидеального газавизобарном процессепри увеличении температуры на 1К.
В
1874 году[1][2]
Д.
Менделееввычислил значение константы
вуравнении
Менделеева-Клапейрона(уравнении
состоянияидеального
газа) для одного моля газа, используязакон
Авогадро, согласно которому 1 моль
различных газов при одинаковом давлении
и температуре занимает одинаковый
объём (![]() ).
).
В
некоторых научных кругах эту постоянную
принято называть постоянной
Менделеева.
Обозначается латинской буквой
![]() .
.
Входит
в уравнение
состояния идеального газа![]() .
.
В
Международной
системе единиц (СИ)универсальная
газовая постоянная равна[3]
![]() Дж⁄(моль∙К).
Дж⁄(моль∙К).
В
системе СГСуниверсальная газовая постоянная равна![]() Эрг⁄(моль∙К).
Эрг⁄(моль∙К).
Удельная
газовая постоянная(R/M) для сухого
воздуха:![]() Дж⁄(кг∙К)
Дж⁄(кг∙К)
Связь между газовыми константами
Универсальная
газовая постоянная выражается через
произведение постоянной
Больцмананачисло
Авогадро,![]() .
Универсальная газовая постоянная более
удобна при расчетах, когда число частиц
задано вмолях.
.
Универсальная газовая постоянная более
удобна при расчетах, когда число частиц
задано вмолях.
