
ХФ ВМС; Учебное пособие
.pdf
5.ПОЛИКОНДЕНСАЦИЯ
5.1.Общие сведения о реакциях поликонденсации
5.1.1.Основные отличительные признаки полимеризации. Сравнительная
характеристика поликонденсации и полимеризации
Поликонденсация – процесс образования макромолекул путём одновременного присоединения мономеров и продуктов их взаимодействия друг к другу, сопровождающегося исчезновением реакционных центров после каждого элементарного акта удлинения цепи.
Реакционными центрами при поликонденсации могут быть радикалы, ионы, отдельные атомы, комплексы, и (чаще всего) − реакционноспособные функциональные группы.
В общем случае поликонденсацию можно представить следующими схемами:









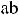 ;
;




 ;
;



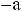


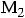
 ,
,
где М1, М2 и М3 – мономерные звенья; а и b – фрагменты функциональных групп или реакционных центров; ab − низкомолекулярный побочный продукт; а' и b' – составные звенья, образованные из реакционных центров мономеров.
На концах макромолекул остаются реакционные центры, природа которых зависит от состава исходной мономерной смеси.
Каждый единичный акт роста макромолекул сопоровождается гибелью двух реакционных центров. При этом возможны два крайних случая механизма стадии роста цепи:
-полная димеризация, затем – полная дупликация димеров, затем – тетрамеров и т. д.;
-последовательное присоединение мономеров к растущей цепи (по аналогии с сополимеризацией при r1 = r2 = 0).
Впервом случае ̅n возрастает в геометрической прогрессии, во втором – в арифметической. В реальных условиях – механизм комбинированный, причём вначале процесса преобладает дупликация, а на завершающем этапе процесса – последовательное присоединении.
Кроме основополагающего отличия – механизмов реакции роста цепи, процессы полимеризации и поликонденсации имеют ещё ряд существенных отличий:
1. Конверсия мономеров: при поликонденсации она происходит сравнительно быстро, превращаясь в олигомеры, в отличие от
61
полимеризации, при которой конверсия мономера происходит постепенно в течение всего процесса;
2.Образование высокомолекулярных цепей: при поликонденсации они появляются на заключительном этапе процесса, в то время как при полимеризации высокомолекулярный продукт присутствует в реакционной смеси уже вначале стадии роста цепи;
3.Динамика нарастания ̅n : при поликонденсации длина цепи увеличивается медленно в течение всего процесса, но в соответствии с закономерностями, подобными геометрической прогрессии; при полимеризации длина цепи возрастает быстро в начальные моменты процесса по закону арифметической прогрессии, и в дальнейшем, как правило, изменяется мало;
4.Химический состав полимера: при полимеризации химические составы мономеров и полимеров практически не отличаются; при поликонденсации в большинстве случаев составы отличаются, что обусловлено образованием низкомолекулярных побочных продуктов.
5.1.2.Мономеры для поликонденсации
Для образования ВМС поликонденсационным методом мономеры должны иметь не менее 2-х реакционных центров в каждой молекуле. Причём – именно реакционных центров, а не функциональных групп, так как эти понятия не тождественные: одна и та же функциональная группа, в зависимости от условий процесса и состава реакционной смеси, может иметь различное количество реакционных центров (например –NH2 группа), выступать как реакционный центр целиком или частью (например –ОН группа). Кроме того, реакционные центры могут быть вообще вне связи с функциональными группами (фенолы).
Большинство реакций поликонденсации – каталитические процессы. Катализ направлен на образование активного реакционного центра. В основе химизма поликонденсации лежат известные из органической химии легко протекающие реакции. Наиболее распространенными мономерами для поликонденсации являются:
-гликоли, бисфенолы, фенолы, а также тиоаналоги перечисленных;
-диамины, диизоцианаты;
-дикарбоновые кислоты, а также их ангидриды, хлорангидриды,
эфиры;
-диалкилгалогениды, диэпоксиды;
-хлорсиланы, силанолы, алкоксисиланы.
Принцип подбора мономерных пар такой: один из мономеров должен иметь электрофильные центры, другой – нуклеофильные. Причём одна и та же функциональная группа может выступать как носитель одновременно нуклеофильных и электрофильных центров, например гидроксиалкильная или карбоксильная группы.
62

5.1.2.1. Понятие о функциональности мономеров для поликонденсации
Функциональность f – количество функциональных групп или реакционных центров в одной молекуле.
От f зависит возможность образования высокомолекулярного продукта,
атакже характер топологического строения макромолекул:
-если f обоих мономеров равна 2, образуются линейные структуры;
-если хотя бы один из мономеров имеет больше 2, образуются разветвлённые и/или сшитые структуры. Но если при > 2 реакционная способность реакционных центров существенно отличается (например в глицерине), то можно получить линейные структуры со свободными боковыми функциональными группами, которые при изменении условий процесса и введении дополнительных компонентов дают разветвления и сшивку. Это широко используют на практике;
-если хотя бы какой-то части мономеров меньше 2, образуются низкомолекулярные или олигомерные продукты.
Кроме , ̅n зависит от соотношения (эквивалентности) мономеров, наличия монофункциональных примесей, побочных реакций с участием мономеров, реакционной способности функциональных групп и независимости активности концевых групп от длины цепи.
Независимость реакционной способности концевых функциональных групп от степени полимеризации называют принципом Флори.
В большинстве процессов он соблюдается при ̅n, превышающей 5−10. Что касается мономеров, то все они в той или иной мере характеризуются взаимозависимостью функциональных групп – влиянием превращения первой группы на активность второй.
5.1.3. Основные поликонденсационные процессы и механизмы получения полимеров
Разнообразие используемых для поликонденсации мономеров обусловливает разнообразие механизмов процессов. Однако для них можно выделить общие основные стадии:
1.Образование реакционных центров;
2.Образование макромолекул реакциями роста и сочетания;
3.Прекращение роста.
Химические механизмы реакций при поликонденсации – предмет изучения органической химии. В рамках химии ВМС, как и в случае полимеризации, изучают закономерности роста молекулярной массы и влияние полимерной природы на характер взаимодействия молекул.
В основе реакций поликонденсации – электрофильное или нуклеофильное замещёние. Практически все промышленные поликонденсационные процессы – каталитические.
63

5.1.3.1. Полиэтерификация
Полиэтерификация − процесс получения сложных эфиров из гликолей и дикарбоновых кислот:
.
Катализаторами процесса могут выступать кислоты, основания, соли, окислы, алкоголяты, металлоорганические соединения.
При катализе сильными протонными кислотами постадийный механизм процесса можно представить следующим образом:
1. Образование реакционного центра:
.
Вторым реакционным центром является атом кислорода гидроксильной группы гликоля.
2. Образование переходного комплекса:
.
2. Образование сложноэфирной связи и регенерация катализатора:
.
Скорость образования карбокатиона зависит от силы кислоты. Механизм катализа солями, окислами и другими катализаторами
отличается тем, что активный центр возникает за счет образования комплекса по карбонильному кислороду и последующего повышения электрофильности карбонильного углерода.
Преимуществом рассмотренного процесса является доступность мономеров. К недостаткам следует отнести обратимость и побочные реакции (например, циклизация гликолей).
5.1.3.2. Полипереэтерификация
Полипереэтерификация – процесс получения полиэфиров из эфиров дикарбоновых кислот и низших спиртов с гликолями.
Наиболее типичным и практически значимым процессом получения полиэфиров данным методом является синтез полиэтилентерефталата (ПЭТ). Промышленный метод получения ПЭТ – двухстадийный:
1. Переэтерификация диметилтерефталата этиленгликолем:
64

 .
.
2.Переэтерификация гидроксиэтилфталатной функцией одной эфирной молекулы гидроксиэтильной функции другой молекулы:
.
Фактически имеет место поликонденсация по схеме
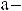







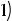
 .
.
Одностадийный процесс не позволяет обеспечить идеальную эквимолярность реакционных центров, которая в двухстадийном процессе реализуется по определению.
5.1.3.3. Поликонденсация дикарбоновых кислот и аминов
Данным методом получают в основном линейные полиамиды из алифатических мономеров:
Процесс осуществляют при повышенной температуре в условиях отсутствия диссоциации на ионы.
Механизм процесса можно представить следующим образом: 1. Образование реакционного центра:
 .
.
Вторым реакционным центром является нуклеофильная аминогруппа. 2. Образование амидной связи:
.
По сути – это обычный кислотный катализ
5.1.3.4. Поликонденсация хлорангидридов дикарбоновых кислот и аминов
65

Данный метод используют для синтеза ароматических полиамидов с высокой температурой плавления, соизмеримой с температурой деструкции, что не позволяет получать и перерабатывать такие полимеры в расплаве. Изза низкой активности ароматических аминов поликонденсация с кислотами при температуре кипения доступных растворителей не идёт. Поэтому вместо кислот используют более активные хлорангидриды:
.
Реакция идёт по механизму SN2:
Для смещёния равновесия реакции в сторону образования продукта используют акцепторы HCl: щелочи, карбонаты, нуклеофильные растворители – диметилформамид, диметилацетамид, пиридин. Как правило, такие процессы гетерофазные и гетерогенные: хлорангидриды содержатся в органической фазе, а амины и акцепторы – в водной; реакция протекает на границе раздела фаз. Процесс проводят при пониженной температуре. Из полимеров, полученных данным методом, формуют пленки и волокна прямо из реакционной массы. Сами же полимеры получили название арамиды. Основное их применение – производство высокомодульных волокон, таких как кевлар.
5.1.3.5. Поликонденсация хлорангидридов дикарбоновых кислот и гидроксилсодержащих соединений
По данному способу получения полиэфиров процесс проводят при повышенной температуре в растворе или расплаве, а также в условиях межфазной поликонденсации:
.
Поскольку выделяющийся HCl практически не влияет на процесс, акцепторы, как правило, не используют. Механизм процесса подобен механизму получения арамидов. Если в качестве диола используют бисфенолы, то продукты называют полиарилаты. Продукты, получаемые их бисфенолов и фосгена (хлорангидрида угольной кислоты – газообразного соединения), называют поликарбонаты.
5.1.3.6. Поликонденсация фенола с формальдегидом
66

Конденсация фенол а с формальдегидом возможна при катализе как кислотами, так и основаниями. Особенностью фенол-формальдегидной кондансации является то, что не только реакционные центры, но и их «носители» − функциональные группы возникают непосредственно в процессе. Характер катализа приводит к существенным отличиям строения продуктов: при кислотном катализе получают линейные структуры, а при основном – разветвлённые. В первом случае продукты называют новолачные смолы, а во втором − резольные смолы.
А. Поликонденсация в присутствии кислых катализаторов Для катализа используют сильные и слабые кислоты. По
технологическим соображениям более предпочтительны не сильные кислоты: щавелевая, трихлоруксусная. Эти кислоты легче удалить из продукта. Механизм процесса можно представить следующим образом:
1. Образование карбониевого катиона:
.
2. Образование реакционного центра – бензилкарбониевого иона:
.
Образованные после отщепления молекулы воды бензилкарбониевые и хинонметидные катионы – очень реакционноспособные промежуточные продукты. Вторым реакционным центром считают фенол в виде цвинтериона.
3. Электрофильная атака фенола бензилкарбониевым катионом:
67

.
Получаемые продукты – олигомеры с молекулярной массой до 5000. Более высоких значений молекулярной массы достичь не представляется возможным. Это обусловлено тем, что из-за высокой активности карбониевого катиона нежелательной сшивки во время синтеза удается избежать лишь за счет проведения процесса в избытке фенола, т.е. в условиях неэквивалентности реакционных центров.
Орто-ориентация метиленовой группы более предпочтительна, т.к. орто-новолаки имеют лучшие эксплуатационные характеристики. Для получения орто-новолаков процесс проводят при рН 4−7 в присутствии окислов и гидроокислов Zn, Mg, Al. Эти и им подобные соединения образуют координационные комплексы с фенольными производными, способствуя тем самым ориентации карбониевого катиона в орто-положение.
Б. Поликонденсация в присутствии щелочных катализаторов Катализаторами фенольно-формальдегидной конденсации в основной
среде могут выступать: неорганические щелочи и гидроокиси металлов, карбонаты, третичные амины, аммиак.
Механизм, с некоторыми упрощениями, можно представить следующим образом:
1. Образование фенолят-аниона – 1-го реакционного центра:
.
Как видно из схемы, образование фенолят-аниона сопровождается его резонансной стабилизацией.
2. Нуклеофильная атака резонансно стабилизированной формой фенолят-аниона электрофильного атома углерода в молекуле формальдегида и образование второго реакционного центра – хинонметида:
68

Лимитирующей реакцией на этой стадии является отщепление гидроксиланиона и образование хинонметида.
3. Стадия роста цепи:
В избытке формальдегида в процессе основной фенол-формальдегидной конденсации, наряду с олигогидроксифениленметиленовыми линейными структурами, образуются разветвлённые моно- и полигидроксиметиленовые производные. Сшивка при этом, при соблюдении необходимых режимов, не происходит. В щелочной среде, в отличие от кислой, гидроксиметиленовые группы достаточно стабильны. Поэтому избыток формальдегида не приводит к сшивке.
Так же как и при кислотной конденсации, присутствие в реакционной смеси ионов комплексообразующих металлов способствует орто-ориентации метиленовых звеньев.
69

5.1.3.7. Карбамидоформальдегидная поликонденсация
Карбамидоформальдегидные олигомеры широко используются для производства аминопластов, клеевых композиций, композиционных материалов ДСП, ДВП и МДФ.
Состав продуктов при данном виде поликонденсации существенно зависит от рН среды:
-при рН 11−13 образуется преимущественно моногидроксиметиленкарбамид;
-при рН 7−8 образуются моно- и N,N'-ди(гидроксиметилен)карбамид;
-при рН 1−4 образуются линейные, разветвлённые и сшитые метиленкарбамиды.
Поэтому процесс проводят в две стадии: сначала при рН не менее 7, а затем – не менее 4. Механизм процесса можно представить следующим образом:
1. Образование монометилолкарбамида в нейтрально-слабощелочной среде:
2. Конденсация карбамида, формальдегида и монометилолкарбамида в слабокислой среде:
3. Конденсация метилолмочевин в слабокислой среде при повышенной температуре с образованием линейных и разветвленных продуктов:
Основными реакциями при этом являются:
70
