
- •Раева в.М., Фролкова а.В. Основные законы равновесия жидкость – пар бинарных систем
- •Введение
- •1. Фазовые равновесия бинарных систем
- •1.1. Основные понятия
- •X' X''
- •1.2. Характеристики бинарных систем
- •2. Фазовое равновесие жидкость – пар бинарных систем
- •2.1. Основное уравнение фазового равновесия бинарных двухфазных систем
- •2.2. Законы Коновалова
- •Первый закон Коновалова
- •Второй закон Коновалова
- •Третий закон Коновалова
- •2.3. Законы Вревского
- •Первый закон Вревского
- •Второй закон Вревского
- •Второй закон Вревского
- •Третий закон Вревского
- •3. Эволюция бинарных азеотропов
- •Условные обозначения и сокращения
- •Литература
1.2. Характеристики бинарных систем
Бинарные жидкие растворы могут быть классифицированы по характеру и интенсивности межмолекулярных взаимодействий (ММВ) между компонентами в фазах и отклонениям фаз от идеального поведения, по избыточным термодинамическим функциям, а также по наличию или отсутствию расслаивания жидкой фазы (гомогенные и гетерогенные смеси) и др.
Степень
неидеальности жидкой фазы определяется
ММВ в растворе. Принято считать, что при
одинаковой интенсивности ММВ между
одноименными и разноименными молекулами
![]() раствор является идеальным. Если же
силы этих взаимодействий не равны, то
проявляются отклонения фазы от идеального
поведения: положительные
раствор является идеальным. Если же
силы этих взаимодействий не равны, то
проявляются отклонения фазы от идеального
поведения: положительные![]() или отрицательные
или отрицательные![]() .
.
Бинарные неидеальные растворы характеризуются различными отклонениями от идеального поведения, которые находят отражение в избыточных термодинамических функциях.
Функциями смешения фМ в термодинамике называют разности между значениями термодинамических функций в образованном растворе (фр) и аддитивными значениями, определяемыми из величин для чистых компонентов при постоянных давлении и температуре:
 .
(4)
.
(4)
Избыточные термодинамические функции – разность между функциями смешения реального и идеального растворов:
 .
(5)
.
(5)
Идеальные
растворы характеризуются нулевыми
значениями всех избыточных термодинамических
функций:
![]() .
В реальных растворах, в общем случае,
все избыточные термодинамические
функции отличны от нуля:
.
В реальных растворах, в общем случае,
все избыточные термодинамические
функции отличны от нуля:
![]() .
.
На рис. 5 приведены примеры концентрационных зависимостей избыточных функций бинарных гомогенных растворов, связанных при P=const и T=const термодинамическим соотношением:
![]() .
(6)
.
(6)
Данные состав – избыточное термодинамическое свойство для бинарных растворов регулярно публикуются в специальной и справочной литературе. В подавляющем большинстве случаев они приводятся для атмосферного давления.
Компоненты
с ограниченной взаимной растворимостью
образуют расслаивающиеся смеси (рис.
6). Условие появления критической точки
(7) означает, что в области расслаивания
![]() :
:
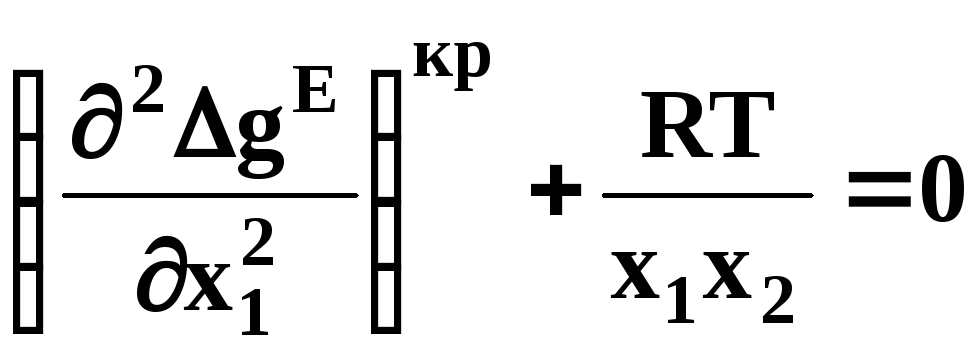 или
или
 .
(7)
.
(7)

Рис.
5. Примеры концентрационных зависимостей
избыточных
термодинамических
функций бинарных гомогенных растворов.
Условие (7) может быть выражено в терминах избыточных энтальпии и энтропии для верхней критической точки растворимости (рис. 4а, 6а, б) в виде:
 ,
,
 .
(8)
.
(8)
В области расслаивания избыточная энтропия может принимать как положительные, так и отрицательные значения, а величина избыточной энтальпии в таких системах должна быть строго положительной.
При реализации НКТР (рис. 4б, 6в) выполняются следующие условия:

 ,
,
 .
(9)
.
(9)
Знаки обеих избыточных функций здесь строго отрицательны. Системы с двумя критическими точками растворимости (рис. 4в) характеризуются знакопеременными концентрационными зависимостями избыточной энтальпии (рис. 6г).
Смеси
идеальных газов представляют собой
идеальные газовые растворы. Поведение
реальных газов описывают различными
уравнениями состояния, в которых
характер и степень отклонения от
идеального поведения учитываются
коэффициентами
![]() (i=1, 2):
(i=1, 2):
 .
.
Здесь Vi0п – объем реального газа (паровой фазы), Vид – объем идеального газа.
В условиях фазового равновесия жидкость – пар одновременно рассматриваются обе фазы системы. Условие (10) записано для компонента, условие (11) – для бинарной системы:
![]() .
(10)
.
(10)
![]() .
(11)
.
(11)
Здесь
![]() (i
=
1, 2) – давление насыщенных паров
компонентов при температуре кипения
раствора.
(i
=
1, 2) – давление насыщенных паров
компонентов при температуре кипения
раствора.
Парожидкостное
равновесие идеальной системы (жидкая
фаза – идеальный раствор
![]() ,
паровая фаза – смесь идеальных газов
,
паровая фаза – смесь идеальных газов![]() )
описывается законом Рауля:
)
описывается законом Рауля:
![]() .
(12)
.
(12)
Характер отклонения жидкой фазы от идеального поведения качественно и количественно определяется избыточной энергией Гиббса бинарного раствора (рис. 7):
![]() .
(13)
.
(13)
Коэффициенты активности компонентов в жидкой фазе могут быть определены из экспериментальных данных:
-
паровая фаза неидеальна (![]() ):
):
![]() ,
(14а)
,
(14а)
-
паровая фаза идеальна (![]() ):
):
![]() .
(14б)
.
(14б)
или
рассчитываются с использованием
математической модели парожидкостного
равновесия. Допущение
об идеальном поведении паровой фазы
реальной системы (![]() )
справедливо для систем, образованных
компонентами, не ассоциированными в
парах, а также в условиях, удаленных от
критических:
)
справедливо для систем, образованных
компонентами, не ассоциированными в
парах, а также в условиях, удаленных от
критических:![]() .
.
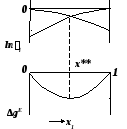
Точки экстремумов концентрационных зависимостей избыточной энергии Гиббса, в которых выполняется условие (15):
-
а
 )
)б
 )
)в
 )
)Рис. 7. Бинарные растворы с различным характером отклонения
от идеального поведения:
а) положительные; б) отрицательные; в, г) смешанные.
г)

![]() ,
,
![]() ,
(15)
,
(15)
называются
псевдоидеальными (рис. 7): х*
расположены в области
![]() ,
точких**
– в области
,
точких**
– в области
![]() .
.
Относительная летучесть компонентов бинарной системы определяется следующим образом:
![]() .
(16)
.
(16)
Для случая идеального поведения паровой фазы (14б) имеем:
 .
(17)
.
(17)
В
случае идеального аналога (смеси) для
любого состава
![]() и справедливо условие:
и справедливо условие:
 ,
(18)
,
(18)
которое
выполняется также в псевдоидеальных
точках (15) реальных (неидеальных) систем
(рис. 8, 9). При
неидеальном поведении системы
![]() .
.
На рис. 8 и 9 сплошные линии соответствуют реальным кривым фазового равновесия, пунктирные – их идеальным аналогам, хаз – точки азеотропов, в которых равны составы паровой и жидкой фаз.

Как будет показано ниже (раздел 3), псевдоидеальные точки играют важную роль при исследовании эволюции бинарных азотропов под воздействием температуры (давления).

Рис.
9. Примеры кривых фазового равновесия
бинарных систем со
смешанными отклонениями от идеального
поведения: а)
зеотропная система; б) моноазеотропная
система;
в)
биазеотропная система.
