
- •Раева в.М., Фролкова а.В. Основные законы равновесия жидкость – пар бинарных систем
- •Введение
- •1. Фазовые равновесия бинарных систем
- •1.1. Основные понятия
- •X' X''
- •1.2. Характеристики бинарных систем
- •2. Фазовое равновесие жидкость – пар бинарных систем
- •2.1. Основное уравнение фазового равновесия бинарных двухфазных систем
- •2.2. Законы Коновалова
- •Первый закон Коновалова
- •Второй закон Коновалова
- •Третий закон Коновалова
- •2.3. Законы Вревского
- •Первый закон Вревского
- •Второй закон Вревского
- •Второй закон Вревского
- •Третий закон Вревского
- •3. Эволюция бинарных азеотропов
- •Условные обозначения и сокращения
- •Литература
Второй закон Вревского
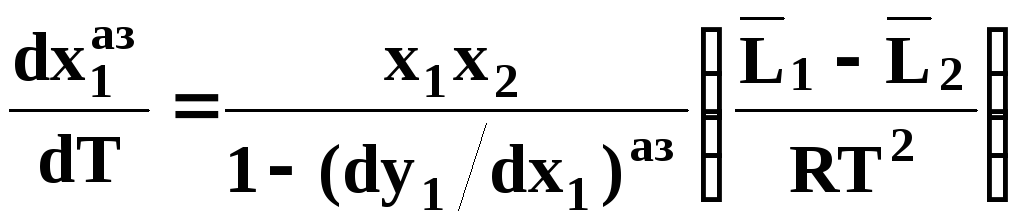 .
(48)
.
(48)
Знак
производной
![]() в уравнении
(48) определяется знаком разности
парциальных молярных теплот испарения
в уравнении
(48) определяется знаком разности
парциальных молярных теплот испарения
![]() и знаком знаменателя
и знаком знаменателя
![]() ;
последний зависит от типа азеотропа, а
именно: от тангенса угла наклона
касательной к кривой фазового равновесия
в точке азеотропа. Для
;
последний зависит от типа азеотропа, а
именно: от тангенса угла наклона
касательной к кривой фазового равновесия
в точке азеотропа. Для
положительного
азеотропа имеем
![]() ,для
отрицательного
,для
отрицательного
![]() .
.
Формулировки второго закона Вревского для азеотропов разных типов: при увеличении температуры (давления)
положительный азеотроп обогащается компонентом с большей парциальной молярной теплотой испарения:
![]()
![]() если
если
![]() ;
;![]() если
если![]() ;
;
отрицательный азеотроп обогащается компонентом с меньшей парциальной молярной теплотой испарения:
![]() если
если
![]() ;
;
![]() если
если
![]() .
.
Эволюция
бинарного азеотропа, представленная
на рис. 16, характеризуется соотношениями:
![]() ,
,![]() .
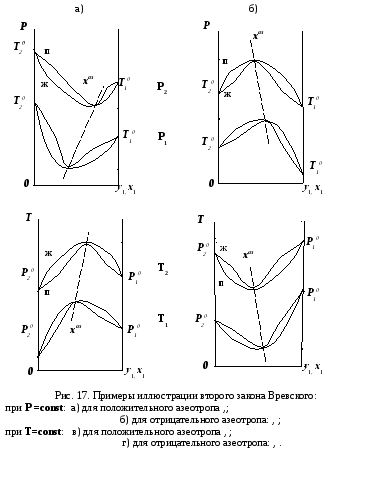
Примеры графической иллюстрации второго
закона Вревского для разных условий
(
.
Примеры графической иллюстрации второго
закона Вревского для разных условий
(![]() )
)![]() приведены
на рис. 17.
приведены
на рис. 17.

в)
г)
Третий закон Вревского
Закон
охватывает
условия второго и первого законов,
которые совместимы в бесконечно малый
промежуток времени. Первоначально
рассматривают точку азеотропа при
определенных температуре и давлении
(![]() ),
далее, закрепив этот состав (
),
далее, закрепив этот состав (![]() =const),
исследуют изменение состава пара и
азеотропа при варьировании температуры
(давления). Следовательно, в начальный
момент можно приравнять выражения в
скобках, полученные из уравнений (44) и
(47).
=const),
исследуют изменение состава пара и
азеотропа при варьировании температуры
(давления). Следовательно, в начальный
момент можно приравнять выражения в
скобках, полученные из уравнений (44) и
(47).
В
результате имеем результате имеем связь
двух производных, отражающих эволюцию
составов паровой фазы
![]() и азеотропа
(
и азеотропа
(![]() ):
):
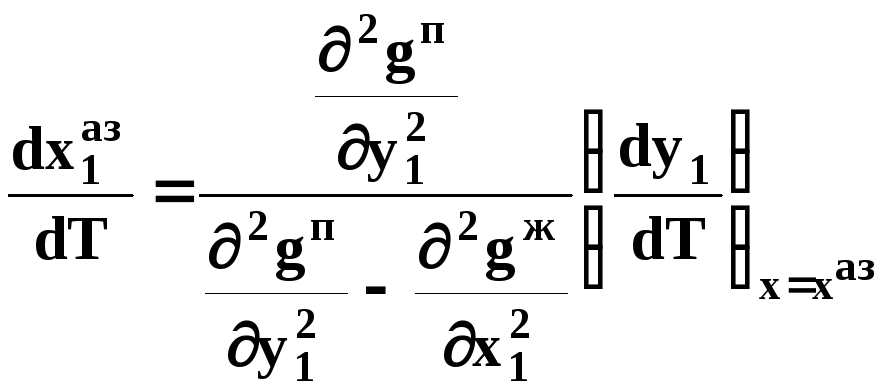 .
(49)
.
(49)
Для
точки азеотропа из третьего закона
Коновалова (37) выразим отношение вторых
производных
![]() потенциала:
потенциала:
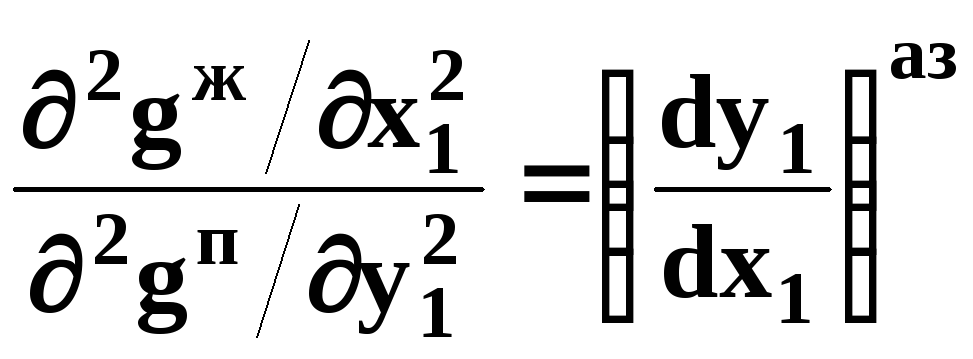 .
(50)
.
(50)
С учетом (48) уравнение (46) имеет вид:
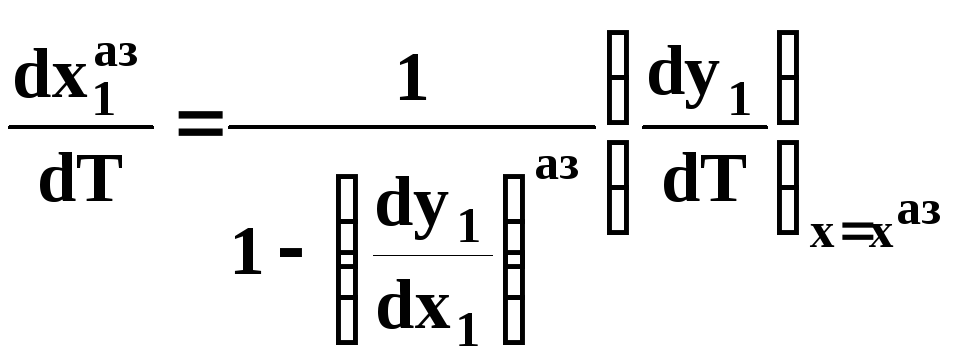 .
(51)
.
(51)
Математический
вывод третьего закона Вревского
базируется на анализе знаков величин,
входящих в уравнение (51). Для положительного
азеотропа
![]() и, следовательно,
и, следовательно,
![]() и
и![]() имеют одинаковые знаки. Для отрицательного
азеотропа
имеют одинаковые знаки. Для отрицательного
азеотропа
![]() и производные
и производные
![]() и
и
![]() имеют разные знаки.
имеют разные знаки.
Формулировка третьего закона Вревского: при увеличении температуры (давления) и для закрепленного состава жидкой фазы
для положительного азеотропа изменение составов пара и азеотропа происходит однонаправленно;
для отрицательного азеотропа изменение составов пара и азеотропа происходит разнонаправленно.
Проиллюстрируем
действие закона в графическом виде. В
системе с положительным азеотропом
(рис. 18а) при увеличении температуры
(давления) состав азеотропа обогащается
компонентом 1. Для закрепленного состава
жидкой фазы в паровой фазе также
увеличивается содержание этого компонента
(![]() ).
В системе с отрицательным азеотропом
(рис. 18б) имеем иную картину: при увеличении
температуры (давления) пар обогащается
компонентом 2, а азеотроп
компонентом 1 (разнонаправленное
изменение).
).
В системе с отрицательным азеотропом
(рис. 18б) имеем иную картину: при увеличении
температуры (давления) пар обогащается
компонентом 2, а азеотроп
компонентом 1 (разнонаправленное
изменение).
а)
б)
Рис.
18. Графическая интерпретация третьего
закона
Вревского
в системах с азеотропами разных типов:
а)
положительным; б) отрицательным.
![]()
