
Краткий курс органической химии. Часть 4
.pdf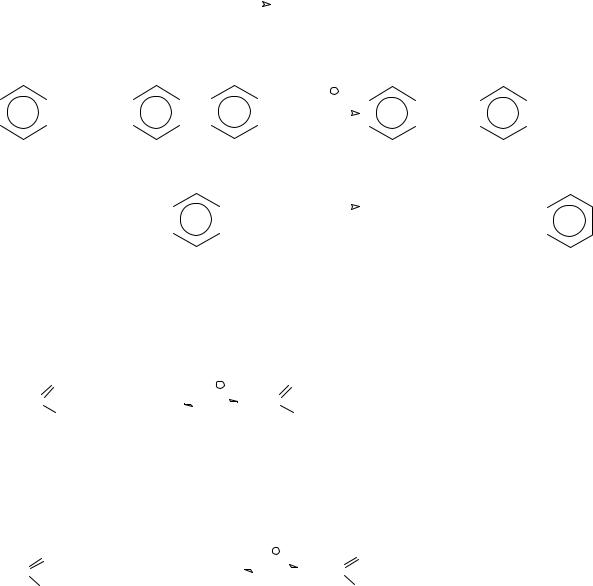
11
ное присоединение молекулы спирта к протонированной форме карбоновой кислоты, а пятая стадия – отщепление молекулы воды. Протон как катализатор присоединяется к карбоновой кислоте на первой стадии и отщепляется от протонированной формы сложного эфира на последней стадии.
Реакционная способность карбоновых кислот и спиртов в реакции этерификации зависит от их электрофильных и соответственно нуклеофильных свойств. Так, например, хлоруксусная кислота подвергается этерификации легче, чем уксусная кислота. Из-за низкой нуклеофильности фенолы в реакцию этерификации не вступают (см. Фенолы). Кроме того, большое значение имеет стерический фактор: чем менее объемными являются R и R′, тем легче образуется продукт на стадии нуклеофильного присоединения. Поэтому лучше всего этерифицируются неразветвленные карбоновые кислоты и первичные спирты, а третичные спирты в условиях реакции этерификации подвергаются дегидратации.
Кроме реакции этерификации, для получения сложных эфиров используют взаимодействие спиртов или фенолов, а также алкоголятов или фенолятов с более сильными ацилирующими реагентами – с галогенангидридами или ангидридами карбоновых кислот. В случае ацилирования спиртов и фенолов галогенангидридами карбоновых кислот используется катализ основаниями, а при ацилировании ангидридами – и основаниями, и кислотами. При ацилировании алкоголятов и фенолятов катализ, естественно, не требуется, поскольку они представляют собой сильные нуклеофилы.
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
Na2CO3 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
CH3C |
|
Cl + CH3CH2OH |
|
|
CH3C |
|
OCH2CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
ацетилхлорид |
|
|
|
|
|
|
этилацетат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
O |
|
C |
|
|
|
|
+ |
|
|
|
|
|
|
OH H |
|
|
|
|
|
|
|
|
C |
|
O |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензойный анигдрид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенилбензоат |
||||||||||||||||||||||||||||||||||
|
CH3CHCH2CH2C |
|
Cl + |
|
|
|
|
CH2ONa |
|
|
|
|
|
|
CH3CHCH2CH2C |
|
OCH2 |
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
CH3 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
O |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
4-метилпентаноилхлорид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензил-4-метилпентаноат |
|||||||||||||||||||||||||||||||||||
Для получения сложных эфиров применяют и реакцию переэтерификации, в которой спирты ацилируются сложными эфирами. Переэтерификация может катализироваться, как и многие реакции ацилирования, как кислотами, так и основаниями. В кислой среде механизм переэтерификации аналогичен механизму этерификации.
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
+ R' |
|
OH |
||||||
R |
|
C |
|
+ R" |
|
OH |
|
R |
|
C |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
O |
|
R' |
|
|
|
|
|
|
|
O |
|
R" |
|||||
|
|
|
|
|
|
|
|
|
|||||||||||
Равновесие этой реакции можно сдвинуть в нужную сторону, используя разницу в температурах кипения спиртов. Так, например, при нагревании метилбутаноата с 1- бутанолом в кислой среде постоянно проводят отгонку более летучего метанола, и равновесие смещается вправо.
|
O |
H |
|
|
|
|
O |
|||||
CH3C |
|
|
+ CH3CH2CH2CH2OH |
|
|
|
|
|
CH3C |
|
|
+ CH3OH |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
O |
|
CH |
|
|
|
|
|
|
O |
|
CH2CH2CH2CH3 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||||
|
3 |
|
|
|
|
|
|
|
|
|
||
www.mitht.ru/e-library
12
Сложные эфиры можно также получать алкилированием солей карбоновых кислот галогенопроизводными. Это взаимодействие является реакцией нуклеофильного замещения.
O |
|
O |
|
R C |
+ R' X |
R C |
+ NaX |
O Na |
O R' |
Так, например, по механизму SN2 происходит алкилирование бензоата натрия метилиодидом до метилбензоата.
COONa CH I |
COOCH |
3 |
3 |
_NaI |
|
3.1.2. Химические свойства |
|
1) Гидролиз |
|
Сложные эфиры гидролизуются до карбоновых кислот и спиртов как в кислой, так и в щелочной среде. Кислотный гидролиз обратим, это обратная реакция этерификации. Механизм кислотного гидролиза можно изобразить, рассмотрев механизм этерификации с конца.
|
|
O |
|
|
|
|
|
|
|
|
|
O |
||||
|
|
|
H |
|
|
|
||||||||||
R |
|
C |
+ H2O |
R |
|
C |
+ R' |
|
OH |
|||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
O |
|
R' |
|
|
|
|
|
|
|
|
|
OH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Щелочной гидролиз необратим, поскольку в результате реакции образуется не сама карбоновая кислота, а ее соль, совершенно неактивная в реакции с нуклеофильным спиртом, поэтому обратная реакция не идет.
O |
+ NaOH H2O R C |
O |
R C |
+ R' OH |
|
O |
R' |
O Na |
Необратимый щелочной гидролиз называют омылением, поскольку этой реакцией с давних пор из животных жиров, которые представляют собой сложные эфиры глицерина и так называемых жирных кислот, получали соли этих кислот, обладающие поверхностной активностью и использовавшиеся в качестве мыла.
2) Аммонолиз
Сложные эфиры при взаимодействии с аммиаком или аминами выступают как ацилирующие агенты. Продуктами этих реакций являются амиды карбоновых кислот, например:

 CH2COOCH3 + NH3
CH2COOCH3 + NH3 
 CH2CNH2 + CH3OH
CH2CNH2 + CH3OH
O
www.mitht.ru/e-library
13
метилфенилацетат фенилацетамид
HCOCH2CH3 + (CH3)2NH  HCN(CH3)2 + CH3CH2OH
HCN(CH3)2 + CH3CH2OH
O O
этилформиат N,N-диметилформамид
3.3. Галогенангидриды
Галогенангидриды карбоновых кислот, или ацилгалогениды, представляют собой производные карбоновых кислот, в которых вместо гидроксильной группы находится атом галогена. Названия галогенопроизводных производятся заменой суффикса и окончания –овая кислота в названии карбоновой кислоты на суффикс –оилгалогенид. Например, хлоранигидрид уксусной кислоты называется этаноилхлорид (или ацетилхлорид), а хлорангидрид 2- метилпентановой кислоты – 2-метилпентаноилхлорид.
Из всех галогенопроизводных карбоновых кислот наибольшее значение имеют хлорангидриды. Их получают из карбоновых кислот действием тионилхлорида или пентахлорида фосфора.
|
|
O |
SOCl2, t |
|
|
O |
||
R |
|
C |
_SO , |
|
|
R |
|
C |
|
|
|
|
|||||
|
|
OH |
2 |
|
|
|
|
Cl |
|
|
|
_HCl |
|
|
|
|
|
|
|
O |
PCl5 |
|
|
|
|
O |
R |
|
C |
_POCl |
, |
R |
|
C |
|
|
|
|||||||
|
|
OH |
_HCl |
3 |
|
|
Cl |
|
Хлорангидриды карбоновых кислот имеют большое значение в органической химии, поскольку они являются сильнейшими ацилирующими агентами, способными ацилировать практически любые нуклеофилы:
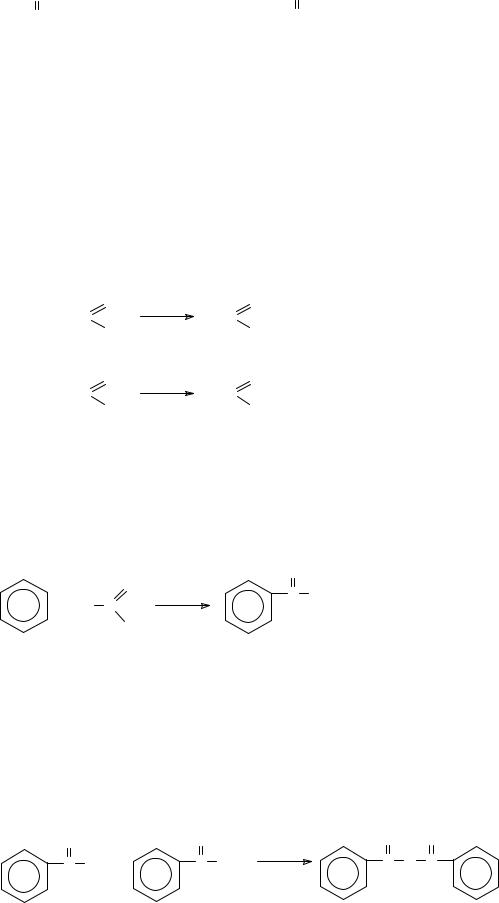
С-нуклеофилы, например, арены в реакциях ацилирования по Фриделю-Крафтсу до ароматических кетонов
O |
|
O |
|
AlCl3 |
C |
R |
|
+ R C |
|
|
+ HCl |
Cl |
|
|
|
О-нуклеофилы, например, воду или гидроксид-анион в реакциях нейтрального или щелочного гидролиза хлорангидридов до карбоновых кислот или их солей, спирты и фенолы или алкоголяты и феноляты до сложных эфиров, соли карбоновых кислот до ангидридов карбоновых кислот. Например, при взаимодействии бензоилхлорида с бензоатом натрия образуется ангидрид бензойной кислоты (бензойный ангидрид).
O |
|
O |
|
O |
|
O |
|
C |
Cl + |
C |
ONa |
C |
O |
C |
+ NaCl |
www.mitht.ru/e-library

14
N-нуклеофилы, например, аммиак или первичные и вторичные амины при получении амидов карбоновых кислот. Так, при ацилировании метиламина пропаноилхлоридом в присутствии основания (например, щелочи) образуется N-метилпропанамид. Щелочь выступает в данной реакции не как катализатор, а как реагент, нейтрализующий выделяющийся хлороводород, который мог бы в противном случае реагировать с метиламином как основанием и дезактивировать его нуклеофильные свойства.
CH3CH2C |
O |
+ CH3NH2 |
NaOH |
CH CH C |
O |
|
Cl |
_NaCl |
NHCH3 |
||||
|
|
3 2 |
||||
|
|
|
_H O |
|
|
|
|
|
|
2 |
|
|
Эта реакция, как и другие реакции ацилирования О- и N-нуклеофилов, протекает по механизму нуклеофильного замещения.
O |
|
O |
|
|
O |
CH3CH2C |
+ NH2CH3 |
CH CH C NHCH |
CH CH C |
+ Cl + H2O |
|
|
|
3 2 |
3 |
3 2 |
|
Cl |
Cl H |
|
|
NHCH3 |
|

 OH
OH
3.4. Ангидриды
Ангидриды карбоновых кислот представляют собой производные карбоновых кислот, в которых два ацильных остатка соединены с атомом кислорода. Различают симметричные и несимметричные (смешанные) ангидриды.
R |
|
C |
|
O |
|
C |
|
R' |
R = R′ |
ангидрид карбоновой кислоты RСООН |
||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
R ≠ R′ |
смешанный ангидрид карбоновых кислот RСООН и R′СООН |
|
|
O |
|
|
O |
|
||||||||
Ангидриды карбоновых кислот получают межмолекулярной дегидратацией карбоновых кислот под действием водоотнимающего средства, например, оксида фосфора (V).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2O5, t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
C |
|
OH + HO |
|
C |
|
R |
R |
|
C |
|
O |
|
C |
|
R |
|||||||||||
|
|
|
|
_ |
H2O |
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
O |
|
|
|
O |
|
|
O O |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Ангидриды можно также получать ацилированием солей карбоновых кислот галогенангидридами. Так, например, при взаимодействии ацетата калия и ацетилхлорида образуется уксусный ангидрид, а реакция бензоата натрия и пропаноилхлоорида приводит к смешанному ангидриду бензойной и пропановой кислот.
CH3 C Cl + |
Na O C CH3 |
CH3 C |
O C |
CH3 |
O |
O |
O |
O |
|
CH3CH2 C Cl |
+ Na O C |
|
CH3CH2 C O C |
|
O |
O |
|
|
O O |
С точки зрения химического поведения ангидриды карбоновых кислот весьма похожи на галогенангидриды и представляют собой сильные ацилирующие агенты. С ними возмож-
www.mitht.ru/e-library

15
но проведение всех реакций ацилирования, которые были рассмотрены для галогенангидридов карбоновых кислот.
3.5. Амиды
Функциональная группа амидов карбоновых кислот состоит из карбонильной группы, сопряженной с аминогруппой. Различают первичные амиды, в которых у атома азота имеются два атома водорода, вторичные амиды, имеющие при атоме азота один углеводородный остаток, и третичные амиды, в молекуле которых атом азота связан с двумя углеводородными остатками.
Названия амидов карбоновых кислот образуют из названия соответствующих карбоновых кислот заменой суффикса –овая кислота на суффикс –амид, указывая в начале названия углеводородные остатки при атоме азота, если они имеются, например:
O
CH3CH2C |
пропанамид (амид пропановой кислоты) |
|
NH2 |
||
|
O
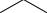
 C
C
 NHCH2CH3 N-этилбензамид (этиламид бензойной кислоты)
NHCH2CH3 N-этилбензамид (этиламид бензойной кислоты)
O
CH3C
NH
N-фенилацетамид (фениламид уксусной кислоты, ацетанилид)
HC |
O |
N,N-диметилформамид (диметиламид муравьиной кислоты) |
 N(CH3)2
N(CH3)2
3.5.1. Способы получения
Первичные амиды получают ацилированием аммиака, при ацилировании первичных аминов получают вторичные амиды, а из вторичных аминов получают третичные амиды. В качестве ацилирующих агентов могут использоваться как карбоновые кислоты, так и их производные – ангидриды, галогенангидриды, сложные эфиры.
При ацилировании карбоновыми кислотами первоначально в результате кислотноосновного взаимодействия образуются соли, которые при нагревании теряют молекулу воды и превращаются в амиды.
O NH |
R' |
O |
|
|
|
O |
R" |
|
|
t |
|||
R C |
R C |
|
R' _ |
R' |
||
|
|
R C |
||||
OH |
|
O |
NH2 |
R" |
H2O |
N |
|
|
|
|
R" |
При ацилировании аммиака или аминов галогенангидридами карбоновых кислот необходим избыток аммиака или амина или какое-либо другое основание для нейтрализации выделяющегося в процессе замещения галогеноводорода. Так, например, при взаимодействии анилина с ацетилхлоридом в присутствии едкого натра получается N-фенилацетамид (ацетанилид).
CH3C |
O |
|
NaOH |
O |
|
+ |
NH2 |
CH3C |
|||
_NaCl |
|||||
|
|||||
|
Cl |
|
_H O |
NH |
|
|
|
|
2 |
|
www.mitht.ru/e-library
16
Для получения первичных амидов может быть использована также реакция частичного гидролиза нитрилов, катализируемая кислотами.
|
|
|
|
|
|
|
|
|
|
|
|
O |
R |
|
C |
|
N |
H2O, H |
|
|
|||||
|
|
|
|
R |
|
C |
||||||
|
|
|||||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
3.5.2.Химические свойства
1)Гидролиз. Как и все производные карбоновых кислот, амиды подвергаются гидролитическому расщеплению до соответствующих карбоновых кислот и аммиака или аминов. Гидролиз может катализироваться как кислотами, так и основаниями, при этом катализатор берется по крайней мере в эквивалентном соотношении к амиду, поскольку он расходуется на кислотно-основное взаимодействие с продуктами гидролиза. Так, например, гидролиз па- ра-нитроацетанилида в присутствии избытка серной кислоты приводит к уксусной кислоте и гидросульфату пара-нитрофениламмония. При щелочном же гидролизе этого амида под действием водного едкого натра образуются пара-нитроанилин и ацетат натрия.
|
H2O |
NH3 HSO4 |
|
+ CH3COOH |
|
|
H2SO4 NO2 |
|
|
|
|
|
NHC CH3 |
|
|
O |
|
NO2 |
H2O |
NH2 + CH3COO Na |
|
NaOH |
|
|
NO2 |
|
2) Дегидратация первичные амидов до нитрилов. При нагревании первичных амидов карбоновых кислот с пентаоксидом фосфора происходит отщепление воды и образование соответствующего нитрила.
|
|
O |
P2O5, t |
|
|
|
|
|
R |
|
C |
R |
|
C |
|
N |
|
|
_H O |
|
|
|||||
|
|
NH |
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
||
3) Восстановление до аминов. При действии на амиды алюмогидрида лития происходит их восстановление до соответствующих аминов.
|
|
O |
LiAlH4 |
|
|
|
|
R' |
R |
|
C R' |
R |
|
CH2 |
|
||
|
|
|
|
N |
||||
|
|
|
|
|||||
|
|
N |
|
|
|
|
|
R" |
|
|
R" |
|
|
|
|
|
|
3.6. Нитрилы
www.mitht.ru/e-library
17
Нитрилы представляют собой производные карбоновых кислот, функциональная группа которых – цианогруппа – не содержит карбонильной группы. Названия нитрилов карбоновых кислот производят от названия соответствующих карбоновых кислот путем замены суффикса –овая кислота на суффикс –нитрил.
CH3C N нитрил уксусной кислоты, или ацетонитрил
N нитрил уксусной кислоты, или ацетонитрил


 C
C N нитрил бензойной кислоты, или бензонитрил
N нитрил бензойной кислоты, или бензонитрил
CH3CH2CHC N нитрил 2-метилбутановой кислоты, или 2-метилбутаннитрил
N нитрил 2-метилбутановой кислоты, или 2-метилбутаннитрил
CH3
Способы получения:
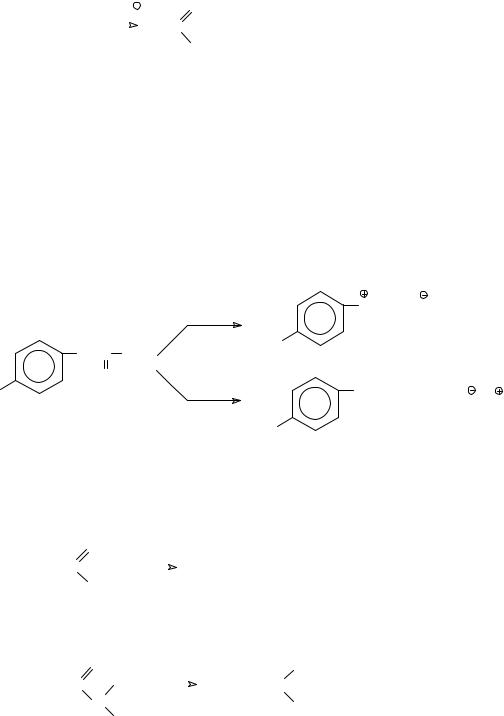
а) алкилирование цианид-аниона галогенопроизводными по механизму SN2
NaC N
N
R X _NaX R C
R C N
N
б) дегидратация первичных амидов с помощью пентаоксида фосфора
|
|
O |
P2O5, t |
|
|
|
|
|
R |
|
C |
R |
|
C |
|
N |
|
|
_H O |
|
|
|||||
|
|
NH |
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
||
Химические свойства:
а) Гидролиз. При нагревании нитрилов с водными растворами сильных минеральных кислот происходит их гидролиз сначала до первичных амидов, которые далее гидролизуются до карбоновых кислот.
H2O, H |
O |
H2O, H |
O |
R C N |
R C |
_NH |
R C |
|
NH2 |
OH |
|
|
4 |
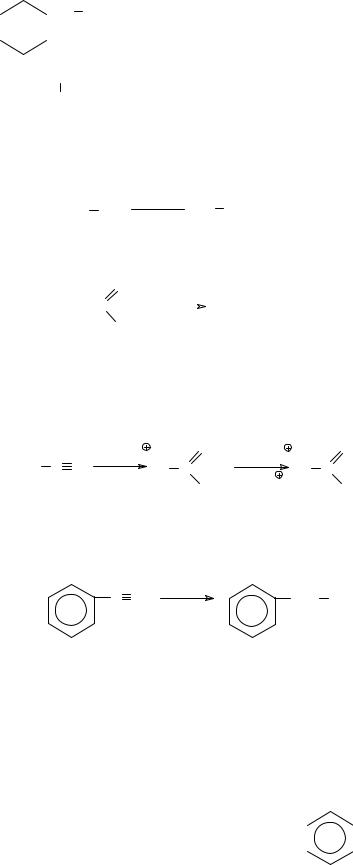
б) Восстановление до первичных аминов. При каталитическом гидрировании нитрилов образуются первичные амины. Например, гидрирование бензонитрила на никелевом катализаторе приводит к бензиламину.
C N 2H2 |
CH2 NH2 |
Ni |
|
4. α,β-Ненасыщенные карбоновые кислоты
Ненасыщенные карбоновые кислоты подразделяются на несопряженные и сопряженные. В сопряженных, или α,β-ненасыщенных карбоновых кислотах двойная связь сопряжена с карбоксильной группой, например:
CH2=CHCOOH CH3CH=CHCOOH
2-пропеновая (акриловая) кислота |
2-бутеновая (кротоновая) кислота |
|||||
CH2 |
|
=CCOOH |
|
|
|
CH=CHCOOH |
|
|
|
|
|||
|
CH3 |
|
|
|
|
|
www.mitht.ru/e-library
18
2-метилпропеновая (метакриловая) кислота
3-фенилпропеновая (коричная) кислота
4.1. Способы получения
Наибольшее практическое значение среди α,β-ненасыщенных карбоновых кислот имеют акриловая и метакриловая кислоты.
Акриловую кислоту и ее важнейшие производные – акрилонитрил, акриламид – получают на основе простейших ненасыщенных углеводородов – ацетилена, этилена и пропилена:
при присоединении к ацетилену циановодорода образуется нитрил акриловой кислоты (акрилонитрил), который сам является важным промышленным продуктом и при гидролизе которого могут быть получены акриламид и акриловая кислота:
CH |
|
CH |
HCN |
CH2=CH |
|
C |
|
N |
H2O |
CH2=CH |
|
CONH2 |
H2O |
CH2=CH |
|
COOH |
||||||||
|
|
|
|
|||||||||||||||||||||
|
CuCl |
|
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|||||||||
образующийся при взаимодействии этилена с хлором в воде этиленхлоргидрин взаимодействием с цианидом калия превращают в этиленциангидрин, который одновременно дегидратируют и гидролизуют при нагревании с водной серной кислотой до акриловой кислоты:
|
Cl2 |
|
KCN |
|
|
|
H SO |
|||
CH2=CH2 |
|
HOCH2CH2Cl |
HOCH2CH2C |
|
N |
2 4 |
CH2=CH |
|
COOH |
|
H2O |
|
|||||||||
|
|
|
|
|||||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
окислением пропилена на различных катализаторах (например, ванадиевых или молибденовых) получают акриловую кислоту (через стадию образования акролеина);
окислительным аммонолизом пропилена на различных катализаторах получают акрилонитрил, который может быть превращен в акриламид и акриловую кислоту:
CH2=CHCH3 O2, NH3 CH2=CH C N
Метакриловую кислоту и ее производные – нитрил, амид, сложные эфиры – получают из ацетона через его циангидрин по следующей схеме:
CH3 |
HCN |
|
|
OH |
H2SO4 |
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|||||
C=O |
CH3 |
|
|
|
|
|
|
|
CH2=C |
|
|
C |
|
N |
|
CH =C |
|
|
CONH |
||||||||
|
C |
|
C |
|
N |
|
|||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H SO |
2 |
|
|
|
|
|
2 |
|
|
|
|
|
CH3 |
|
CH3 |
2 |
4 |
CH3 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
ROH |
|
|
H2SO4 |
H2O |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
CH2=C |
|
COOR |
|
|
CH2=C |
|
COOH |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
|
||||||||||||
4.2. Химические свойства
www.mitht.ru/e-library

19
α,β-Ненасыщенные карбоновые кислоты образуют функциональные производные по карбоксильной группе точно так же, как и насыщенные карбоновые кислоты.
Наличие двойной связи предполагает протекание реакций присоединения, характерных для алкенов, однако электрофильное присоединение затруднено и требует более жестких условий, поскольку двойная связь дезактивирована сопряженной с ней электроноакцепторной карбоксильной группой (–I- и –М-эффекты). Присоединение осуществляется формально против правила Марковникова. Так, например, взаимодействие метакриловой кислоты с хлороводородом приводит к 2-метил-3-хлорпропановой кислоте.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
O |
H |
|
Cl |
|
|
|
|
|
|
O |
|||
|
|
|
|
|||||||||||||
CH2=C |
|
C |
|
|
|
|
|
CH |
|
CH |
|
C |
||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
OH |
|
|
|
|
|
2 |
|
|
|
|
OH |
|
CH |
|
|
|
|
Cl |
|
|
|
|
||||||
|
3 |
|
|
|
|
|
|
CH3 |
||||||||
α,β-Ненасыщенные кислоты являются прекрасными диенофилами – партнерами сопряженных диенов – в реакции диеновой конденсации Дильса-Альдера. Например, при нагревании метилакрилата с 1,3-бутадиеном образуется метиловый эфир 3- циклогексенкарбоновой кислоты.
COOCH3 t 
 COOCH3 +
COOCH3 + 





Промышленное использование α,β-ненасыщенных карбоновых кислот и их производных обусловлено их способностью к полимеризации. Полимеры и сополимеры на основе акрилатов и метакрилатов представляют собой органические стекла, а из полимеров на основе акрилонитрила изготовляют синтетические волокна, имитирующие различные природные волокна, в том числе и шерсть. Полимеризация производных α,β-ненасыщенных карбоновых кислот происходит под действием радикалов (радикальная полимеризация) или металлорганических соединений в качестве катализаторов (анионная полимеризация).
n CH2=CCOOCH3 |
|
|
|
CH |
|
|
CH3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
C |
|
|
|
Полиметилметакрилат |
||||
|
|
|
|
|
|
|||||||
|
|
2 |
|
|
|
|
|
n |
||||
|
CH3 |
|
|
|
|
|
|
COOCH3 |
|
|||
5.Дикарбоновые кислоты
Кдикарбоновым кислотам относятся производные углеводородов, в молекулах которых находятся две карбоксильные группы. Дикарбоновые кислоты бывают насыщенные, ненасыщенные и ароматические. Многие из них имеют тривиальные названия.
НООССООН |
этандиовая, или щавелевая кислота |
|||||||
НООССН2СООН |
пропандиовая, или малоновая кислота |
|||||||
НООССН2СН2СООН |
бутандиовая, или янтарная кислота |
|||||||
НООССН2СН2СН2СООН |
пентандиовая, или глутаровая кислота |
|||||||
НООССН2СН2СН2СН2СООН |
гександиовая, или адипиновая кислота |
|||||||
|
|
|
|
COOH |
|
|
|
COOH |
HOOC |
|
|
|
|
|
|
|
COOH |
|
|
|
|
|||||
www.mitht.ru/e-library

20
транс-2-бутендиовая, |
|
|
цис-2-бутендиовая, |
|
|
|
|
|||
или фумаровая кислота |
|
|
или малеиновая кислота |
|||||||
|
|
|
|
|
|
COOH |
|
COOH |
||
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
COOH |
||||
|
|
|
|
|
|
|||||
1,2-бензолдикарбоновая, |
1,3-бензолдикарбоновая, 1,4-бензолдикарбоновая, |
|||||||||
или фталевая кислота |
или изофталевая кислота |
или терефталевая кислота |
||||||||
5.1. Способы получения
Для создания двух карбоксильных групп в молекулах дикарбоновых кислот можно использовать практически все способы получения карбоновых кислот, рассмотренные ранее. Так, дикарбоновые кислоты можно получать гидролизом цианокарбоновых кислот (мононитрилов дикарбоновых кислот) или динитрилов дикарбоновых кислот. Например, малоновая кислота может быть получена из уксусной кислоты следующей цепочкой превращений:
|
Cl2 |
|
2KCN |
|
H2O, H |
|
CH3COOH |
|
ClCH2COOH |
|
NCCH2COOK |
|
HOOCCH2COOH |
Pкр. |
|
|
||||
|
|
|
|
|
|
|
Хлорирование уксусной кислоты в присутствии красного фосфора прифодит к образованию хлоруксусной кислоты, взаимодействие которой с цианидом калия с целью нуклеофильного замещения атома хлора на цианогруппу дает калиевую соль цианоуксусной кислоты. Последнюю кислотным гидролизом превращают в малоновую кислоту.
Из акриловой кислоты практически аналогично можно синтезировать янтарную ки-
слоту.
CH2=CHCOOH HCl  ClCH2CH2COOH 2KCN
ClCH2CH2COOH 2KCN
 NCCH2CH2COOK H2O, H
NCCH2CH2COOK H2O, H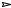 HOOCCH2CH2COOH
HOOCCH2CH2COOH
Используются для получения дикарбоновых кислот и реакции окисления, известные как способы получения монокарбоновых кислот, такие как окисление первичных спиртов, альдегидов и кетонов. Так, например, при окислении таких диолов как этиленгликоль и 1,4- бутандиол получаются щавелевая и янтарная кислоты, соответственно, а окислением циклогексанола или циклогексанона концентрированной азотной кислотой синтезируют адипиновую кислоту.
OH O
COOH
HNO3 HNO3 (CH2)4
(CH2)4
COOH
www.mitht.ru/e-library
