
Краткий курс органической химии. Часть 4
.pdf
21
Окислением бензола и нафталина получают малеиновую и фталевую кислоты или их ангидриды.
O2, V2O5  COOH
COOH
COOH COOH
O2, V2O5 

COOH
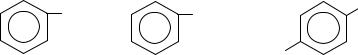
Кроме того, все бензолдикарбоновые кислоты можно получить окислением соответствующих ксилолов перманганатом калия, например, терефталевую кислоту – окислением параксилола.
CH3 COOH
KMnO4 
CH3 COOH
5.2. Свойства дикарбоновых кислот
По химическим свойствам дикарбоновые кислоты очень похожи на монокарбоновые кислоты. Однако наличие двух карбоксильных групп придает некоторую специфику этому классу.
Дикарбоновые кислоты, в которых карбоксильные группы расположены достаточно близко друг к другу, проявляют более сильные кислотные свойства, чем монокарбоновые кислоты, за счет электроноакцепторного воздействия карбоксильных групп друг на друга. Так, например, рКа щавелевой кислоты составляет 1,27, малоновой – 2,86, янтарной и глутаровой кислот – 4,21 и 4,34, соответственно.
Дикарбоновые кислоты в зависимости от расстояния между карбоксильными группами по-разному ведут себя при нагревании. Щавелевая и малоновая кислоты подвергаются декарбоксилированию с образованием муравьиной и уксусной кислот, соответственно.
HOOC |
|
COOH |
|
_ |
t |
H |
|
COOH |
|
|
|
CO2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
HOOCCH2COOH |
|
t |
|
CH3COOH |
|||||
|
_ CO2 |
|
|||||||
При более отдаленном расположении карбоксильных групп для соответствующих дикарбоновых кислот возникает возможность внутримолекулярной дегидратации с образованием циклических ангидридов. Это происходит, однако, только тогда, когда образующийся цикл является устойчивым. Поэтому такое поведение при нагревании характерно для таких дикарбоновых кислот, ангидриды которых являются пятиили шестичленными циклическими соединениями, например, для янтарной и глутаровой кислот.
|
|
|
|
|
|
O |
CH2 |
|
COOH |
t |
|
O |
|
|
|
|||||
|
|
|
COOH |
_ H O |
|
|
CH |
|
|||||
|
|
|
|
|||
2 |
|
|
2 |
|
|
|
www.mithtO .ru/e-library

22
янтарный ангидрид
CH2 |
|
|
COOH |
|
|
|
O |
|
|
|
t |
|
|
O глутаровый ангидрид |
|||
|
|
|
|
|||||
|
|
|
|
|||||
CH2 |
|
|
_ H O |
|
|
|||
CH2 |
|
|
COOH |
2 |
|
|
O |
|
|
|
|
|
|||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
По отношению к нагреванию можно различить изомерные малеиновую и фумаровую кислоты. Первая при нагревании отщепляет воду и превращается в малеиновый ангидрид, а вторая из-за транс-расположения карбоксильных групп не способна к такой дегидратации, и с ней при нагревании не происходит никакого химического превращения.
|
|
COOH |
|
|
O |
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
t |
|
|
O |
|
|
|
t |
|
|
|
|
|
|
|
|
|||
|
|
|
_ H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC |
|
|||
|
|
COOH |
|
|
O |
|
||||
|
|
|
|
|
|
|
|
|
|
|
малеиновая |
малеиновый |
фумаровая кислота |
|
|||||||
кислота |
|
ангидрид |
|
|
|
|
||||
Из бензолдикарбоновых кислот только фталевая кислота подвергается дегидратации при нагревании.
COOH |
O |
|
|
t |
O |
_ H2O |
|
COOH |
O |
|
фталевый ангидрид
5.3. Малоновый эфир
Из производных дикарбоновых кислот особое значение имеет диэтиловый эфир малоновой кислоты, который часто называют просто малоновым эфиром. Малоновый эфир получают реакцией этерификации малоновой кислоты с этиловым спиртом.
|
COOH |
H |
|
|
|
|
COOC2H5 |
|
|
|
|
|
|
||||
CH2 |
+ 2C2H5OH |
|
|
|
|
|
CH2 |
+ 2H2O |
|
|
|
|
|
||||
|
|
|
|
|
||||
|
COOH |
|
|
|
|
|
|
COOC2H5 |
Малоновый эфир применяют в синтезе многих органических соединений, в том числе и карбоновых кислот, используя при этом его С-Н-кислотные свойства, а также способность малоновой кислоты к декарбоксилированию.
Малоновый эфир является достаточно сильной С-Н-кислотой, поскольку сопряженное ему основание стабилизировано двумя сложноэфирными группами, проявляющими –М- эффект. Депротонировать малоновый эфир можно различными основаниями, например, этилат натрия превращает его в так называемый натрмалоновый эфир.
|
|
OC2H5 |
OC H |
OC2H5 |
|
|
COOC2H5 C2H5ONa |
C O |
2 |
5 |
|
CH2 |
C O |
|
C O |
||
COOC H _C2H5OH |
Na CH |
CH |
|
CH |
|
|
2 5 |
C O |
|
|
C O |
|
|
www.mitht.ru/e-libraryC O |
|
||
|
|
OC2H5 |
OC H |
OC2H5 |
|
|
|
|
2 |
5 |
|

23
Натрмалоновый эфир представляет собой С-нуклеофил, который может быть подвергнут алкилированию с помощью алкилгалогенида по механизму SN2 с образованием алкилзамещенного малонового эфира. Этот эфир кислотным гидролизом переводят в алкилзамещенную малоновую кислоту, при нагревании которой в результате декарбоксилирования образуется карбоновая кислота, которую можно рассматривать как алкилзамещенную уксусную кислоту.
|
|
|
|
|
|
|
|
COOC2H5 R |
|
X |
|
|
|
|
COOC2H5 |
|
H2O, H |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Na CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
_NaX |
R CH |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
COOC H |
|
COOC H |
_ |
2C H OH |
||||||||||||||||||
2 5 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
5 |
|
2 |
5 |
|
|
|
|
||
|
|
|
|
|
|
|
|
R |
|
CH |
COOH |
t |
R |
|
CH2COOH |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
COOH |
_CO |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Поскольку алкизамещенный малоновый эфир содержит еще один подвижный атом водорода, то процесс алкилирования можно повторить и получить диалкилзамещенный малоновый эфир. При этом алкилировать можно как тем же алкилгалогенидом, так и другим. В результате после гидролиза и декарбоксилирования можно получить дизамещенную уксусную кислоту. Например, 2-метилбутановую кислоту можно получить из малонового эфира, проалкилировав его дважды – сначала метилгалогенидом, а потом этилгалогенидом.
|
|
COOC2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
COOC2H5 |
|
|
|
|
|
|
|
|
|
|
COOC H |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
C H ONa |
|
|
|
|
|
|
|
|
CH I |
2 |
|
5 |
C H ONa |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
Na CH |
|
|
|
|
3 |
|
CH |
|
CH |
|
2 5 |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_NaI |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
COOC2H5 |
|
|
_C H OH |
|
|
|
|
COOC2H5 |
3 |
|
|
|
COOC2H5 C2H5OH |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
2 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
COOC2H5 |
C H Br |
CH CH |
COOC2H5 |
H O, H |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
CH3 |
|
C |
|
|
|
|
2 |
5 |
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
_NaBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
_ |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
COOC H |
|
|
H OH |
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
Na |
|
|
|
|
|
2 5 |
|
|
|
|
|
|
|
|
|
COOC2H5 |
2C2 5 |
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
CH3CH2 |
COOH |
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
CH |
C |
|
|
|
_CO |
|
CH3CH2 |
|
CH |
|
COOH |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
COOH |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
6. Задачи и упражнения
1.Назовите по систематической номенклатуре следующие соединения: а) изомасляная кислота; б) фенилуксусная кислота; в) адипиновая кислота; г) хлорангидрид изовалериановой кислоты; д) диметиловый эфир янтарной кислоты; е) нитрил коричной кислоты.
2.Напишите формулы следующих соединений: а) 2-метилбутановая кислота; б) метилбутаноат; в) этаноилбромид; г) бензамид; д) ангидрид глутаровой кислоты; е) N-фенил-3- метилгексанамид; ж) фенилбензоат; з) 2-бутеннитрил; и) бензойный ангидрид; к) N,N- диметилформамид; л) 2-хлор-3-метилпентаноилбромид; м) фенилацетонитрил.
www.mitht.ru/e-library
24
3.Приведите все способы синтеза уксусной кислоты, основанные на реакциях окисления различных соединений.
4.Превратите этилхлорид в пропановую кислоту двумя различными способами: а) через ее нитрил и б) с помощью реакции Гриньяра.
5.Используя реакцию Гриньяра с диоксидом углерода получите: а) бензойную кислоту; б) масляную кислоту; в) фенилуксусную кислот; г) изомасляную кислоту.
6.Получите из толуола бензойную кислоту и превратите ее в этил-мета-нитробензоат.
7.Изобразите механизм взаимодействия пропановой кислоты с метанолом в присутствии серной кислоты.
8.Используя только этилен в качестве единственного органического реагента, получите этилацетат и напишите для него уравнения следующих реакций: а) с водой в кислой среде; б) с водным раствором едкого натра; в) с аммиаком. Приведите механизмы реакций
«а» и «б».
9.Из толуола получите пара-нитробензоилхлорид и напишите для него уравнения реакций со следующими реагентами: а) водный раствор едкого натра; б) анилин в присутствии карбоната натрия; в) фенол; г) изопропиловый спирт; д) толуол в присутствии трихлорида алюминия; е) пара-нитробензоат натрия.
10.Из малонового эфира получите: а) 3-фенилпропановую кислоту; б) валериановую кислоту; в) изомасляную кислоту.
11.Из малонового эфира получите изовалериановую кислоту и превратите ее в следующие соединения: а) метил-3-метилбутаноат; б) 3-метилбутаноилхлорид; в) N-фенил-3- метилбутанамид; г) нитрил изовалериановой кислоты.
12.Предложите схемы следующих превращений: а) этилен → диэтилэтандиоат (диэтилоксалат); б) бензол → терефталевая кислота; в) пропановая кислота → 2- метилпропандиовая кислота; г) орто-ксилол → фталевый ангидрид.
www.mitht.ru/e-library
25
АМИНЫ
Амины – это органические производные аммиака, в которых атом азота может быть связан только с углеводородными остатками и атомами водорода. В зависимости от того, сколько углеводородных остатков связано с атомом азота, амины подразделяются на первичные, вторичные и третичные.
|
|
|
|
|
|
|
|
|
|
R' |
|||
R |
|
NH2 |
R |
|
NH |
|
R' |
R |
|
|
|
|
|
|
|
|
|
N |
|
R" |
|||||||
|
|
|
|
|
|||||||||
первичные |
вторичные |
третичные |
|||||||||||
амины |
амины |
амины |
|||||||||||
В зависимости от строения углеводородных остатков, с которыми связан атом азота, амины подразделяют также на алифатические и ароматические. В ароматических аминах атом азота присоединен непосредственно к атому углерода ароматического кольца.
Первичные, вторичные и третичные амины простого строения называют по ради- кально-функциональной номенклатуре, добавляя окончание -амин к названию углеводородного остатка; в случае симметричных вторичных и третичных аминов к названию углеводородного остатка прибавляют приставку ди- или три-. Несимметричные вторичные и третичные амины называют, как симметрично замещенные амины, располагая углеводородные остатки в алфавитном порядке или как N-замещенные первичные амины. В последнем случае в качестве такого первичного амина выбирают наиболее сложный углеводородный остаток:
CH3CH2 |
|
NH2 |
|
|
|
CH3 |
|
NH |
|
CH3 |
CH3 |
|
NH |
|
CH2CH3 |
CH3 |
|
N |
|
CH2CH2CH3 |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2CH3 |
|||
этиламин |
|
|
|
диметиламин |
метилэтиламин |
метилэтилпропиламин |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(N-метилэтиламин) (N-метил-N-этилпропиламин) |
||||||||||
Амины более сложной структуры называют, прибавляя окончание -амин к названию |
|||||||||||||||||||||||||||
родоначального углеводорода: |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
CH3CH2 |
CH |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
C |
|
CH2CH3 |
3,4-диметил-3-гексанамин |
|||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
CH3 NH2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
CH3 |
CH |
|
CH=CH |
|
CH3 |
N-этил-3-пентен-2-амин |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
NHCH2CH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Простейший ароматический амин (бензоламин или фениламин) имеет тривиальное название анилин, которое сохраняется и в названиях замещенных ароматических аминов.
NH2 |
NHCH3 |
NH2 |
|
||
|
|
CH3 |
анилин |
N-метиланилин |
пара-метиланилин (пара-толуидин) |
www.mitht.ru/e-library

26
1. Способы получения
1.1. Восстановление азотсодержащих соединений
Как алифатические, так и ароматические нитросоединения можно восстановить до соответствующих первичных аминов:
[H]
R NO2  R NH2
R NH2
В качестве восстановителей могут быть использованы самые разнообразные вещества. Так, классический способ получения анилина по Зинину – это восстановление нитробензола сульфидом натрия. В настоящее время в промышленности анилин получают каталитическим гидрированием нитробензола:
NO2 NH2
H2, Ni
В лабораторных условиях удобнее восстанавливать нитросоединения водородом в момент выделения, т.е. использовать в качестве восстановительной системы достаточно активный металл в кислой среде. Например, анилин получают действием на нитробензол олова в соляной кислоте. Образующийся при восстановлении анилин в кислой реакционной среде существует в виде солянокислой соли, которую по завершении реакции переводят в анилин действием щелочи.
NO2 |
NH3 Cl |
NH2 |
Sn, HCl |
|
NaOH |
|
|
_NaCl |
хлорид фениламмония
Кроме нитросоединений первичные амины могут быть получены восстановлением таких производных альдегидов и кетонов, как оксимы, гидразоны и имины.
R |
C=N |
|
|
OH |
|
|
|
|
|
||
R' |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||
R |
|
|
|
|
|
|
|
H , Ni |
R |
||
|
|
2 |
|
|
|
||||||
R' |
C=N |
|
NH2 |
|
|
R' CH |
|
NH2 |
|||
|
|
|
|
||||||||
|
|
|
|
|
|||||||
R |
C=NH |
|
|
|
|
|
|
||||
R' |
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
Альдегиды и кетоны могут быть превращены в первичные амины в одну стадию восстановительным аминированием – действием аммиака и водорода на никелевом катализаторе.
NH3, H2
R C R'  R CH R'
R CH R'
O
 Ni NH2
Ni NH2
www.mitht.ru/e-library
27
Нитрилы карбоновых кислот восстанавливаются в условиях каталитического гидрирования до первичных аминов.
2H2, Ni
R C N
N  R CH2 NH2
R CH2 NH2
Амиды карбоновых кислот восстанавливаются алюмогидридом лития до соответст-
вующих аминов (первичных, вторичных, третичных):
|
|
|
|
|
|
R' LiAlH4 |
|
|
|
|
|
R' |
|
R |
|
C |
|
N |
|
R |
|
CH |
|
N |
|
||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
R" |
2 |
|
|
R" |
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
O |
|
|
|
|
|
|
|||||
1.2. Алкилирование аммиака и аминов
Первичные амины могут быть получены алкилированием аммиака как нуклеофила. В качестве алкилирующих реагентов обычно используются галогенопроизводные. При взаимодействии алкилгалогенида с аммиаком образуется галогенид алкиламмония, который в избытке аммиака депротонируется до свободного амина.
NH3 |
|
NH3 |
|
R X |
R NH3 _NH X |
R NH2 |
|
|
X |
4 |
|
|
|
|
|
Вторичные амины синтезируют алкилированием первичных аминов галогенопроизводными. Так, например, N-метиланилин можно получить действием на анилин метилиодида с последующей обработкой образующегося иодида метилфениламмония едким натром.
|
|
|
NH2 CH3I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
NH2 |
|
CH3 |
NaOH |
|
|
|
NH |
|
CH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
_NaI |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_H O |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
Третичные амины можно получить аналогичным образом из вторичных аминов, на- |
||||||||||||||||||||||||||
пример: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH3CH2NHCH3 + |
|
|
CH2Br |
|
|
NaOH |
|
|
|
CH2NCH2CH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NaBr + H2O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
метилэтиламин |
|
|
|
|
|
N-метил-N-этилбензиламин |
|||||||||||||||||||||
2. Химические свойства
2.1. Основность аминов
Как и аммиак, амины проявляют основные свойства благодаря тому, что на атоме азота имеется необходимая для присоединения протона неподеленная пара электронов.
R N R' |
H A |
H |
|
R N R' A |
|||
|
|||
R" |
|
R" |
www.mitht.ru/e-library
28
Электроотрицательность атома азота не столь высока, как у атома кислорода, поэтому основность аминов выше по сравнению со спиртами или фенолами.
Основность аминов зависит от электронной плотности на атоме азота. Алифатические амины проявляют более сильные основные свойства, чем аммиак, поскольку алкильные группы являются более сильными донорами электронов по сравнению с атомом водорода. По этой же причине вторичные амины более основны, чем первичные. Ароматические амины как основания являются более слабыми, чем алифатические амины, из-за сопряжения неподеленной пары электронов атома азота с π-электронной системой ароматического кольца. Так, основность анилина ниже, чем основность циклогексиламина, а дифениламин уступает по основности анилину, поскольку в этом случае наблюдается сопряжение неподеленной пары электронов атома азота уже с двумя бензольными остатками.
NH |
NH2 |
NH |
< |
|
2 |
|
< |
Заместители в ароматическом кольце влияют на основность ароматического амина. Электронодонорные заместители повышают основность, так как через бензольное ядро увеличивают электронную плотность на атоме азота. Электроноакцепторные заместители, наоборот, понижают основные свойства ароматических аминов. Так, в ряду пара-толуидин, анилин, пара-нитроанилин основность уменьшается, поскольку метильная группа в пара- толуидине является электронодонорным заместителем (+I-эффект), а нитрогруппа – электроноакцепторным заместителем (–I- и –М-эффекты).
NH2 |
NH2 |
NH2 |
> |
> |
|
CH3 |
O |
N |
|
|
O |
При взаимодействии аминов с сильными кислотами образуются аммониевые соли. Так, анилин, который плохо растворяется в воде, растворяется в соляной кислоте, поскольку при этом он превращается в хлорид фениламмония (или солянокислый фениламмоний), хорошо растворимый в воде, как и многие ионные соединения.
NH2 |
HCl |
NH3 Cl |
|
|
хлорид фениламмония
2.2. Амины как нуклеофилы
2.2.1. Алкилирование и ацилирование аминов
Как нуклеофилы, амины могут реагировать с реагентами, имеющими электрофильные центры. При этом могут протекать как реакции замещения, так и реакции присоединения. Взаимодействиями первого типа являются реакции алкилирования и ацилирования аминов.
www.mitht.ru/e-library
29
При алкилировании аминов галогенопроизводными углеводородов реакция может идти по одному из известных механизмов нуклеофильного замещения. В результате образуется соль аммония, которую можно перевести в «свободный» амин действием основания (см. способы получения аминов). Так, алкилированием первичного амина можно получить вторичный амин, алкилированием вторичного амина – третичный, а при алкилировании третичного амина образуется четвертичная соль аммония. Например, взаимодействием бензиламина с этилбромидом получают Ν-этилбензиламин, а последовательное метилирование метиламина с помощью метилиодида приводит к иодиду тетраметиламмония в качестве конечного продукта. Этот же продукт можно получить и при взаимодействии метиламина с тремя эквивалентами метилиодида.
|
CH2NH2 CH CH Br |
CH2NH2CH2CH3 NaOH |
CH2NHCH2CH3 |
||
|
|
3 |
2 |
||
|
|
|
|
Br |
|
|
|
|
бромид бензилэтиламмония |
|
|
CH |
NH |
3CH3I |
|
CH3 |
|
CH |
N CH I |
|
|||
3 |
2 |
3 |
3 |
|
|
CH3
иодид тетраметиламмония
Ацилирование аминов до амидов карбоновых кислот осуществляют такими производными карбоновых кислот, как галогенангидриды и ангидриды. Например, взаимодействием пропиламина с бензоилхлоридом в присутствии щелочи получают Ν-пропиламид бензойной кислоты (Ν-пропилбензамид), а реакция анилина с ангидридом уксусной кислоты приводит к Ν-фенилацетамиду.
CH CH CH NH |
+ |
C Cl |
NaOH |
C NHCH2CH2CH3 |
3 2 2 2 |
O |
_NaCl |
||
|
|
O |
||
NH2 |
|
O |
|
|
|
CH3C |
NHCCH3 |
+ CH3COOH |
|
+ |
|
O |
O |
|
|
|
CH3C |
|
|
|
|
O |
|
|
2.2.2. Взаимодействие первичных и вторичных аминов с альдегидами и кетонами
С альдегидами и кетонами первичные и вторичные амины реагируют по механизму нуклеофильного присоединения. С первичными аминами образуются азометины (основания Шиффа):
|
O |
H |
OH |
|
|
|
R C=O |
R" NH2 R C |
N R" |
R C N R" |
_ |
H2O |
R C=N R" |
R' |
R' H |
R' H |
|
R' |
||
www.mitht.ru/e-library
30
Так, например, анилин реагирует с бензальдегидом с образованием безилиденанили-
на.
NH2 |
CH=O |
N=CH |
|
+ |
_H O |
|
|
|
|
|
2 |
Вторичные амины с альдегидами и кетонами, имеющими атом водорода в α- положении, дают аддукт, который стабилизируется также в результате дегидратации, однако, поскольку при атоме азота в этом аддукте нет атома водорода, происходит отщепление воды с образованием двойной связи между бывшим карбонильным атомом углерода и α-атомом углерода. Такие продукты называют енаминами. Рассмотрим эту реакцию на примере взаимодействия циклогексанона с диметиламином с образованием 1-(Ν,Ν- диметиламино)циклогексена.
H |
H |
H |
|
H |
|
|
O |
|
OH |
|
|
O NH(CH3)2 |
|
N |
|
N(CH3)2 |
N(CH3)2 |
|
|
CH |
|
_H2O |
|
|
|
CH3 |
3 |
|
|
2.2.3. Взаимодействие аминов с азотистой кислотой
Взаимодействие аминов с азотистой кислотой осуществляют, действуя на амины нитритом щелочного металла в кислой среде, чаще всего в соляной кислоте. При этом используется избыток кислоты, необходимый для образования электрофильной частицы – нитрозилкатиона, который и реагирует с амином, находящимся в равновесии с его протонированной формой.
Первичные алифатические амины реагируют с нитритом натрия в избытке соляной кислоты по механизму, который можно рассмотреть на конкретном примере пропиламина.
|
|
HCl |
H |
|
|
NaNO2 + HCl |
HONO |
HO N=O |
N=O |
||
_Cl |
|||||
|
|
|
_H2O |






 N=O
N=O 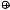














 CH3CH2CH2 NH2
CH3CH2CH2 NH2 





 CH3CH2CH2 NH2 N=O
CH3CH2CH2 NH2 N=O  _H
_H  CH3CH2CH2 NH N=O
CH3CH2CH2 NH N=O
Образовавшийся при взаимодействии амина с нитрозил-катионом Ν- нитрозопропиламин находится в равновесии с его таутомером (таутомеры – структурные изомеры, находящиеся в динамическом равновесии и превращающиеся друг в друга в результате перемещения какого-либо атома или группы атомов, чаще всего – атома водорода, см. Альдегиды и кетоны), из которого после протонирования и отщепления воды образуется катион пропилдиазония, чрезвычайно неустойчивый, как и все алифатические диазониевый катионы.



















 H
H 






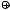 CH3CH2CH2 NH N=O
CH3CH2CH2 NH N=O 
 CH3CH2CH2 N=N
CH3CH2CH2 N=N
 OH
OH 
 CH3CH2CH2 N=N
CH3CH2CH2 N=N
 OH2
OH2
CH CH CH N=N |
CH3CH2CH2 N N |
CH3CH2CH2 |
3 2 2 |
|
_N2 |
www.mitht.ru/e-library
